基于金納米顆粒/碳化氮-金屬有機框架材料Cd-MOFs-74的C-反應蛋白免疫傳感器的研制
趙瀟瀾, 謝發婷, 遲寬能, 楊云慧, 胡 蓉
(云南師范大學化學化工學院,云南昆明 650500)
快速、可靠地檢測生物標志物在疾病的診斷中起著至關重要的作用。C-反應蛋白(CRP)是炎性淋巴因子(白介素-6IL-6、白介素-1IL-1、腫瘤壞死因子TNF)在肝細胞和上皮細胞中合成的急性期炎性蛋白。血清中CRP含量異常被證明與許多疾病有關,包括細菌或病毒感染的腦膜炎、心血管疾病(高血壓、高血脂等)、骨髓炎、新冠肺炎、冠心病等[1 - 4]。臨床上可通過分析CRP濃度對患心血管疾病的風險進行評估[5]。因此,發展CRP的定量分析方法對于預測心血管疾病發生的可能性具有重要意義。目前臨床上檢測CRP的方法主要是比濁法[6]、局部表面等離子體共振[7]、酶聯免疫分析[8]和熒光法[9]等。但這些方法大多數具有儀器價格昂貴、靈敏度低等缺點。電化學生物傳感器具有簡單、靈敏度高和易于操作等優點[10],可用于實時檢測抗原-抗體反應[11],在臨床診斷、食品安全、食品質量、生物學分析和環境監測中得到了廣泛的應用[12]。
金屬有機框架材料(MOFs)是近十年來迅速發展的一種具有三維孔結構的配位聚合物。目前MOFs在催化[13]、儲能[14]、生物傳感[15]和分離[16]等多個領域都有廣泛的應用。碳化氮作為一種新型富氮的類石墨相二維碳納米材料,具有優良的半導體特性,已被廣泛運用于催化[17]、光電[18]、電池[19]等諸多領域。本實驗基于金納米顆粒/碳化氮(Au NPs@C3N4)與多孔框架材料Cd-MOF-74,構建了一種新的夾心型免疫傳感器用于CRP的定量檢測。用Au NPs@C3N4提供大的比表面積,用于固定CRP抗體(anti-CRP),可以提高傳感器的靈敏度。多孔有機框架材料Cd-MOF-74為信號標簽,通過檢測MOFs材料中Cd2+的信號,構建了夾心型免疫傳感器實現對CRP的定量檢測。之前的報道中,我們將Fe-MIL-88作為信號標簽時只檢測到MOFs中的配體峰[20],并未檢測到離子峰,但以Cd-MOF-74作為信號標簽時,既檢測到MOFs中的配體峰也檢測到Cd2+的峰,且離子峰的信號更強。該免疫傳感器在與CRP相關的疾病監測和臨床診斷的生物學應用中顯示出巨大的潛力。
1 實驗部分
1.1 儀器和試劑
電化學工作站(CHI650E,上海辰華儀器公司);真空干燥箱(DZF-6020,上海博訊實驗有限公司);電子分析天平(ME104E,德國賽多利斯集團);透射電鏡(JEM 2100,日本電子株式會社);高速冷凍離心機(TGL16,長沙湘智離心機儀器有限公司);超聲波清洗機(ST2200HP,上海科導超聲儀器有限公司)。
CRP、anti-CRP(上海領潮生物科技有限公司);0.01 mol/L磷酸鹽緩沖溶液(PBS,0.138 mol/L NaCl,pH=7.4)(Solarbio公司);2,5-二羥基對苯二甲酸(DHTA)、CdAc2·2H2O(上海阿拉丁試劑有限公司);牛血清蛋白(BSA,廣州賽國生物科技有限公司);檸檬酸三鈉(盛奧化學試劑有限公司);HAuCl4(國藥集團化學試劑有限公司);檸檬酸(廣東西隴化工廠);冰HAc、無水乙醇、甲醇(廣東光華科技股份有限公司);N,N-二甲基甲酰胺(DMF,風船化學試劑有限公司);類石墨相碳化氮(C3N4,先豐納米材料科技有限公司);Na2HPO4·12H2O(盛奧化學試劑有限公司);無水NaAc(上海麥克林生化科技有限公司);人反應C蛋白ELISA試劑盒(上海江萊科技有限公司)。所用試劑均為分析純,水為去離子水。
1.2 材料制備
1.2.1 Au NPs的合成參照文獻方法[21],將50 mL去離子水與500 μL 1%HAuCl4加入到100 mL圓底燒瓶中,加熱攪拌至沸騰后,立即加入1.75 mL 1%的檸檬酸三鈉溶液,在沸騰狀態下持續攪拌直至溶液變為酒紅色,冷卻至室溫后,于4 ℃避光保存。
1.2.2 Au NPs@C3N4的制備將0.05 g C3N4超聲分散于20 mL的滅菌水中,在不斷攪拌的條件下滴加20 mL Au NPs,室溫攪拌48 h。以8 000 r/min的轉速離心3 min,滅菌水洗滌3次,最終分散于5 mL的滅菌水中,4 ℃避光保存。
1.2.3 Cd-MOF-74的合成參照文獻報道的方法[22],稱取0.4 g DHTA超聲分散于10 mL DMF中得到A液;稱取1.398 g CdAc2·2H2O分散于30 mL DMF中得到B液。將A液緩慢滴加至B液中,并超聲30 min。而后將混合液轉移至反應釜中,在125 ℃反應20 h,待反應結束且冷卻至室溫后,抽濾,DMF和甲醇分別洗滌3次(10 mL×3)。抽濾產物用甲醇浸泡一周,每隔24 h更換一次,7 d后抽濾得到產物,于60 ℃真空干燥12 h,得到黃色晶體。
1.2.4 Au NPs@Cd-MOF-74的制備將15 mL合成的Au NPs逐滴加入分散于25 mL滅菌水的0.1 g Cd-MOF-74中,攪拌12 h。離心,滅菌水洗滌3次,分散于4 mL滅菌水中,4 ℃保存備用。
1.2.5 Au NPs@Cd-MOF-74標記anti-CRP取400 μL合成的Au NPs@Cd-MOF-74,加入600 μL滅菌水,搖振均勻。再取10 μL 1 mg/mL anti-CRP,按2 μL/times間隔3 min加入,于4 ℃振搖2 h。而后加入25 μL 10%BSA,4 ℃繼續振搖30 min。以4 000 r/min低溫離心6 min,并用0.01 mol/L PBS洗滌2次,最終分散于1 mL PBS中,4 ℃保存備用。
1.3 免疫傳感器的制備
玻碳電極(GCE,d=3 mm)用砂紙打磨,再在麂皮上用不同粒徑的Al2O3粉末進行拋光。而后依次用HNO3(1∶1)、無水乙醇和去離子水各超聲3 min后晾干。將合成的Au NPs@C3N4分散液與5%Nafion溶液按體積比1∶1混合,取10 μL混合液滴加到GCE表面,自然晾干,再滴加anti-CRP,于4 ℃過夜。將電極取出用PBS沖洗去除未結合的anti-CRP后,晾干,滴加1%BSA(10 μL),于37 ℃下封閉非特異性結合位點1 h。而后將電極取出沖洗、晾干,再滴加不同濃度的抗原于37 ℃恒溫培育1 h,PBS沖洗、晾干后,最后滴加10 μL Au NPs@Cd-MOF-74標記的anti-CRP,37 ℃培育1 h。夾心型電化學免疫傳感器制備流程如圖1所示。
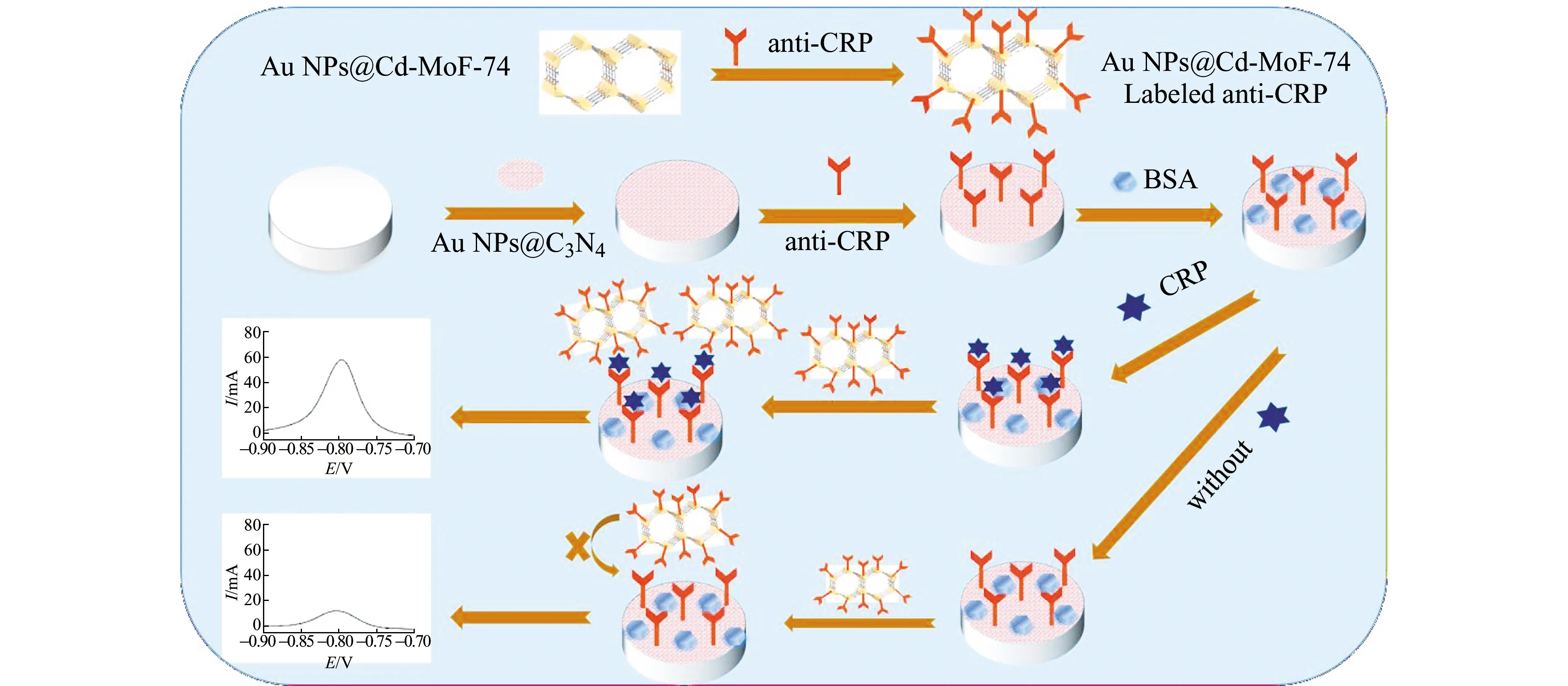
圖1 夾心型電化學免疫傳感器的原理及制備Fig.1 The principle of sandwich electrochemical immunosensor
1.4 電化學測量
采用差分脈沖伏安法(DPV),在-0.7至-0.9 V電位范圍內進行測量;交流阻抗在1 Hz至100 kHz的頻率范圍內進行測量。
2 結果與討論
2.1 材料表征
2.1.1 微觀形貌本文通過掃描電鏡圖(SEM)和透射電鏡圖(TEM)表征C3N4、Au NPs@C3N4、Cd-MOF-74及Au NPs@Cd-MOF-74的微觀形貌。由圖2A可見,C3N4是一種片層狀的材料。Au NPs與C3N4混合均勻后,Au NPs吸附于C3N4表面得到Au NPs@C3N4復合物。如圖2B所示,Au NPs均勻的分散在C3N4上。圖2C則顯示出Cd-MOF-74為典型的棒狀結構,與先前文獻的報道結果吻合[22]。當Cd-MOF-74吸附Au NPs后,其尺寸縮小且結構松散呈碎石狀(圖2D)。從圖2E可見,Au NPs在Cd-MOF-74上分散均勻,說明Au NPs@Cd-MOF-74合成成功。

圖2 C3N4(A)和Au NPs@C3N(B)的透射電鏡(TCM)圖,Cd-MOF-74(C)和Au NPs@Cd-MOF-74(D)的掃描電鏡(SEM)圖,Au NPs@Cd-MOF-74的TEM圖(E)Fig.2 TEM images of C3N4(A) and Au NPs@C3N4(B),the SEM images of Cd-MOF-74(C) and Au NPs@Cd-MOF-74(D),the TEM image of Au NPs@Cd-MOF-74(E)
2.1.2 X射線衍射表征本實驗采用X射線衍射(XRD)對合成的Cd-MOF-74的晶體結構進行表征,并與標準譜圖進行比對。圖3顯示在2θ為7°與12°的峰與文獻報道[22]一致,表明多孔有序的Cd-MOF-74成功合成。
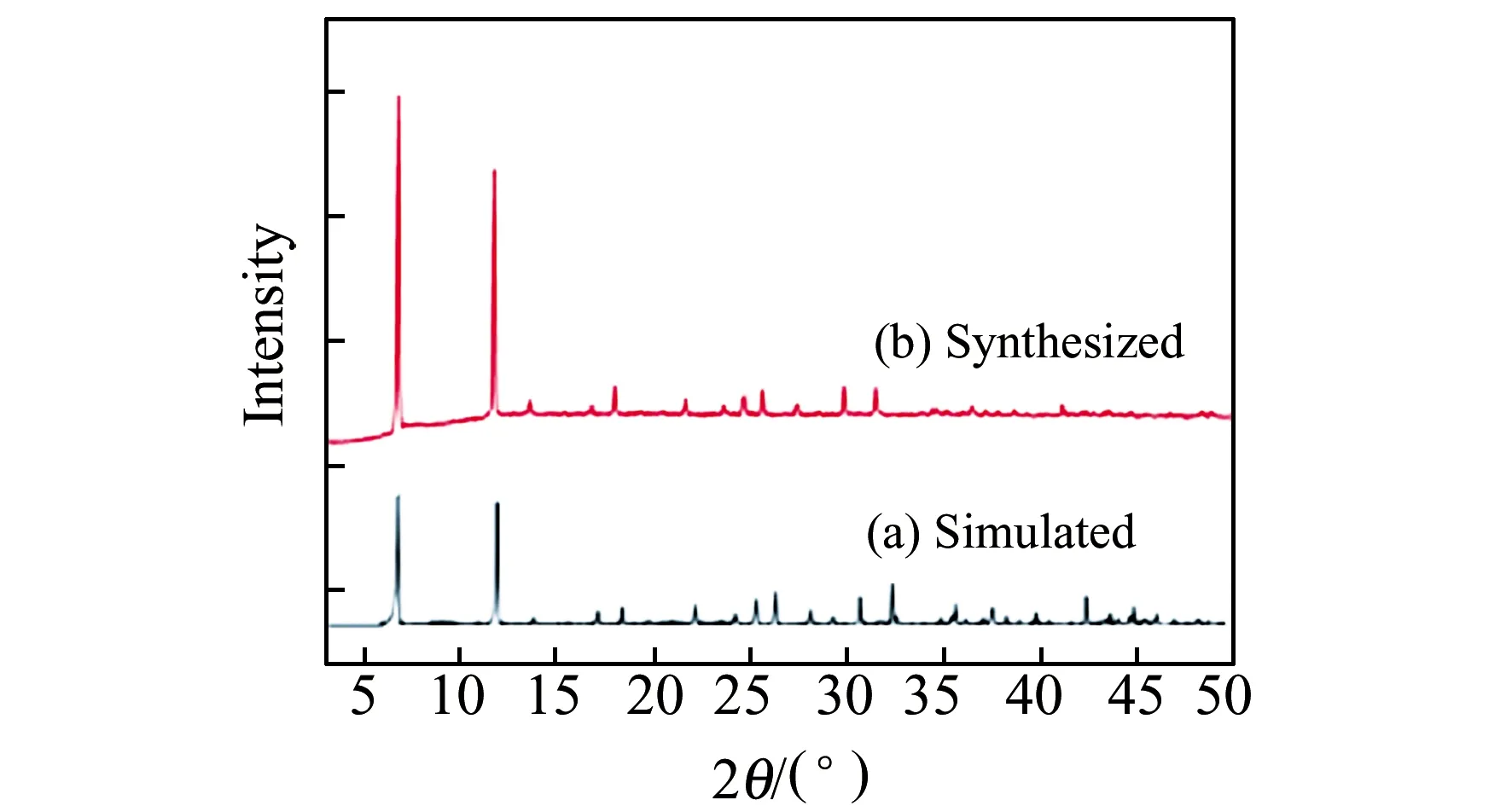
圖3 Cd-MOF-74的X射線衍射(XRD)圖Fig.3 XRD pattern of Cd-MOF-74
2.1.3 電極修飾過程的電化學表征本實驗在10 mmol/L [Fe(CN)6]3-/4-(含0.2 mol/L KCl)溶液中進行。由圖4可見,曲線a為裸的GCE,它接近一條直線證明裸電極導電性優良;在電極上鋪展一層Au NPs@C3N4作為基底之后,阻抗值比裸電極略有增大(曲線b),由于修飾了Au NPs@C3N4和Nafion膜共同形成的界面對電子的傳遞有所阻礙;曲線c為在基底之上自組裝了anti-CRP,此時阻抗值接近600左右,anti-CRP是一種蛋白質,本身不導電引起阻抗值增大;用1%BSA封閉非特異性位點后,BSA/anti-CRP/Au NPs@C3N4修飾電極后的電化學阻抗(曲線d)在曲線c的基礎上進一步增大,因為BSA是一種不能傳導電子的蛋白質;曲線e為滴加了CRP抗原的CRP/BSA/anti-CRP/Au NPs@C3N4/GCE,CRP抗體抗原特異性結合形成免疫復合物,進一步阻礙電子的傳導;曲線f為Au NPs@Cd-MOF-74-anti-CRP/CRP/BSA/anti-CRP/Au NPs@C3N4修飾在電極表面之后的電化學阻抗,MOFs標記的抗體與抗原結合后,修飾電極的阻抗進一步增大,表明Au NPs@Cd-MOF-74-anti-CRP成功組裝在電極上。從上述曲線阻抗值的逐步變化結果得出,此夾心型免疫傳感器構建成功。
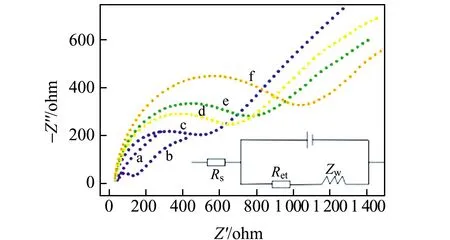
圖4 不同電極的交流阻抗譜(EIS)Fig.4 The EIS of different modified electrodes(a)bare GCE;(b)Au NPs@C3N4/GCE;(c)anti-CRP/Au NPs@C3N4/GCE;(d)BSA/anti-CRP/Au NPs@C3N4/GCE;(e)CRP/BSA/anti-CRP/Au NPs@C3N4/GCE;(f)Au NPs@Cd-MOF-74-anti-CRP/CRP/BSA/anti-CRP/Au NPs@C3N4/GCE.All tests were carried out in 10 mmol/L[Fe(CN)6]3-/4- containing 0.2 mol/L KCl.
2.2 Cd-MOF-74的響應峰電流來源
為了確認Cd-MOF-74的信號來源于Cd2+,本實驗考察了DHTA在PBS中的DPV響應電流。由圖5可見,配體DHTA與Cd-MOF-74在PBS中的響應電流峰的位置差別較大,其信號峰分別位于0.4 V和-0.8 V。Cd-MOF-74材料合成過程中,只含有Cd2+和DHTA,證實Cd-MOF-74產生的響應電流來源于Cd-MOF-74中的Cd2+。實驗中檢測到的電流信號為Cd-MOF-74中Cd2+的還原峰。
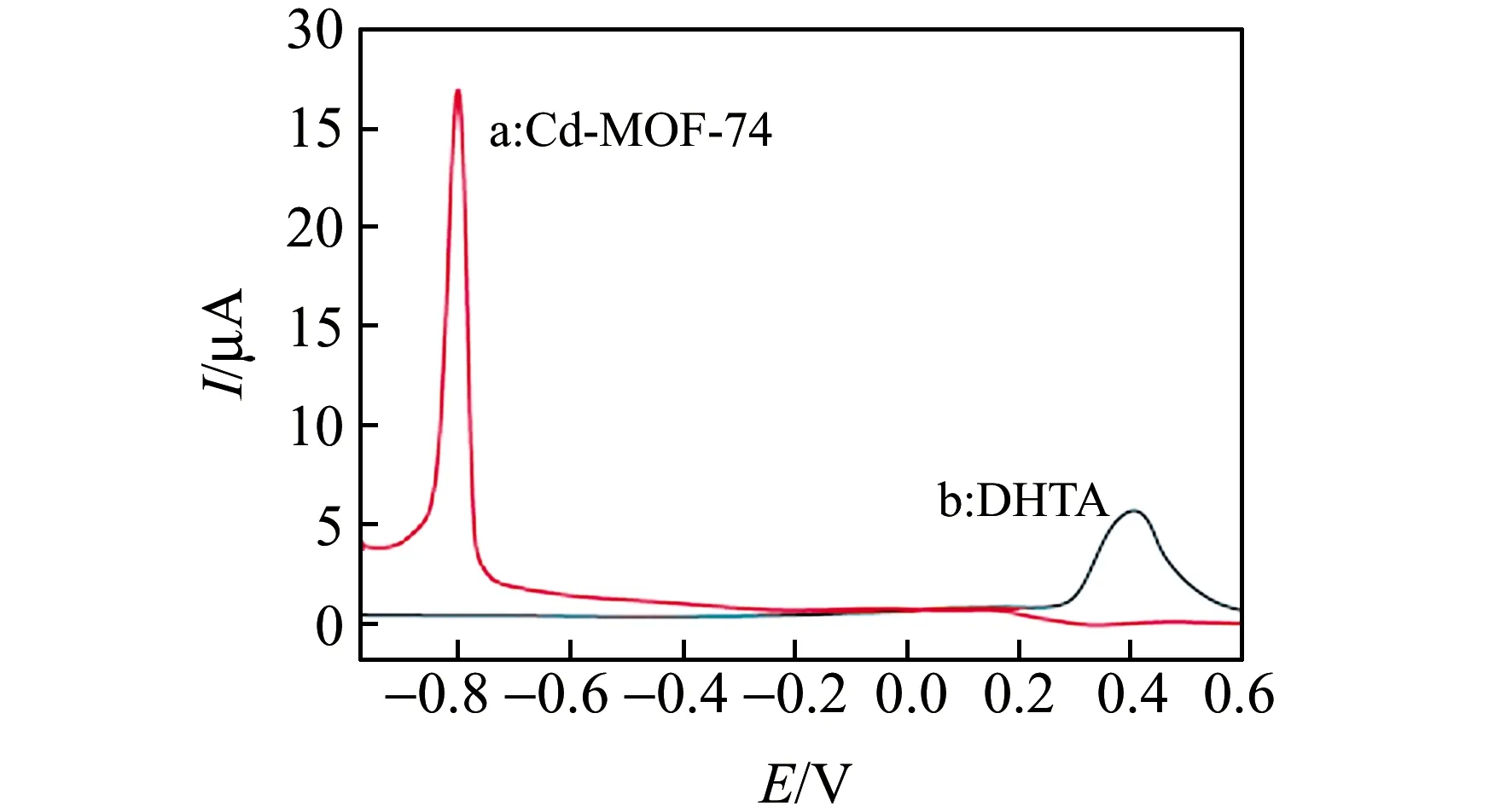
圖5 Cd-MOF-74和DHTA在PBS中的電流響應Fig.5 Current response of Cd-MOF-74 and DHTA in PBS
2.3 實驗條件優化
實驗考察了HAc-NaAc、Na2HPO4-檸檬酸和檸檬酸-檸檬酸三鈉三種緩沖體系(0.1 mol/L,pH=5)對免疫傳感器的影響。為了排除其它因素干擾,抗體的濃度固定為40 μg/mL,抗原濃度選定為30 ng/mL。結果表明:在HAc-NaAc緩沖體系中,電流響應最大,但是目標與空白差值不明顯;選用Na2HPO4-檸檬酸為緩沖體系時目標和空白相差無幾;而在檸檬酸-檸檬酸三鈉緩沖體系中,峰電流差值最大。本實驗選用檸檬酸-檸檬酸三鈉緩沖溶液作為底液。
考察了當培育抗原濃度保持在30 ng/mL,檸檬酸-檸檬酸三鈉緩沖溶液作為底液時,固定抗體濃度增加對響應電流的影響。由圖6可見,隨著anti-CRP濃度的增大,響應電流也隨之逐漸增大。當抗體濃度達到40 μg/mL時,響應電流達到峰值,且此時目標和空白差值最大。繼續增大抗體濃度,電流峰值反而有所下降。本實驗選擇40 μg/mL作為固定抗體的濃度。
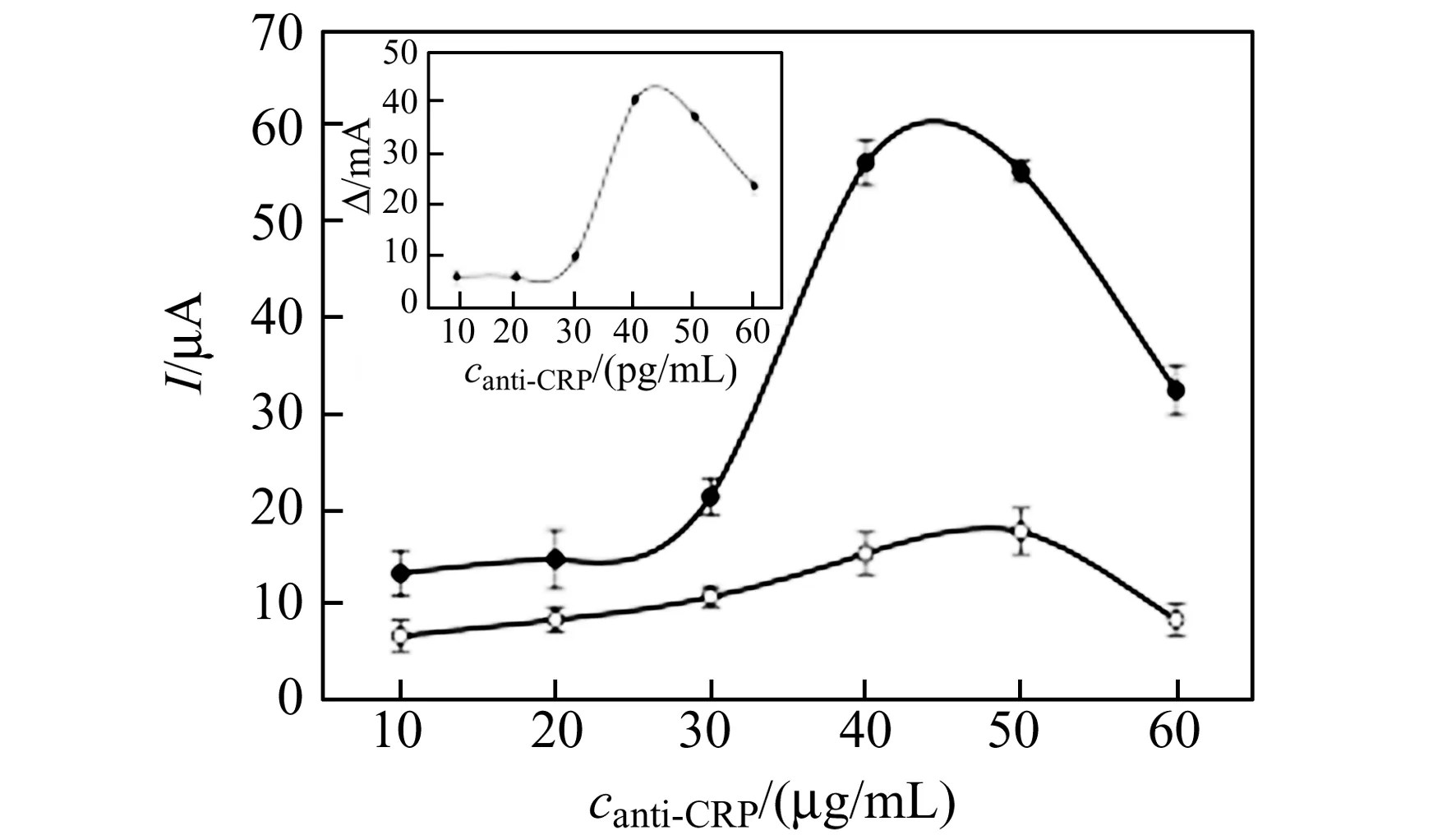
圖6 固定抗體濃度對免疫傳感器響應電流的影響(內插圖為目標與空白的差值)Fig.6 The effect of concentration of immobilized antibody on the response of immunosensors(inset graph is the current response between target and blank)
2.4 免疫傳感器的響應性能
在最優條件下,分別對不同濃度抗原的免疫傳感器的響應性能進行測試。圖7A為免疫傳感器的DPV響應電流與CRP蛋白濃度之間的關系。由圖可見,響應電流隨CRP濃度的增大而遞增。圖7B為免疫傳感器的線性曲線。CRP濃度的對數與響應電流具有良好的線性關系,線性回歸方程為:I(μA)=20.69lgc(ng/mL)+23.83,R2=0.994,線性范圍為0.1~100 ng/mL,檢出限(S/N=3)為33.3 pg/mL(圖7B)。
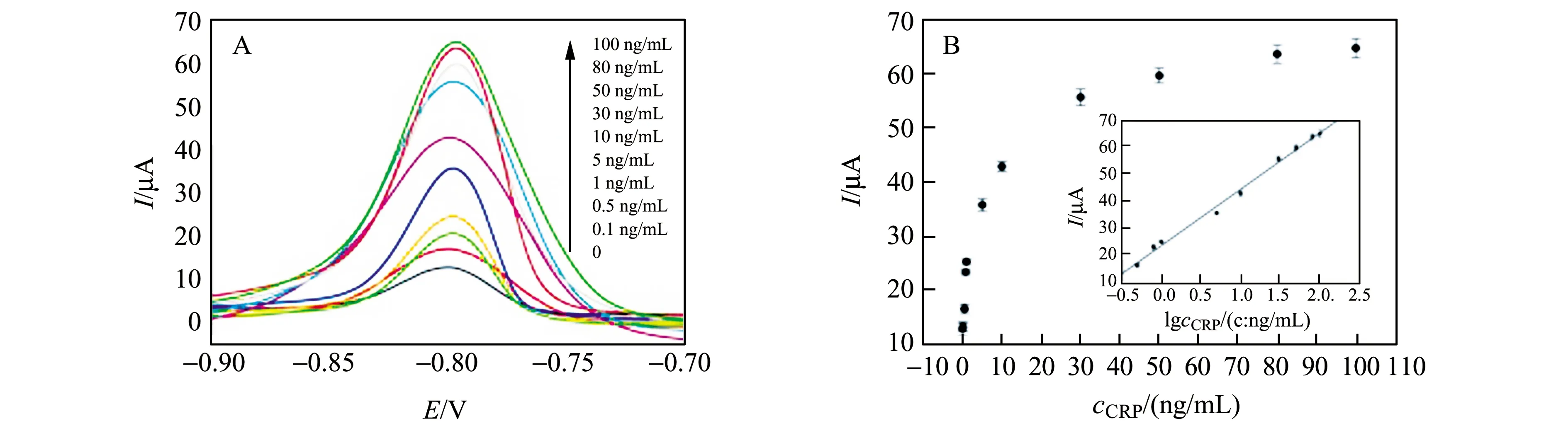
圖7 免疫傳感器對不同濃度CRP的響應曲線(A)和免疫傳感器的校正曲線(B)Fig.7 The current response of immunosensor to different concentrations of CRP(A) and calibration curves of immunosensor(B)
為了進一步驗證本文構建的免疫傳感器的性能,將此免疫傳感器同文獻所報道的CRP監測方法進行了比較。由表1可見,該免疫傳感器具有較低的檢出限,更高的靈敏度,且線性范圍寬。其優良性能歸功于:(1)作為基底材料的C3N4具有高比表面積和優良的導電性;(2)作為信號源的Cd-MOF-74是一種多孔、比表面積大且能提供大量金屬活性位點的配位聚合物,在提供更多蛋白結合位點的同時,有著較強的響應電流信號。
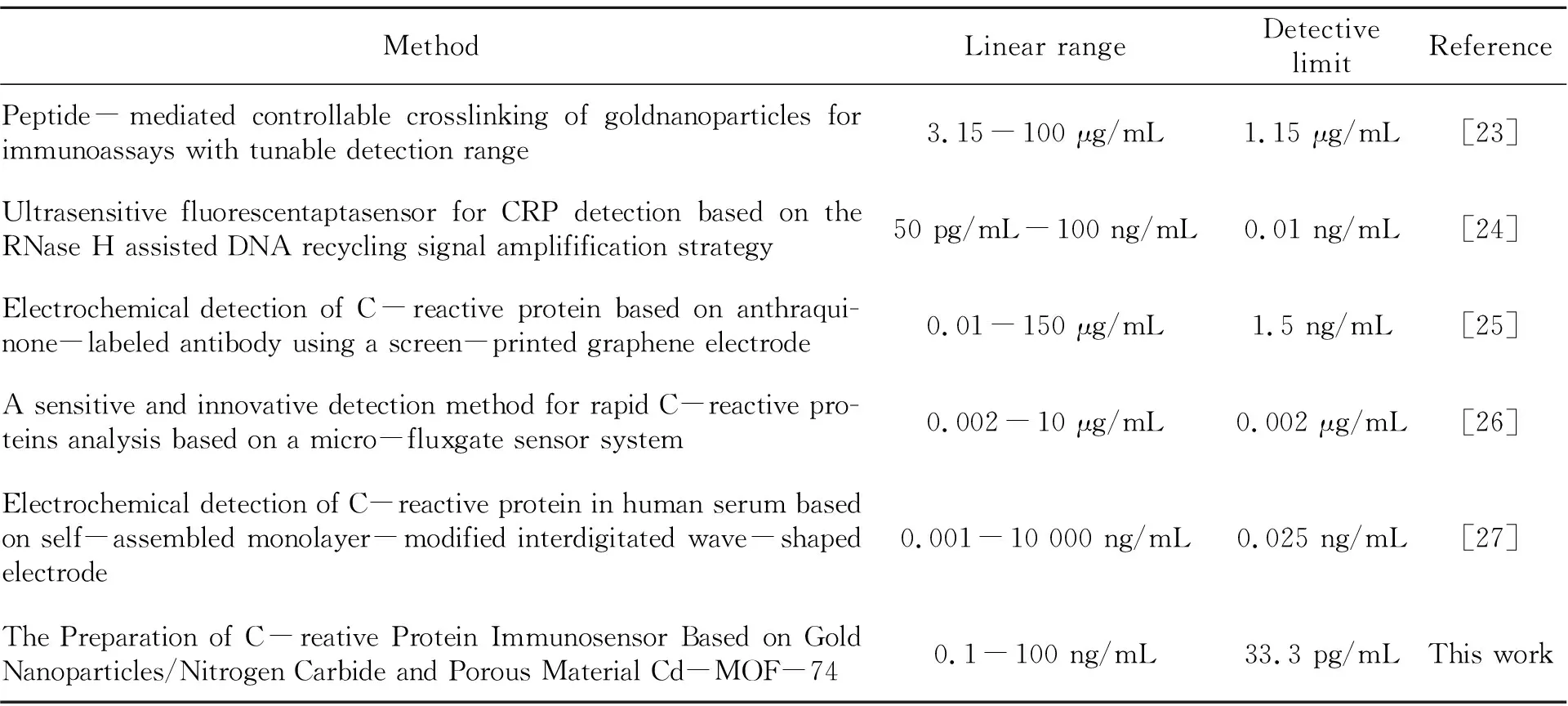
表1 不同CRP檢測方法對比Table 1 Analytical performance of correlative methods for CRP detection
2.5 免疫傳感器的選擇性
在最優條件下,分別將500 ng/mL的凝血酶(Thrombin)、癌胚抗原(CEA)、人絨毛膜促性腺激素(HCG)、甲胎蛋白(AFP)4種干擾物替換50 ng/mL的CRP抗原。從圖8可知,僅加入CRP抗原電流信號顯著增大,而干擾物(500 ng/mL)的電流信號和空白值相差不大。說明此傳感器具有較好的抗干擾能力,選擇性好,可用于檢測C-反應蛋白。
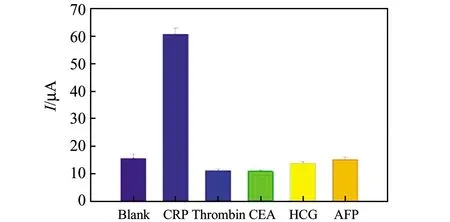
圖8 免疫傳感器的選擇性Fig.8 Selectivity of the immunosensor
2.6 回收率測定
在0.01%的血清稀釋液中,采用標準加入法,分別加入3種不同濃度的CRP抗原(5、10、80 ng/mL),以此評估本實驗所構建的生物傳感器的實用價值。每種濃度平行測定3組,回收率范圍在98.4%~104.2%之間。由上述結果可知,本文設計的免疫傳感器用于復雜真實環境時取得令人滿意的結果,因此能夠用于實際樣品的檢測。
2.7 免疫傳感器的重現性
本實驗在最優實驗條件下,采用5根不同電極構建免疫傳感器對50 ng/mL的抗原進行平行測定,其相對標準偏差為3.6%。因此,構建的免疫傳感器具有良好的精密度和重現性。
2.8 與標準檢測方法酶聯免疫法比較
本實驗采用標準人C反應酶聯免疫試劑盒對CRP進行定量檢測,結果顯示紫外吸收光譜隨CRP濃度的增加而上升,CRP濃度在375~12 000 ng/mL之間時,紫外吸收峰值與CRP濃度線性相關良好。線性方程為:A=1.304lgc(ng/mL)-3.332(R2=0.9683),檢測下限為125 ng/mL。將此測試結果與本實驗所構建的夾心型免疫傳感器進行了比較。本實驗所提出的檢測方法與ELISA Kits相比,具有更高的靈敏度(檢測下限降低了3個數量級)。
僅對比檢測范圍與檢測下限不足以說明本實驗所提出的檢測方法的準確性和實用性。我們采用本實驗所提出的檢測方法與人C反應ELISA Kits對同一真實血清樣品再次進行了對比檢測。因為,本實驗所提出方法與ELISA Kits的標準曲線范圍不在同一數量級且無重疊區域。為了嚴謹起見,ELISA Kits直接檢測100%血清原液。而本實驗構建的免疫傳感器則檢測稀釋100倍后的1%血清,再通過稀釋倍數計算得到血清原液中CRP的濃度。在真實血清樣本中,本實驗構建的免疫傳感器同商業試劑盒對比僅有-3.4%的誤差。結果證實所提出的夾心型免疫傳感器有可靠的準確度,具有實用性。
3 結論
本實驗基于Au NPs@C3N4與多孔有機框架材料Cd-MOF-74,構建了一種新的夾心型免疫傳感器用于CRP的定量檢測。本文構建的夾心型免疫傳感器在CRP含量為0.1~100 ng/mL范圍內具有較高的靈敏度,檢出限(S/N=3)為33.3 pg/mL。將該免疫傳感器在對實際血清樣品中進行加標回收檢測,并與ELISA Kits作對比。實驗結果證明該夾心型免疫傳感器在臨床上CRP的監測中有良好的應用前景。

