錦鯽源豚鼠氣單胞菌滅活疫苗的制備及免疫效果評價※
●魏代民 劉長宇,2 張 偉 李若銘 劉俊彤 張 建 單曉楓※※
(1.吉林農業大學動物科學技術學院 吉林 長春 130118;2.吉林省通化縣人力資源與社會保障局 吉林 通化 134100;3.吉林省圖們市農業農村局 吉林 延邊 137200)
近年來,我國不僅對食用魚類的需求穩步增加,對觀賞性魚類的需求也在逐漸提升,觀賞性魚類的養殖已成為水產經濟的一個重要組成部分。錦鯽因體色鮮艷、食譜廣泛、環境適應能力強等特點常被用于觀賞魚養殖[1],但集約化、高密度的養殖模式以及水環境的管理不善等因素均會增加錦鯽感染各種細菌性疾病的風險[2]。
疫苗的預防接種對降低細菌性疾病發病率起到重要作用。滅活疫苗具有制備工藝簡單、生產成本低、毒力弱、滅活效果穩定以及幾乎不受母源抗體影響等優點,是目前市面上主流的免疫方式。本試驗利用分離豚鼠氣單胞菌AC-CY菌株,制備錦鯽源豚鼠氣單胞菌(Aeromonas caviae,A.caviae)滅活疫苗,通過對錦鯽的免疫與攻毒試驗,檢測不同階段的免疫指標對A.caviae滅活疫苗的免疫效果,以期為防控豚鼠氣單胞菌引發的疾病提供一定理論支持。
1 材料與方法
1.1 材料
1.1.1 試驗菌株及試驗動物豚鼠氣單胞菌AC-CY菌株,分離自吉林省長春市某觀賞魚養殖場某患病錦鯽魚。健康錦鯽魚300尾(購自長春某魚類養殖場),平均單體重(70±3)g。試驗前在水箱中飼養14 d,觀察健康狀況。
1.1.2 試驗主要試劑HRP標記的魚補體4(C4)酶聯免疫分析試劑盒,HRP標記的魚補體3(C3)酶聯免疫分析試劑盒,HRP標記的溶菌酶(LYS)酶聯免疫分析試劑盒,HRP標記的免疫球蛋白M(IgM)酶聯免疫分析試劑盒,HRP標記的堿性磷酸酶(AKP)酶聯免疫分析試劑盒,均購自南京建成生物技術有限公司;EasyScript? One-Step gDNA Removal and cDNA Synthesis SuperMix RNA反轉錄試劑盒購自北京全式金生物技術有限公司;甲醛購自廣州某化工廠。
1.2 方法
1.2.1 滅活疫苗的制備將AC-CY菌株接種于LB液體培養基中,37℃振蕩培養24 h后,將菌液濃度調至 1×107CFU/mL,將調好濃度的菌液按照菌液量分別加入0.1%、0.15%、0.2%、0.25%、0.3%、0.35%、0.4%、0.45%和0.5%的甲醛溶液,每種濃度3管,并將不同濃度的配制液放在4℃冰箱里滅活48 h,每隔6 h取100 μL均勻涂布于哥倫比亞綿羊血瓊脂培養基、RS瓊脂平板培養基及LB固體培養基上,同時設計不加甲醛溶液的陰性對照組。通過觀察各組細菌的生長情況,發現最佳滅活條件為甲醛溶液濃度0.4%,滅活時間48 h,溫度4℃。用PBS緩沖液將滅活疫苗離心清洗3次,封裝到疫苗瓶中。
1.2.2 疫苗的免疫及保護率測定將300尾健康錦鯽隨機分為2組,每組150尾,水溫24℃,養殖周期為49 d。分別在0、7、14、28 d,滅活組每尾腹腔注射0.2 mL的滅活疫苗,PBS組注射同等劑量PBS。
在35 d進行攻毒試驗,將AC-CY菌液(前期試驗測定LD50= 2.51×102CFU/mL)過夜培養后濃度調至3×103CFU/mL,每尾注射0.2 mL,49 d時觀察死亡情況,計算相對免疫保護率(RPS)。公式:RPS=(1-免疫組死亡率/對照組死亡率)×100%[3]。
1.2.3 錦鯽血清相關免疫指標檢測分別在免疫前(0 d),第1次免疫后(7 d),第2次免疫后(14 d)、21 d、第3次免疫后(28 d)及攻毒試驗(35 d),每組隨機選取10尾進行麻醉后尾靜脈取血,將血清置于-80℃冰箱內保存。利用ELISA法測定采集血清中的溶菌酶(LYS)、堿性磷酸酶(AKP)、魚補體4(C4)、魚補體3(C3)、免疫球蛋白M(IgM)含量。
1.2.4 實時熒光定量PCR的檢測分別在免疫前(0 d),第1次免疫后(7 d),第2次免疫后(14 d)、21 d、第3次免疫后(28 d)及攻毒試驗后(35 d),每組隨機選取10尾錦鯽,分別進行麻醉采樣,采集肝臟、脾臟、腎臟、腸和腮5個組織器官。在超凈工作臺中提取RNA。取一部分RNA進行濃度及完整性檢測,剩余RNA按照反轉錄試劑盒進行反轉錄。
為評估免疫效力,試驗通過(qRT-PCR)方法測定錦鯽各組織中IL-10、IL-1β、IFN-γ和TNF-α的相對表達量,引物序列詳見表1,無cDNA模板設定作為陰性對照,參照樣品為0 d,每個樣品3個重復,內參基因為β-actin,反應 體 系:2×PerfertStartTMGreen qPCR SuperMix(Dye II)10 μL ,上 下 游 引 物 各0.5 μL ,cDNA 1 μL ,Nuclease-free Water 8 μL 。反應條件:50℃2 min、95℃ 30 s、95℃ 5 s、62℃ 30 s,共40個循環[4]。
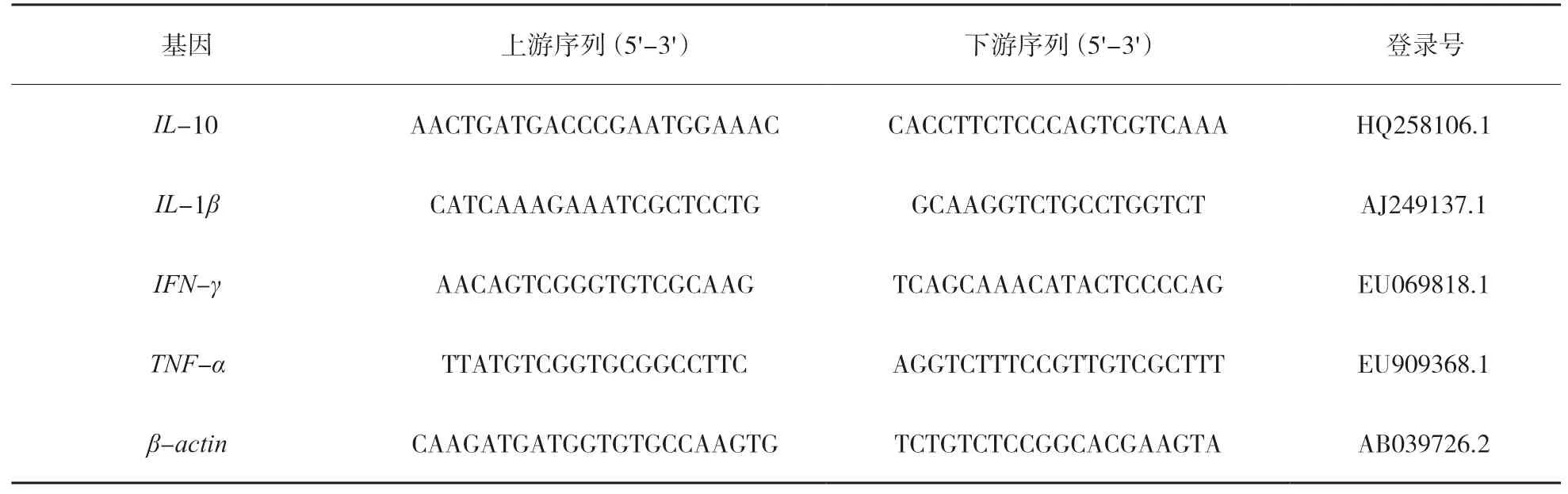
表1 qRT-PCR 引物序列
1.2.5 血清殺菌活性檢測在第3次免疫后,滅活組及PBS組各隨機挑取3尾,尾靜脈麻醉后取血,分離出血清備用。將AC-CY菌株放入LB液體培養基中過夜培養,使用PBS緩沖液洗滌3次,濃度稀釋至2×103CFU/mL后,取1 mL稀釋的菌液與0.2 mL的血清混合均勻,分別在0、1、2、3、4 h取出100 μL混合液體,均勻涂布于RS瓊脂平板培養基上,37℃培養24 h。依據每個時間段培養基上生長的細菌數,計算出每組的細菌存活指數(SI),測定各組血清殺菌水平。計算公式:
細菌存活指數(SI)=(取樣時細菌數/0 h細菌數)×100%[5]。
1.2.6 白細胞吞噬試驗將滅活組與PBS組在免疫前、第1次免疫后、第2次免疫后和第3次免疫后分別采血進行制片并染色,使用顯微鏡觀察。隨機觀察100個白細胞,計算白細胞吞噬百分比(PP)以及白細胞吞噬指數(PI)[6]。計算公式:PP=(吞噬細菌的白細胞數/白細胞數)×100%PI=(100個白細胞吞噬的細菌總數)/100
2 結果與分析
2.1 血清免疫指標檢測結果
由圖1可見,滅活組在第1次免疫后,AKP濃度、LYS濃度、C3濃度和C4濃度不斷上升,第2次免疫時濃度均達到此時免疫周期的峰值,21 d有所下降,第3次免疫后有所上升。在35 d攻毒試驗后,所有濃度均達到整個免疫周期的峰值。PBS組無明顯變化。
2.2 血清中IgM檢測結果
如圖2所示,經過注射AC-CY滅活疫苗的錦鯽可產生IgM抗體,且抗體水平顯著(P<0.001)高于PBS組,在第1次免疫后,其IgM抗體水平不斷上升,第2次免疫時IgM抗體水平達到免疫時期最高值,IgM抗體水平在21 d有所下降,第3次免疫后有所上升,在35 d攻毒試驗后,其IgM抗體水平達到免疫周期最高值。PBS組無明顯變化。
2.3 實時熒光定量PCR檢測結果
2.3.1 IL-1β基因相對表達量結果結果如圖3所示,在整個養殖周期內滅活組IL-1β與PBS組均存在顯著性差異(P<0.001),經滅活疫苗接種免疫后,各臟器組織中IL-1β的相對表達水平升高,且隨著免疫次數及時間的增加,各組織的IL-1β相對表達量均有提升;其中,免疫周期內(28 d)滅活組在14 d時腎臟表達量最高,攻毒試驗后(35 d),PBS組和試驗組的IL-1β表達量均上升,滅活組的表達量顯著高于PBS組(P<0.001)。以上結果表明,錦鯽接種滅活疫苗能提高各組織中IL-1β的相對表達量,增強炎性反應。
2.3.2 IFN-γ基因相對表達量結果結果如圖4所示,與PBS組相比,滅活組在接種疫苗后IFN-γ的表達量在各個時期均為上調。在21 d各個組織中的IFN-γ表達量均有不同程度的下降,在第3次免疫后(28 d),表達量略有提升,其在14 d腎臟中的表達量最高。攻毒后,2組IFN-γ的表達量均升高,滅活組顯著高于PBS組。
2.3.3 TNF-α基因相對表達量結果結果如圖5所示,滅活組各組織的TNF-α表達量峰值均為第2次免疫后(14 d),在各組織中表達量最高為14 d的腎臟。
2.3.4 IL-10基因相對表達量結果結果如圖6所示,各組織在免疫周期內免疫基因IL-10的表達量在14 d均為峰值,其中腸道的表達量是各組織中最高。整個免疫周期內,滅活組的IL-10表達量呈上升趨勢;攻毒后,2組的IL-10表達量均有所升高,滅活組顯著高于PBS組。
2.4 血清殺菌活性檢測結果
在第3次免疫(28 d)后,試驗組及PBS組隨機挑取3尾,尾靜脈麻醉后取血,同文中“1.2.5”方法收集血清。根據各時間段平板上生長的細菌數計算出每組的細菌存活指數(SI),判定各組血清殺菌水平。結果如表2所示,2組均有一定的殺菌能力,滅活組在4 h內細菌存活指數不斷下降,最低達到37.47%;PBS組殺菌能力微弱,4 h內的SI分別為98.57%、96.75%、93.65%、94.52%和95.43%。
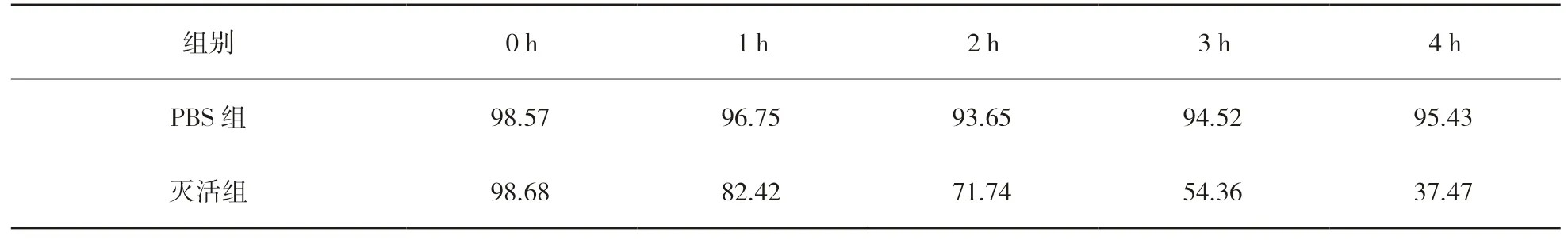
表2 細菌存活指數(SI) 單位:%
2.5 白細胞吞噬試驗結果
2.5.1 白細胞吞噬百分比在顯微鏡下3次隨機記錄100個白細胞的吞噬情況,并根據計算公式計算3組平行試驗的PP平均值,試驗結果如圖7所示。在0 d時,滅活組與PBS組的PP值分別為16.96%和17.40%,2組無顯著差異,試驗組在7 d上升到28.09%,14 d達到最大值48.56%,而21 d有所下降為35.99%,28 d回升至41.01%。PBS組在期間的PP值變化不顯著。
2.5.2 白細胞吞噬指數在顯微鏡下3次隨機記錄100個白細胞的吞噬情況,并根據計算公式計算3組平行試驗的PI平均值,試驗結果如圖8所示。滅活組與PBS組的PI值分別為1.94和2.52,2組幾乎無差異。試驗組PI值在7 d上升到2.52,14 d達到最大值3.62,而21 d有所下降為2.77,28 d回升至2.95。PBS組在期間的PI值變化不顯著(P>0.05)。
2.6 免疫保護試驗結果
在養殖周期35 d后,對2組錦鯽進行攻毒試驗,49 d后,觀察死亡情況如9圖所示,攻毒后,PBS組在7 d內全部死亡,滅活組RPS為77%。
3 討論
由于滅活疫苗具有制備工藝簡單、毒性小、效果明顯等優點,是魚類最主要的商品化水產疫病防控疫苗,且魚類腹腔的注射方式效果也優于口服法與浸泡法[7]。研究表明,制備滅活疫苗的甲醛濃度、滅活時間、滅活溫度對于其免疫效力影響極大,并且溫度、時間、濃度的篩選均為越小越好,這樣能最大化保留免疫抗原的效果,使免疫效果加強。張丹風等[8]制備的A. hydrophila滅活疫苗的最佳溫度為4℃,此溫度下A. hydrophila的滅活效果最佳,這與本研究結果一致。而潘吉脈[9]研究的A. hydrophila滅活疫苗最佳滅活溫度為28℃,這與本研究結果不同,這可能是由于不同菌株的原因。本試驗制備的AC-CY滅活疫苗采用甲醛進行滅活,摸索甲醛最佳制備滅活疫苗的濃度、時間及溫度后,選取甲醛溶液最終濃度為0.4%,滅活時間為48 h,溫度為4℃,可保留較好的免疫原性。
魚的免疫系統分為特異性免疫及非特異性免疫,其中非特異性免疫是魚抵擋外來病原菌至關重要的屏障,本試驗對滅活組錦鯽與PBS組錦鯽都進行非特異性免疫指標的檢測,用免疫指標的變化評價免疫效力。LYS廣泛存在于許多生物體內,可使病原微生物細胞壁破裂達到溶解的作用[10];AKP參與生命的鈣、磷等代謝[11],與生長發育密切相關,同時其濃度高低可用于肝膽等疾病的鑒別診斷[12];C3和C4在補體經典激活途徑中扮演重要角色[13];IgM在病原微生物入侵機體時,可調控體液免疫的吞噬和免疫應答,其活力可表示機體免疫調節的能力,是硬骨魚重要的免疫指標[14]。本試驗結果表明,LYS、AKP、C3、C4和IgM的活性均有不同程度提高,AKP在攻毒試驗后血清中含量顯著升高,可能是AC-CY菌株進入機體刺激肝臟免疫分泌大量AKP的原因,其作用機制還有待于進一步研究;LYS、C3、C4活性的升高表明機體的非特異免疫能力被加強,疫苗對機體有保護作用;IgM是魚類體液反應的特定組分,已有研究表明,注射疫苗可提升魚類各臟器組織中IgM的活力,但表達強度與組織器官類型相關[15]。
機體受到刺激時,組織細胞(大多為免疫細胞)會分泌多種不同的細胞因子,以加強機體免疫能力。當病原體進入機體時,早期免疫反應為單核細胞經刺激分泌IL-1β激活巨噬細胞,巨噬細胞轉錄TNF-α[16]。本試驗結果顯示,滅活組各組織中IL-1β、TNF-α表達水平均有顯著提升,在14 d時,腎臟IL-1β與TNF-α表達量為最高,推測AC-CY滅活疫苗作為抗原進入機體時,首先刺激腎臟的免疫系統調節。IFN-γ具有免疫調控的能力[17]。本試驗結果表明,滅活組IFN-γ表達水平在免疫周期內迅速上升,第2次免疫后達到峰值,說明AC-CY滅活疫苗可能調節體內免疫水平,有一定的抗病毒能力。IL-10不僅參與細胞的生長與分化,同時還可調控炎性反應和免疫反應,從而抑制免疫炎癥因子過多產生[18]。本試驗IL-10表達水平的升高證明機體已開啟免疫保護,抑制過多的炎性因子對機體造成損傷。
免疫保護試驗的結果表明,免疫保護率為77%;血清殺菌試驗也證明血清具有一定的殺菌能力,說明AC-CY滅活疫苗在抗豚鼠氣單胞菌AC-CY感染的過程中具有良好的保護作用。
4 結論
本試驗制備的AC-CY滅活疫苗通過非特異性免疫指標檢測和qRT-PCR檢測細胞因子等方法證明錦鯽的相關免疫指標均提高,錦鯽機體受到AC-CY菌株侵襲時有一定保護的能力。
攻毒試驗證明,AC-CY滅活疫苗可以提高錦鯽抗豚鼠氣單胞菌AC-CY感染的能力,降低死亡率,其保護率為77%。

