超聲輔助堿性蛋白酶提取雞爪膠原蛋白肽理化性質及功能特性
周婷 吳瑀婕 盧方云 楊彪 馬晶晶 楊靜 鄒燁 王道營 徐為民

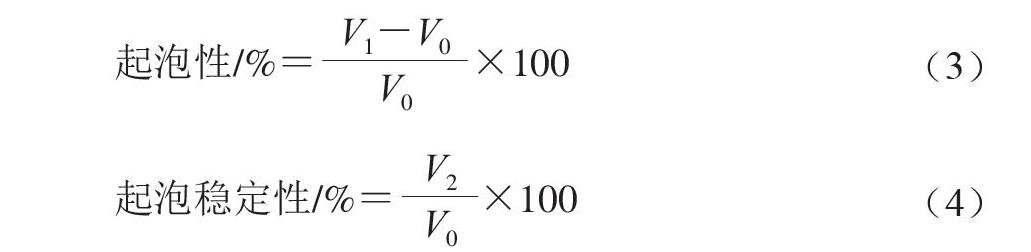
摘 要:以超聲波輔助堿性蛋白酶提取所得雞爪膠原蛋白肽作為實驗材料,首先研究雞爪膠原蛋白肽的理化特性(外觀色澤、等電點、分子質量分布、十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳、氨基酸組成及水解度),進一步對其起泡性和起泡穩定性、乳化性和乳化穩定性等功能特性進行研究。結果表明:雞爪膠原蛋白肽的分子質量分布范圍小于α2-鏈,小分子質量肽段比例較高;氨基酸種類豐富,甘氨酸和脯氨酸在總氨基酸含量中占比最高;優化提取的雞爪膠原蛋白肽水解度約28.65%,起泡性和起泡穩定性高達133.33%和126.67%,且具有較好的乳化性和乳化穩定性。
關鍵詞:雞爪;膠原蛋白肽;理化性質;功能特性
Physicochemical and Functional Properties of Collagen Peptides Derived from Ultrasonic-Assisted
Alkaline Protease Hydrolysis of Chicken Claws
ZHOU Ting1,2, WU Yujie1,2, LU Fangyun1, YANG Biao1, MA Jingjing1, YANG Jing1,2, ZOU Ye1,*, WANG Daoying1,2,*, XU Weimin1
(1. Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Science, Nanjing 210014, China;
2. College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
Abstract: The physicochemical properties (color appearance, isoelectric point, molecular mass, SDS polyacrylamide gel electrophoresis pattern, amino acid composition and hydrolysis degree) of collagen peptides produced by ultrasonic-assisted alkaline protease hydrolysis of chicken claws were determined as well as the functional characteristics such as foaming ability, foam stability, emulsification ability and emulsion stability. The results showed that the molecular mass distribution of the collagen peptides was below the α2-chain, small peptides being the major ones. The collagen peptides contained a wide variety of amino acids, with glycine and proline being the predominant ones. The hydrolysis degree of the collagen peptides prepared under the optimized conditions, having good foaming ability (133.33%) and foam stability (126.67%), having good emulsification capacity and emulsion stability, was about 28.65%.
Keywords: chicken claw; collagen peptides; physicochemical properties; functional characteristics
DOI:10.7506/rlyj1001-8123-20210422-108
中圖分類號:TS251.94? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? 文獻標志碼:A 文章編號:1001-8123(2021)10-0008-05
引文格式:
周婷, 吳瑀婕, 盧方云, 等. 超聲輔助堿性蛋白酶提取雞爪膠原蛋白肽理化性質及功能特性[J]. 肉類研究, 2021, 35(10): 8-12. DOI:10.7506/rlyj1001-8123-20210422-108.? ? http://www.rlyj.net.cn
ZHOU Ting, WU Yujie, LU Fangyun, et al. Physicochemical and functional properties of collagen peptides derived from ultrasonic-assisted alkaline protease hydrolysis of chicken claws[J]. Meat Research, 2021, 35(10): 8-12. DOI:10.7506/rlyj1001-8123-20210422-108.? ? http://www.rlyj.net.cn
膠原蛋白肽是由膠原蛋白(簡稱膠原)衍生的物質,主要來源包括自然界中存在、經過蛋白質水解和人為合成。膠原蛋白肽具有較強的消化吸收性,所以有利于人體小腸的消化與吸收[1-2]。GB 31645—2018《食品安全國家標準 膠原蛋白肽》規定富含膠原的新鮮動物組織在水解到一定程度后,即分子質量低于10 kDa時,稱為膠原肽[3]。膠原蛋白肽具有許多異于膠原的特性:易透皮、抗氧化、抑菌、無凝膠屬性和降血壓,而與其他蛋白多肽的主要區別在于其脯氨酸和羥脯氨酸的含量明顯居高[4-5]。
在肉雞工業生產車間會產生大量富含膠原的副產物,如雞爪、雞皮、雞骨等。一些西方國家將少部分雞爪作為寵物飼料,但絕大部分被棄用[6-8]。目前,僅亞洲一些國家將雞爪及其副產物制作成雞爪類制品,因此開發一種能有效提升雞爪經濟附加值的方法迫在眉睫。利用雞爪作為酶提膠原蛋白肽的原材料,不僅可極大程度地利用其中的膠原物質,而且能減少資源浪費和環境污染,也可將其應用于化妝品和食品添加劑行業,以提升雞爪的附加值和資源利用效率。因此,從資源豐富且價格相對低廉的雞爪中提取膠原蛋白肽并研究其性質十分必要。
1 材料與方法
1.1 材料與試劑
單凍雞爪購于山東榮華食品集團有限公司,經蒸餾水清洗、低溫通風晾干后,分裝,于-20 ℃下保存備用;金龍魚大豆油購于江蘇省南京市玄武區鐘靈街蘇果超市。
氫氧化鈉(分析純) 國藥集團化學試劑有限公司;冰醋酸、甲醛(分析純) 西隴化工股份有限公司。
1.2 儀器與設備
FiveEasy Plus pH計 梅特勒-托利多儀器(上海)有限公司;CR-400色彩色差計 日本Konica Minolta公司;BJ1514018L-8900氨基酸分析儀 日本日立公司;1260高效液相色譜儀 美國Agilent公司;Mini-Pro TEAN Tetra Cell 美國Bio-Rad公司;T-25數顯勻漿機 德國ZKA公司;Gen5全波長酶標儀 美國伯騰儀器有限公司;SCIENTZ-IID超聲波細胞粉碎機 寧波新芝生物科技股份有限公司。
1.3 方法
1.3.1 雞爪膠原蛋白肽制備工藝
工藝流程:雞爪(剔骨)→脫脂、除雜蛋白→水洗→超聲波輔助酶解→滅酶→離心→膠原蛋白肽提取液→凍干成粉末
操作要點:雞爪剔骨處理制備無骨雞爪,使用NaOH和Na2CO3溶液進行脫脂,再在0.1 mol/L NaOH溶液
(液料比10∶1,V/m)中浸泡6 h,每3 h更換一次NaOH溶液,以去除雜蛋白。采用堿性蛋白酶,參考預實驗中通過單因素試驗和響應面優化試驗得到的最佳參數(料液比1∶25、超聲功率250 W、酶提時間4 h)提取雞爪膠原蛋白肽,最后于100 ℃下滅酶10 min,取出冷卻,在10 000 r/min離心10 min后得雞爪膠原蛋白肽液,真空冷凍干燥制成雞爪膠原蛋白肽粉末。
1.3.2 雞爪膠原蛋白肽外觀顏色表征
通過肉眼觀察雞爪膠原蛋白肽的外觀色澤,然后用色差計測定雞爪膠原蛋白肽亮度值(L*)、紅度值(a*)、黃度值(b*),并根據L*、a*、b*計算色差(ΔE)。L*越大,亮度越亮;a*表示樣品顏色的紅綠偏向,若正值越大則說明偏移紅色方向;b*反映樣品色澤的黃藍偏向,若正值越大則偏移黃色方向。
1.3.3 雞爪膠原蛋白肽等電點的測定
根據程海明等[9]的方法,將2 g雞爪膠原蛋白肽粉末復溶于8 mL 0.5 mol/L醋酸溶液中,攪拌至溶液澄清,然后用6 mol/L NaOH溶液滴定到膠原蛋白肽溶液出現沉淀,且此時沉淀不會溶解,用精密pH計測定溶液pH值,即為雞爪膠原蛋白肽等電點,重復測定3 次,結果取平均值。
1.3.4 氨基酸組分測定
參照GB 5009.124—2016《食品安全國家標準 食品中氨基酸的測定》[10],利用氨基酸自動分析儀測定雞爪膠原蛋白肽中氨基酸的組成和含量。
1.3.5 分子質量組成分布測定
采用尺寸排阻色譜測定、峰面積歸一法計算樣品分子質量分布情況[11]。色譜檢測條件:TSKgel G2000 SWXL_012EA01051F尺寸排阻色譜柱(粒徑5 μm、孔徑125 A、排阻限5 000~150 000 Da),流動相pH 6.7、100 mmol/L磷酸鹽緩沖液,柱溫為室溫,流速0.7 mL/min,檢測波長280 nm,上樣質量濃度1.0 mg/mL。
1.3.6 十二烷基硫酸鈉-聚丙烯胺凝膠電泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)測定
參考肖楓等[12]的方法,略作修改。取200 μL 2 mg/mL雞爪膠原蛋白肽溶液與50 μL含體積分數5% β-巰基乙醇的樣品緩沖液(250 mmol/L Tris-HCl、10% SDS、50%甘油、0.5%溴酚藍)混合,以不含β-巰基乙醇的樣品緩沖液作為空白對照)。將樣品溶液先于95 ℃水浴加熱5 min后,再于12 000×g離心5 min。使用垂直板電泳裝置,采用12%分離膠、4%濃縮膠,電極緩沖液為Tris-Gly緩沖液(含0.1% SDS),上樣量約為5 μL,恒定電壓120 V下電泳90 min。電泳結束后,加入考馬斯亮藍染色液,染色約2 h,然后用去離子水沖洗多次,脫色液脫色處理,對蛋白質條帶拍照觀察。
1.3.7 水解度測定
采用雙指示甲醛滴定法[13]測定水解度,并略作修改。用蒸餾水配制質量濃度2 mg/mL的雞爪膠原蛋白肽凍干粉溶液,用pH計測定溶液pH值為8.20,然后加入約20 mL甲醛(用NaOH調節pH值至8.2),最后用
0.1 mol/L NaOH溶液滴定至pH 9.0,記錄此時消耗NaOH溶液體積(V1,mL),以蒸餾水代替樣品溶液作為空白組,記錄空白組所消耗NaOH溶液體積(V0,mL)。采用凱式定氮法[14]測定雞爪膠原蛋白肽凍干粉中蛋白含量,分別按式(1)~(2)計算雞爪膠原蛋白肽凍干粉中氨基態氮含量和雞爪膠原蛋白水解度。
(1)
(2)
式中:0.1為NaOH溶液標準溶液濃度/(mol/L);14.008為1 mL 0.1 mol/L NaOH標準溶液相當于氮的質量/mg。
1.3.8 起泡性和起泡穩定性測定
取一定量雞爪膠原蛋白肽粉末,用蒸餾水復溶,溶液質量濃度分別為1、2、3 g/100 mL,取30 mL
(V0,mL)不同質量濃度雞爪膠原蛋白肽溶液置于50 mL燒杯中,在12 000 r/min下高速分散2 min,使雞爪膠原蛋白肽溶液均勻起泡,立即測定均質后總體積(V1,mL),靜置40 min再次測定體積(V2,mL)[15]。分別按式(3)~(4)計算雞爪膠原蛋白肽溶液起泡性和起泡穩定性。
(3)
(4)
1.3.9 乳化性和乳化穩定性測定
將雞爪膠原蛋白肽凍干粉末復溶于60 ℃蒸餾水中,質量濃度分別為1、2、3 g/100 mL,取不同質量濃度膠原蛋白肽溶液約3 mL,加入1 mL大豆油,使用均質機(12 000 r/min)將體系混合均勻,分別于均質后0 min和10 min時取容器底部乳液,用提前配制的質量分數0.1% SDS溶液將雞爪膠原蛋白肽質量濃度分別為1、2、3 g/100 mL乳液分別稀釋200、400、600 倍,最后用酶標儀在500 nm波長處測定稀釋后乳液的吸光度[16]。乳化性和乳化穩定性分別按式(5)~(6)計算。
(5)
(6)
式中:A0為0 min時雞爪膠原蛋白肽乳液吸光度;A10為10 min時雞爪膠原蛋白肽乳化液吸光度;L為比色皿光程(0.01 m);n為溶液稀釋倍數;ρ為蛋白質量濃度/(g/100 mL);φ為油相體積分數(25%);Δt為10 min。
1.4 數據處理
運用Excel軟件進行實驗數據處理,每組實驗均重復3 次,結果取平均值。用SPSS 18.0軟件采用單因素方差分析、Tukey test法進行統計分析,P<0.05表示兩組數據差異顯著。使用Origin軟件作圖。
2 結果與分析
2.1 雞爪膠原蛋白肽粉末外觀顏色表征和等電點
雞爪膠原蛋白肽粉末均一、細致,未出現明顯結塊現象,顏色偏向黃色,且無雜質,有少許腥味。由表1可知,所測L*、a*、b*與肉眼觀察到的外觀顏色特征一致。
等電點是兩性電解質特有的物理參數[17],當溶液中正、負離子數量相等時,此時的氫離子濃度為該物質的等電點。在等電點處,蛋白分子受到的靜電作用力最弱,而蛋白分子之間相互作用增強,蛋白分子處于穩定狀態。蛋白的等電點與其氨基酸組成及結構特性
有關[18]。經測定,雞爪膠原蛋白肽的等電點平均值為4.73,等電點較低的酸性氨基酸天冬氨酸、谷氨酸含量在雞爪膠原蛋白肽中含量相對較高,這與氨基酸含量測定結果相一致。
2.2 雞爪膠原蛋白肽氨基酸組分分析
由表2可知,雞爪膠原蛋白肽中氨基酸種類較為豐富,甘氨酸、脯氨酸、精氨酸、谷氨酸、丙氨酸含量相對較多。其中甘氨酸含量最高,在總氨基酸含量中占比為17.284%,其次是脯氨酸,在總氨基酸含量中占比為16.565%;含量最少的是胱氨酸和酪氨酸,在總氨基酸含量中占比分別為0.194%和0.733%。疏水性氨基酸在總氨基酸含量中占比26.356%,必需氨基酸在總氨基酸含量中占比為15.556%。孔惠等[19]提取鮭魚皮明膠并制備膠原蛋白肽,發現在大多數普通蛋白質中脯氨酸含量相對較少,但膠原蛋白及其水解物中脯氨酸含量較高。本實驗中雞爪膠原蛋白肽中脯氨酸含量為16.565%,這與南學敏[20]
對羊骨膠原蛋白肽的研究結果一致,表明所制備雞爪膠原蛋白肽符合標準膠原蛋白肽的氨基酸組成特征。
2.3 雞爪膠原蛋白肽的分子質量組成分布
由表3可知,71%的雞爪膠原蛋白肽分子質量在1.35~17 kDa范圍內,27%的膠原蛋白肽分子
質量小于1.35 kDa。研究表明,膠原蛋白肽中小分子質量組分相對含量較多,則其溶解度較好;反之,若膠原蛋白肽分子中大分子質量組分含量較高,則其溶解性較差。綜上可知,小分子質量膠原蛋白肽更易被人體吸收,其體內消化轉換率更高[21]。
2.4 雞爪膠原蛋白肽的SDS-PAGE分析結果
泳道1~2. 5 mg/mL雞膝軟骨膠原蛋白肽;泳道3. Marker;泳道4~5. 2.5 mg/mL雞爪膠原蛋白肽。
由圖1可知,質量濃度5 mg/mL雞爪膠原蛋白肽有3 條清晰且染色較深的條帶,分別為α1-鏈、α2-鏈和β-鏈;而質量濃度2.5 mg/mL雞爪膠原蛋白肽的條帶模糊,可能是由于雞爪膠原蛋白肽溶液的質量濃度直接影響上樣量,當質量濃度低時,部分蛋白組分不能被有效電泳分離。凝膠底部有些條帶聚集,顏色沉積,可能是由于一些蛋白組分密切聯結,導致條帶堆積而無法分開。總的來說,雞爪膠原蛋白肽的電泳條帶基本集中分布在α2-鏈下方,說明膠原蛋白三螺旋結構被破壞,大部分已被酶解為小分子肽。
2.5 雞爪膠原蛋白的水解度
由圖2可知,隨酶解時間的延長,雞爪膠原蛋白肽水解度總體呈上升趨勢。在堿性蛋白酶作用下,酶解3 h內水解度增加速率較大,至4 h后逐漸趨于穩定。酶解0~3 h內,膠原分子中含有大量肽鍵,此時微量的酶解產物對強烈的酶促反應抑制作用微弱,酶-底物絡合物開始形成[22],導致水解度不斷上升;酶解4 h后,隨著反應進行形成大量小分子物質,水解度漸趨于穩定狀態。雞爪膠原蛋白在酶提時間4 h時水解度最高,約為28.65%。
2.6 雞爪膠原蛋白肽起泡性和起泡穩定性
注:同列小寫字母不同,表示差異顯著(P<0.05)。表5同。
起泡性及起泡穩定性受到蛋白種類、溶液pH值、溶液質量濃度、環境溫度等因素的綜合影響[23]。由表4可知,雞爪膠原蛋白肽的起泡性和起泡穩定性均隨質量濃度的增加呈顯著升高的趨勢(P<0.05)。這是由于隨著雞爪膠原蛋白肽質量濃度的增加,其分子間疏水區域面積增大,黏性增大,使得膠原蛋白肽分子經歷迅速攪拌作用后富集于氣-液界面,形成密集的多層膜結構,此時膠原蛋白肽的起泡性和起泡穩定性相應得到增強[24]。蛋白質類產品的起泡性與泡沫穩定性在食品工業中應用廣泛,其可用作發泡劑替代蛋類,改善烘焙食品的食用品質,使產品質地更加疏松、軟糯且可口。
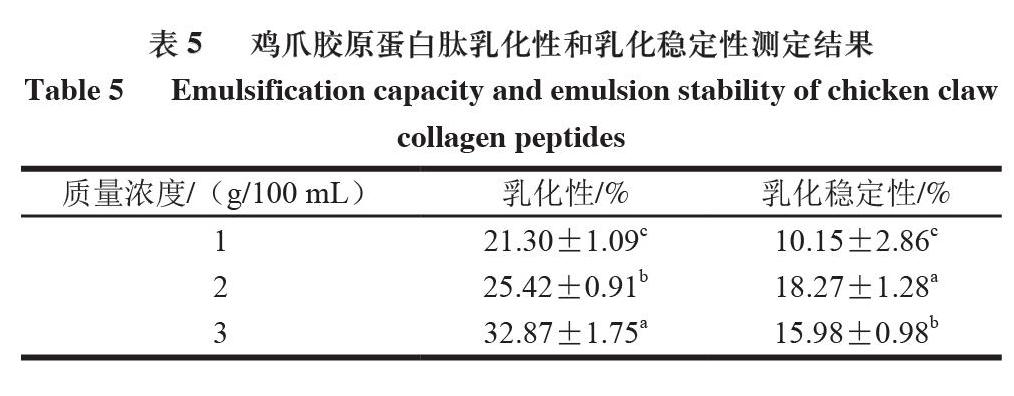
2.7 雞爪膠原蛋白肽乳化性和乳化穩定性
乳化性用于衡量水油結合形成乳化液的能力,乳化穩定性則反映油水混合乳狀液維持穩定的能力[25],二者受物質顆粒大小、加工方式、加工溫度和蛋白質質量濃度等因素綜合影響[26]。由表5可知,雞爪膠原蛋白肽的乳化性隨質量濃度的增加而逐漸增加,但乳化穩定性呈先增加后降低的趨勢,這可能是由于膠原蛋白肽質量濃度增加的同時,蛋白質分子數量也隨之增加,形成界面膜的強度和厚度均減弱。雞爪膠原蛋白肽的乳化性和乳化穩定性顯著低于未水解大分子酪蛋白(乳化性76.6%和乳化穩定性90.27%),這說明得到的雞爪膠原蛋白肽分子質量小,不利于其在油-水界面擴散且吸附能力弱。由于膠原蛋白肽具有乳化性與乳化穩定性可將其用于甜品制作行業。研究發現在面包中添加0.8%膠原蛋白多肽后,面包的體積膨脹和食用品質得到提升,且面包老化時間從3 d提高到5 d,即延長了面包產品的貨架期[27]。
3 結 論
首先對超聲輔助堿性蛋白酶提取的雞爪膠原蛋白肽的外觀色澤、等電點、分子質量分布、氨基酸組成、SDS-PAGE電泳圖及水解度進行系統研究,然后對其起泡性、起泡穩定性和乳化性、乳化穩定性進行測定。雞爪膠原蛋白肽粉末呈均一、細致狀態,顏色偏黃,有少許腥味;平均等電點為4.73,氨基酸組成種類豐富。SDS-PAGE圖譜顯示,雞爪膠原蛋白肽電泳條帶基本集中在α2-鏈以下,表明膠原蛋白三螺旋結構遭到嚴重破壞,大部分已被酶解為小分子肽。優化提取條件下雞爪膠原蛋白的水解度達到28.65%,雞爪膠原蛋白肽起泡性和起泡穩定性均較好,具備一定的乳化性和乳化穩定性,但較酪蛋白小得多,可能由于其分子質量相對較小。
通過對雞爪膠原蛋白肽的理化性質及功能特性綜合評估,認為雞爪膠原蛋白肽理化性能優質,且具備良好的功能特性。但目前國內膠原蛋白肽研究和國外仍有很大差距,產品開發略顯單一,膠原蛋白肽特有的理化性質和功能活性特點還存在許多待開發的用途,還應繼續深入探究。
參考文獻:
[1] BERNARDINI R D, HARNEDY P, BOLTON D, et al. Antioxidant and antimicrobial peptidic hydrolysates from muscle protein sources and by-products[J]. Food Chemistry, 2010, 124(4): 1296-1307. DOI:10.1016/j.foodchem.2010.07.004.
[2] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. DOI:10.1016/0003-2697(76)90527-3.
[3] 李敏雄, 郭斌, 劉飛, 等. 羅非魚皮膠原蛋白肽制備的工藝優化[J].?現代食品科技, 2018, 34(7): 205-212. DOI:10.13982/j.mfst.1673-9078.2018.7.030.
[4] 周雪松. 膠原蛋白肽產業現狀及發展趨勢[J]. 食品與發酵工業, 2013, 39(6): 115-119.
[5] WOITKOWIAK D, FRYDRYCHOWSKI A F, HADZIK J, et al. Identification of small peptides of acidic collagen extracts from silver carp skin and their therapeutic relevance[J]. Advances in Clinical &?Experimental Medicine, 2016, 25(02):227-235. DOI:10.17219/acem/36361.
[6] MALISON A, ARPANTUD P, KEERATIPIBUL S. Chicken foot broth byproduct: a new source for highly effective peptide-calcium chelate[J]. Food Chemistry, 2021, 345(6):13-19. DOI:10.1016/j.foodchem.2020.128713.
[7] MOKREJ P, MR?ZEK P, G?L R, et al. Biotechnological preparation of gelatines from chicken feet[J]. Polymers, 2019, 11(6): 24-29. DOI:10.3390/polym11061060.
[8] DE ALMEIDA P F, DE ARA?JO M G O, CURVELO-SANTANA J C. Collagen extraction from chicken feet for jelly production[J]. Acta Scientiarum Technology, 2012, 34(3): 345-351. DOI:10.4025/actascitechnol.v34i3.10602.
[9] 程海明, 王磊, 王睿, 等. Zeta電位法測定膠原及其降解物的等電點[J]. 皮革科學與工程, 2006(6): 40-43. DOI:10.3969/j.issn.1004-7964.2006.06.008.
[10] 中華人民共和國國家衛生和計劃生育委員會, 國家食品藥品監督管理總局. 食品安全國家標準 食品中氨基酸的測定: GB 5009.124—2016[S]. 北京:中國標準出版社, 2016.
[11] 林霖. 烏骨雞多肽產品質量指標及其黑色素提取和含量測定研究[D].?南昌: 南昌大學, 2007. DOI:10.7666/d.y1238288.
[12] 肖楓, 朱文學, 康懷彬, 等. 正交試驗優化黃河鯉魚鱗酶促溶性膠原蛋白提取工藝[J]. 食品科學, 2015, 36(12): 60-64. DOI:10.7506/spkx1002-6630-201512011.
[13] 黃煥, 王欣, 劉寶林. 魚鱗膠原蛋白水解度兩種測定方法的比較[J]. 食品工業科技, 2010, 31(3):354-356. DOI:10.13386/j.issn1002-0306.2010.03.090.
[14] 王淡兮, 孫秀蘭. 蛋白質定量檢測方法的探討[J]. 糧食與食品工業, 2009, 16(4): 49-51; 62. DOI:10.3969/j.issn.1672-5026.2009.04.015.
[15] 祝婧, 劉磊, 張名位, 等. 不同分子質量海鱸魚膠原蛋白肽組分的功能特性比較[J]. 現代食品科技, 2014, 30(12): 113-118. DOI:10.13982/j.mfst.1673-9078.2014.12.019.
[16] 李靜, 冉旭. 大鯢皮膠原蛋白肽理化性質和功能特性研究[J]. 食品工業, 2016, 37(1): 217-222.
[17] XING C, QING Y, QIU K W, et al. Water-soluble myofibrillar protein-pectin complex for enhanced physical stability near the isoelectric point: fabrication, rheology and thermal property[J]. International Journal of Biological Macromolecules, 2020, 142(6): 31-38. DOI:10.1016/j.ijbiomac.2019.10.003.
[18] WANG Y D, GAO B H, CHEN S Y, et al. In vitro corrosion of pure Mg in phosphate buffer solution-influences of isoelectric point and molecular structure of amino acids[J]. Materials Science & Engineering C. Materials for Biological Applications, 2019, 105(3): 24-28. DOI:10.1016/j.msec.2019.110042.
[19] 孔惠, 邢曉平, 曹玉華, 等. 鮭魚皮明膠的提取及膠原蛋白肽的制備[J].?食品與生物技術學報, 2018, 37(10): 1042-1047. DOI:10.3969/j.issn.1673-1689.2018.10.006.
[20] 南學敏. 羊骨膠原蛋白肽抗氧化活性及氨基酸組成分析[D].?呼和浩特: 內蒙古農業大學, 2019. DOI:10.27229/d.cnki.gnmnu.2019.000439.
[21] 張鴿. 河鲀魚皮膠原蛋白肽提取及其化妝品功效研究[D]. 廈門:?集美大學, 2018. DOI:10.27720/d.cnki.gjmdx.2018.000031.
[22] WANG S N, JIANG L Z, LI Y, et al. Optimization on aqueous enzymatic extraction conditions of pine seed protein by response surface method[J]. Procedia Engineering, 2011(15):4956-4966. DOI:10.1016/j.proeng.2011.08.922.
[23] WOUTERS A G,FIERENS E,ROMBOUTS I,et al. Exploring the relationship between structural and air-water interfacial properties of wheat (Triticum aestivum L.) gluten hydrolysates in a food system relevant pH range[J]. Journal of Agricultural and Food Chemistry, 2017, 65(6): 1263-1271. DOI:10.1021/acs.jafc.6b05062.
[24] 李玉珍, 肖懷秋. 蛋白酶酶解液溶解度對起泡性和乳化性的影響研究[J]. 糧油食品科技, 2009, 17(6): 21-22. DOI:10.3969/j.issn.1007-7561.2009.06.009.
[25] KINSELLA J E. Functional properties of soy proteins[J]. Journal of the American Oil Chemists Society, 1979, 56(3): 242-258. DOI:10.1007/BF02671468.
[26] 樊雪靜. 大豆分離蛋白-寡糖復合體系乳化性及乳化穩定性研究[D]. 哈爾濱: 東北農業大學, 2018.
[27] 翁凌, 鄭焱戈, 馮雨晨, 等. 膠原小肽和海藻糖對面包抗老化效果的研究[J]. 中國食品添加劑, 2018(12): 163-171.
收稿日期:2021-04-22
基金項目:國家現代農業(肉雞)產業技術體系建設專項(CARS-41);國家自然科學基金青年科學基金項目(31901612);
江蘇省農業自主創新項目(CX(19)2018);江蘇省自然科學基金項目(BK20180300)
第一作者簡介:周婷(1997—)(ORCID: 0000-0002-8927-7326),女,碩士研究生,研究方向為畜禽副產品的高值化開發與綜合利用。E-mail: 1579642322@qq.com
*通信作者簡介:鄒燁(1986—)(ORCID: 0000-0002-2320-786X),女,副研究員,博士,研究方向為畜禽副產品的高值化開發與綜合利用。E-mail: zouye@jaas.ac.cn
王道營(1979—)(ORCID: 0000-0003-1776-5854),男,研究員,博士,研究方向為肉品加工與質量控制。E-mail: wdy0373@aliyun.com

