超聲結合熱處理對金黃色葡萄球菌及其生物膜的抗菌和抗生物膜機制
孫晉躍 王德寶 孫芝蘭 熊強 劉芳 徐為民 王道營 李坤鵬

摘 要:將超聲(ultrasound,US)與熱處理(heat,HT)相結合(UH),研究其對金黃色葡萄球菌游離細胞和生物膜細胞的殺菌效果,并分析其抗菌和抗生物膜機制。結果表明:US聯合70 ℃ HT(UH70)可顯著降低金黃色葡萄球菌游離細胞和生物膜細胞的數量(P<0.05);掃描電子顯微鏡結果表明,UH70對菌體細胞的細胞膜完整性具有明顯的破壞作用,激光共聚焦掃描顯微鏡顯示,UH70導致細胞的通透性急劇增加,從而導致胞外ATP、核酸和蛋白質含量顯著增加(P<0.05);此外,UH70能引起細胞內呼吸鏈脫氫酶活性顯著降低,引起生物膜胞外多糖含量顯著降低(P<0.05)。綜上所述,US結合HT與單獨的US或HT相比具有較強的殺菌效果,它可以通過破壞金黃色葡萄球菌菌體細胞的細胞膜完整性,引起細胞膜通透性的改變,造成ATP、核酸、蛋白質外泄,降低細菌呼吸鏈脫氫酶的活性,達到協同殺菌目的。
關鍵詞:超聲;熱處理;金黃色葡萄球菌;游離細胞;生物膜
Antibacterial and Antibiofilm Mechanism of Ultrasound in Combination with Heat against Staphylococcus aureus
SUN Jinyue1,2, WANG Debao1, SUN Zhilan1, XIONG Qiang2, LIU Fang1,*, XU Weimin1, WANG Daoying1, LI Kunpeng3
(1.Institute of Agricultural Products Processing, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China;
2.College of Food Science and Light Industry, Nanjing Tech University, Nanjing 211816, China;
3.Xuzhou Datun Lijia Food Co. Ltd, Xuzhou 221618, China)
Abstract: This study was devised to investigate the bactericidal effect and mechanism of ultrasound (US) in combination with heat (HT) against Staphylococcus aureus planktonic and biofilm cells. The results showed that US combined with HT at 70 ℃ (UH70) significantly reduced the counts of Staphylococcus aureus planktonic and biofilm cells (P < 0.05). Scanning electron microscopy (SEM) showed that UH70 obviously damaged the cell membrane. Confocal laser scanning microscopy (CLSM) indicated that UH70 sharply increased the permeability of the cell membrane, thereby causing a significant increase in the extracellular concentrations of ATP, nucleic acid and protein (P < 0.05). In addition, UH70 significantly decreased the activity of intracellular respiratory chain dehydrogenase and the concentration of extracellular polysaccharide in the biofilm (P < 0.05). In conclusion, US combined with HT could have stronger bactericidal effect than either alone. The synergistic bactericidal mechanism may be related to destroying the cell membrane, altering cell membrane permeability, causing the leakage of ATP, nucleic acid and protein out of the cells, and reducing the activity of respiratory chain dehydrogenase.
Keywords: ultrasound; heat; Staphylococcus aureus; planktonic cells; biofilm
DOI:10.7506/rlyj1001-8123-20210809-197
中圖分類號:TS251.1? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼:A 文章編號:1001-8123(2021)10-0062-08
引文格式:
孫晉躍, 王德寶, 孫芝蘭, 等. 超聲結合熱處理對金黃色葡萄球菌及其生物膜的抗菌和抗生物膜機制[J]. 肉類研究, 2021, 35(10): 62-69. DOI:10.7506/rlyj1001-8123-20210809-197.? ? http://www.rlyj.net.cn
SUN Jinyue, WANG Debao, SUN Zhilan, et al. Antibacterial and antibiofilm mechanism of ultrasound in combination with heat against Staphylococcus aureus[J]. Meat Research, 2021, 35(10): 62-69. DOI:10.7506/rlyj1001-8123-20210809-197.? ??http://www.rlyj.net.cn
雞肉肉質鮮美,脂肪含量低,蛋白質含量高,口感細膩,因此一直受到消費者的喜愛[1]。目前,雞肉的營銷以冷鮮雞肉為主。冷鮮雞肉指的是在0~4 ℃條件下貯藏和銷售的雞肉。但是,由于處理溫度相對較低,且蛋白質含量高,因此雞肉極易受到一些食源性致病菌和食源性條件致病菌污染,從而導致雞肉腐敗變質[2]。金黃色葡萄球菌作為革蘭氏陽性食源性病原菌之一,可引起人和動物受傷部位的感染,引發心血管發炎和肺炎[3-4]。同時,奶酪、牛肉、雞肉、魚類等高蛋白食品易受到金黃色葡萄球菌的污染[5-7]。生物膜是細菌污染食品的另外一種方式。一方面,生物膜的胞外會有許多大分子物質聚集,形成一層胞外基質。胞外基質的存在會對細菌起到保護作用,增強細菌對外界環境的抵抗能力,增加滅菌難度[8]。
另一方面,食品、食品加工設備以及一些隱蔽處會增大形成生物膜的的風險,從而導致食品的交叉污染[9-10]。
因此,鑒于金黃色葡萄球菌游離細胞和生物膜細胞的危害,開發高效的殺菌技術抑制金黃色葡萄球菌游離細胞和生物膜細胞的生長就顯得尤其重要。
近年來,超聲(ultrasound,US)殺菌技術受到廣泛關注。然而,當單獨使用US殺菌時,并沒有顯示出對食源性致病菌有較強殺菌作用,且殺菌效率較低[11]。因此,許多研究者將US協同滅菌作為提高滅菌效率的替代方法。Guo Liping等[12]報道US和次氯酸鈉聯合處理對滅活大腸桿菌具有協同作用。許愈等[13]報道,US聯合酸性電解水可以提高對副溶血性弧菌的殺菌效率。熱殺菌是一種傳統的殺菌技術,在食品工業中得到廣泛應用。在72 ℃條件下處理20 min或在82 ℃條件下處理5 min,可有效減少杏仁表面食源性致病菌的數量[14]。然而,較高的溫度可能會損害食品的營養成分和感官質量。因此,尋找一種既能滅活食品中的微生物,又能保證食品質量不受損害的方法具有重要意義。Li Jiao等[15]報道,US與加熱相結合可以縮短滅菌時間并降低滅菌溫度。
本研究確定熱處理(heat,HT)、US、US結合HT(UH)對金黃色葡萄球菌游離細胞和生物膜細胞的殺菌效果,研究UH的抗菌和抗生物膜機制。
1 材料與方法
1.1 材料與試劑
金黃色葡萄球菌(Staphylococcus aureus)菌株,由課題組從雞肉中分離并保存。
BHI腦心浸液肉湯、BHI腦心浸液固體培養基?青島海博生物科技有限公司;Nunc? Lab-TekTM 8 孔腔室蓋玻片系統、LIVE/DEAD BacLightTM試劑盒 美國賽默飛世爾科技公司;24 孔聚氯乙烯培養板 美國康寧公司;增強型ATP檢測試劑盒 上海碧云天生物技術有限公司;氯化鈉 國藥集團化學試劑有限公司。
1.2 儀器與設備
KQ-800KD超聲清洗機 中國昆山超聲儀器有限公司;Centrifuge 5810R離心機、Centrifuge 5424R離心機 德國Eppendorf公司;Gen5全波長酶標儀 美國伯騰儀器有限公司;Ultra View VOX轉盤式激光共聚焦掃描顯微鏡(confocal laser scanning microscope,CLSM) 美國珀金埃爾默股份有限公司;EVO-LS10掃描電子顯微鏡(scanning electron microscope,SEM) 德國卡爾蔡司股份公司。
1.3 方法
1.3.1 菌株的培養
將從-80 ℃冰箱取出的金黃色葡萄球菌菌液解凍,然后用接種環蘸取菌液,在BHI固體平板上劃線,并在37 ℃條件下培養24 h,挑取單菌落放置于5 mL的BHI腦心浸液肉湯試管中,37 ℃條件下,200 r/min培養12 h,進入對數期,濃度約為109 CFU/mL,連續轉接2 次后備用[13]。
1.3.2 US、HT、UH處理
HT、US、UH處理金黃色葡萄球菌游離細胞和生物膜細胞。通過恒溫水浴鍋進行HT處理,溫度分別為50、60、70 ℃(HT50、HT60、HT70組),加熱時間分別為5、10、20、30、60 min。在超聲波清洗機(50 kHz、400 W)進行US和UH處理,處理溫度分別為50、60、70 ℃(UH50、UH60、UH70組),處理時間分別為5、10、20、30、60 min。未經任何處理的金黃色葡萄球菌游離細胞和生物膜細胞在室溫下放置5、10、20、30、60 min作為空白對照。
1.3.3 金黃色葡萄球菌游離細胞的滅菌處理
將對數期的金黃色葡萄球菌菌液1 mL收集至離心管中,在4 ℃條件下,5 000 r/min離心10 min,去除培養基,并用0.85 g/100 mL生理鹽水洗滌菌泥3 次,然后注入5 mL 0.85 g/100 mL生理鹽水,制備成菌懸液(約109 CFU/mL)。將金黃色葡萄球菌菌懸液用US、HT50、HT60、HT70、UH50、UH60、UH70分別處理5、10、20、30、60 min。最后,用0.85 g/100 mL生理鹽水連續10 倍梯度稀釋菌懸液,選取合適稀釋梯度的菌懸液1 mL,加入平板,并加入BHI固體培養基,待培養基凝固后放入37 ℃條件下培養24 h,進行菌落計數[13,16]。
1.3.4 金黃色葡萄球菌生物膜細胞的滅菌處理
將1 mL濃度約為107 CFU/mL金黃色葡萄球菌菌液添加到24 孔聚氯乙烯培養板的每個孔中,并在37 ℃條件下培養72 h,每24 h更換培養基。培養72 h后得到生物膜細胞,吸出培養基,并用0.01 mol/L磷酸鹽緩沖液(phosphate buffer saline,PBS)(pH 7.4)清洗生物膜3 次,最后向每個孔中添加1 mL 0.01 mol/L PBS,制備生物膜細胞懸液(約109 CFU/mL)。用US、HT50、HT60、HT70、UH50、UH60、UH70處理生物膜細胞懸液,處理時間分別為5、10、20、30、60 min。經不同處理后,將生物膜溶液收集至裝有9 mL 0.01 mol/L PBS的試管中,用已滅菌的棉簽刮擦孔壁和底部,并將棉簽一起放入試管中。按照1.3.3節方法對生物膜中細胞計數。
1.3.5 SEM和CLSM觀察細胞形態
用US、HT70和UH70處理金黃色葡萄球菌游離細胞和生物膜細胞30 min,此外,未經任何處理并置于室溫下30 min的金黃色葡萄球菌游離細胞和生物膜細胞用作空白對照。
參考Liu Fang等[16]的方法。游離細胞SEM觀察:將處理和未經處理的菌懸液在5 000×g、4 ℃條件下離心10 min,并留下菌泥,然后,將菌泥用體積分數2.5%戊二醛在4 ℃條件下固定12 h,通過SEM觀察游離細胞形態;生物膜細胞SEM觀察:將濃度約107 CFU/mL的未經處理金黃色葡萄球菌菌液(400 ?L)添加到8 孔室載玻片的每個孔中,并根據1.3.4節方法進行生物膜培養,經過不同處理后,將8 孔室載玻片割成小方塊,并用體積分數2.5%戊二醛在4 ℃條件下固定12 h,通過SEM觀察生物膜細胞形態。
參考Liu Fang等[16]的方法。游離細胞CLSM觀察:將處理和未經處理的菌懸液在5 000×g、4 ℃條件下離心10 min,使用LIVE/DEAD BacLightTM試劑盒染色30 min,通過CLSM觀察游離細胞形態;生物膜細胞CLSM觀察:采用SEM分析中的方法培養生物膜,將經不同處理后的生物膜用LIVE/DEAD BacLightTM試劑盒染色30 min,然后去除隔板,在CLSM下觀察生物膜細胞形態。
1.3.6 金黃色葡萄球菌生物膜中胞外多糖含量測定
參考Liu Fang等[16]的方法進行測定。用US、HT70和UH70處理金黃色葡萄球菌生物膜30 min,未經任何處理并置于室溫下30 min的金黃色葡萄球菌生物膜細胞用作空白對照。將處理和未經處理的生物膜細胞收集到不同試管中,在5 000×g、4 ℃條件下離心30 min,收集上清液測定可溶性多糖含量,收集沉淀物并重懸在10 mL 0.85 g/100 mL NaCl溶液(含體積分數0.22%甲醛)中,用于測定不溶性多糖含量。采用苯酚-硫酸法測定可溶性和不溶性多糖含量。
1.3.7 胞外ATP、核酸、蛋白質含量測定
參考Liu Fang[16]、Guo Mingming[17]等的方法。用US、HT50、HT60、HT70、UH50、UH60和UH70處理金黃色葡萄球菌游離細胞和生物膜細胞30 min,在3 000×g、4 ℃條件下離心10 min,收集上清液,用紫外-可見分光光度計測定上清液在260 nm和280 nm波長處的光密度(OD260 nm、OD280 nm),分別用于表征核酸、蛋白質含量。
參考Liu Fang等[16]的方法進行胞外ATP含量測定。用US、HT50、HT60、HT70、UH50、UH60和UH70處理金黃色葡萄球菌游離細胞和生物膜細胞30 min,在10 000×g、0 ℃條件下離心1 min,取上清液,按照試劑盒步驟進行操作測定胞外ATP含量。
1.3.8 呼吸鏈脫氫酶活性測定
通過氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC)實驗測定呼吸鏈脫氫酶的活性[18-19]。用US、HT50、HT60、HT70、UH50、UH60和UH70處理金黃色葡萄球菌游離細胞和生物膜細胞30 min。然后將菌液與2 mL 0.05 mol/L Tris-HCl緩沖液(pH 8.5)、2 mL 0.1 mol/L葡萄糖溶液和2 mL 1 mg/mL TTC溶液混合,并置于37 ℃反應5 h。最后,將樣品與5 mL石油醚混合,并提取有機相。用紫外-可見分光光度計測得有機相在490 nm波長處的光密度(OD490 nm)。呼吸鏈脫氫酶活性與OD490 nm呈正相關,以OD490 nm分析呼吸鏈脫氫酶活性變化。
1.4 數據處理
實驗中所有樣本為3 份,結果表示為平均值±標準差,使用SPSS 26.0軟件中的ANOVA分析對照組與實驗組之間的顯著性差異(P<0.05)。
2 結果與分析
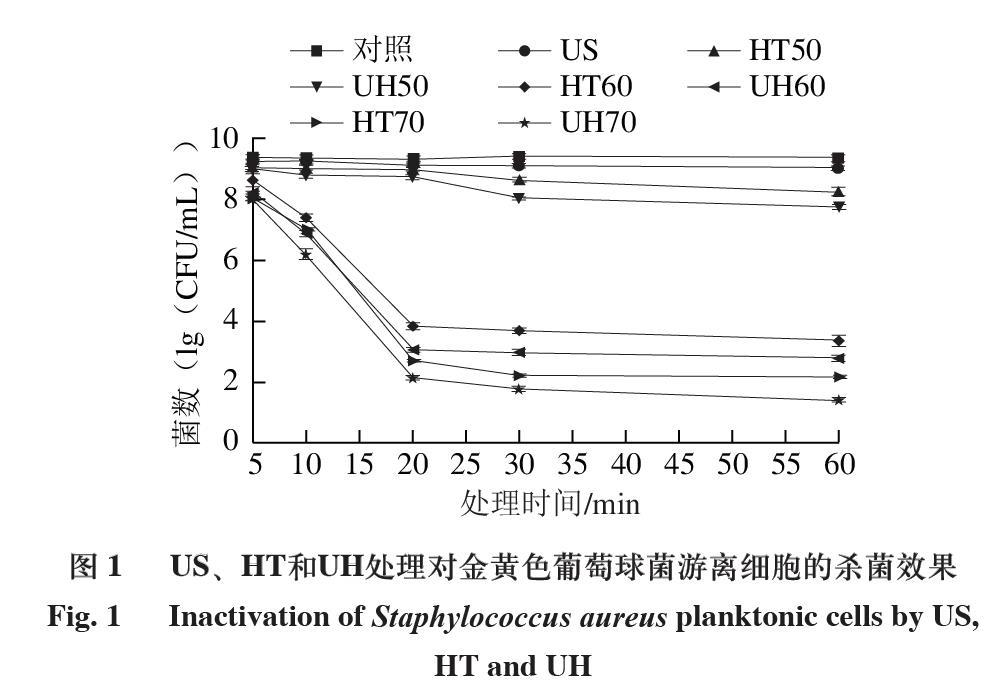
2.1 US、HT和UH處理對金黃色葡萄球菌游離細胞的殺菌效果
由圖1可知,在處理5 min時,US、HT50、HT60和HT70組只能使0.13、0.35、0.75、1.37(1g(CFU/mL))的金黃色葡萄球菌游離細胞失活,而處理30 min時可使0.31、0.79、5.74、7.21(1g(CFU/mL))的金黃色葡萄球菌游離細胞失活。這表明隨著處理時間的延長,金黃色葡萄球菌游離細胞逐漸減少。此外,溫和的熱處理比超聲處理對細菌的滅活更有效。US處理60 min只能使0.35(1g(CFU/mL))的金黃色葡萄球菌游離細胞失活,然而,HT70處理60 min可使7.23(1g(CFU/mL))的金黃色葡萄球菌游離細胞失活。此外,UH比US或HT單獨處理更有效。UH70處理60 min可使得金黃色葡萄球菌游離細胞數量降低到低于檢出限(≤1.4(1g(CFU/mL))),而單獨的US或HT在本研究中的任何處理時間也達不到相同的處理效果。
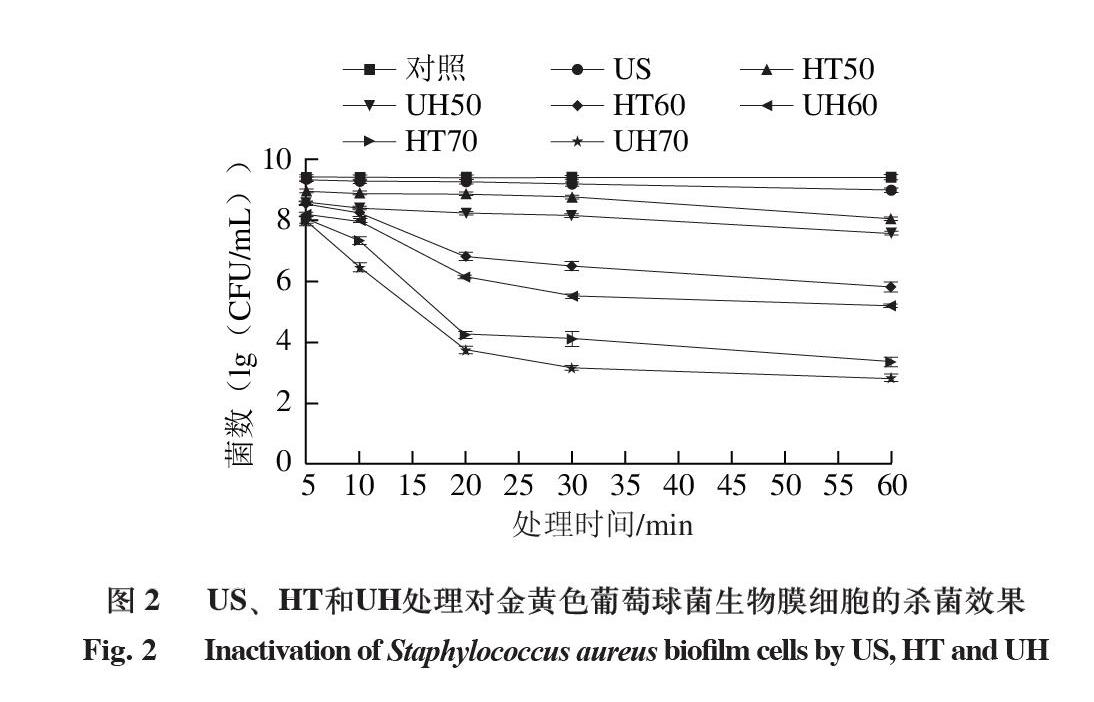
2.2 US、HT和UH處理對金黃色葡萄球菌生物膜細胞的殺菌效果
由圖2可知,對照組的金黃色葡萄球菌生物膜細胞數量約為9.40(1g(CFU/mL)),經US、HT50、HT60和HT70處理5 min后,金黃色葡萄球菌生物膜細胞分別減少0.08、0.46、0.87、1.35(1g(CFU/mL)),處理30 min后分別減少0.22、0.65、2.93、5.35(1g(CFU/mL)),這表明隨著處理時間的延長,金黃色葡萄球菌生物膜細胞逐漸減少。此外,金黃色葡萄球菌生物膜細胞經HT70處理60 min后,減少6.10(1g(CFU/mL)),減少量高于US處理60 min,金黃色葡萄球菌生物膜細胞只能減少0.42(1g(CFU/mL))。UH60處理30 min,生物膜細胞數量的減少值大于US和HT60處理30 min的減少值之和。
2.3 SEM和CLSM觀察
用SEM觀察金黃色葡萄球菌游離細胞和生物膜細胞,由圖3A1~D1、A3~D3可知,對照組的金黃色葡萄球菌游離細胞和生物膜細胞表面完整光滑,無任何孔隙,且生物膜細胞緊密連接在一起,這表明生物膜細胞胞外基質未受到破壞。經US處理30 min后,金黃色葡萄球菌游離細胞和生物膜細胞表面開始出現褶皺,生物膜細胞的胞外基質出現瓦解。而HT70處理30 min后細胞出現萎縮現象,細菌表面開始出現凹陷,生物膜細胞的胞外基質遭到破壞,變得稀疏。UH70處理30 min后,細胞結構受到嚴重破壞,游離細胞內大分子物質外泄,導致細胞黏連在一起,生物膜細胞基質受到嚴重破壞,生物膜變得更稀疏。
用CLSM觀察金黃色葡萄球菌游離細胞和生物膜細胞,由圖3A2~D2、A4~D4可知,對照組金黃色葡萄球菌游離細胞和生物膜細胞發出綠色熒光,這表明所有細菌細胞都是活細胞。經US處理30 min后,少量游離細胞和生物膜細胞被染成紅色,這表明US可造成少量細胞的通透性發生改變。經HT70處理30 min后,游離細胞和生物膜細胞被染成紅色的比例明顯增加,這表明HT70可導致金黃色葡萄球菌游離細胞和生物膜細胞的細胞膜通透性明顯增加。UH70處理30 min后,金黃色葡萄球菌游離細胞和生物膜細胞的細胞膜通透性急劇增加,被染成紅色的細胞比例明顯高于US和HT70處理組。
2.4 金黃色葡萄球菌生物膜胞外多糖含量
大寫字母不同,表示組間差異顯著(P<0.05)。圖5~6同。
由圖4可知,對照組金黃色葡萄球菌生物膜胞外可溶性多糖含量與不溶性多糖含量分別為32.93、62.07 μg/mL。
經US、HT70和UH70處理30 min后生物膜胞外可溶性多糖含量變為26.90、18.60、13.61 μg/mL,不溶性多糖含量變為45.90、27.26、21.04 μg/mL。與對照組相比,US、HT70和UH70處理均可導致金黃色葡萄球菌生物膜胞外多糖含量顯著減少(P<0.05)。此外,UH處理比單獨的US和HT處理能夠更有效降低金黃色葡萄球菌生物膜胞外可溶性多糖與不溶性多糖含量。
2.5 胞外ATP、核酸、蛋白質含量
由圖5A和圖5D可知,對照組的金黃色葡萄球菌游離細胞和生物膜細胞的胞外ATP含量分別為6.69、7.26 nmol/mL。經US、HT50、HT60和HT70處理30 min后,游離細胞的胞外ATP含量分別約為44、135、252、284 nmol/mL,生物膜細胞的胞外ATP含量分別約為26、68、91、170 nmol/mL,這表明游離細胞和生物膜細胞的胞外ATP含量隨著處理溫度的升高而顯著增加,且HT比US能更有效地破壞游離細胞和生物膜細胞的細胞膜(P<0.05)。此外,經UH50、UH60和UH70處理30 min后,游離細胞的胞外ATP含量分別約為153、275、377 nmol/mL,生物膜細胞的胞外ATP含量分別約為75、110、201 nmol/mL。這表明與US和HT單獨處理相比,UH可以更有效地破壞游離細胞和生物膜細胞的細胞膜,引起胞內ATP泄漏到胞外,從而導致胞外ATP含量顯著增加(P<0.05)。
核酸和蛋白質分別在260 nm和280 nm波長處具有最大光密度。與對照組相比,所有處理組均可導致金黃色葡萄球菌游離細胞和生物膜細胞的胞外核酸和蛋白質含量顯著增加(P<0.05),但UH處理組的胞外核酸和蛋白質含量顯著高于US和HT的單一處理組,這表明UH處理組與US和HT單一處理組相比,可對金黃色葡萄球菌游離細胞和生物膜細胞的細胞膜產生嚴重損傷。
2.6 金黃色葡萄球菌游離細胞和生物膜細胞呼吸鏈脫氫酶活性
細菌呼吸鏈脫氫酶活性降低,意味著細菌的呼吸作用和代謝途徑受到抑制。由圖6可知,對照組金黃色葡萄球菌游離細胞和生物膜細胞OD490 nm分別為0.463和0.422。經US、HT50、HT60和UH70處理30 min后的游離細胞OD490 nm分別為0.375、0.355、0.274和0.145,生物膜細胞OD490 nm分別為0.371、0.309、0.188和0.128。此外,經UH50、UH60和UH70處理30 min后的游離細胞OD490 nm分別為0.335、0.200和0.099,生物膜細胞OD490 nm分別為0.287、0.158和0.109。這表明,UH處理比US和HT單獨處理能夠更有效地降低金黃色葡萄球菌游離細胞和生物膜細胞的呼吸鏈脫氫酶活性。
3 討 論
US和HT聯合使用(UH)對金黃色葡萄球菌游離細胞和生物膜細胞具有協同殺菌作用。UH70能滅活金黃色葡萄球菌游離細胞達到無法檢測的水平(≤1.4(1g(CFU/mL))),但單獨的US或HT70處理在任何時間都達不到相同的效果。此外,UH70可以在30 min內滅活6.30(1g(CFU/mL))金黃色葡萄球菌生物膜細胞,但HT70需要60 min才能達到同樣的效果。因此,UH不僅提高了滅菌效率,而且縮短了處理時間。值得注意的是,金黃色葡萄球菌生物膜細胞比游離細胞更難被滅活,這是因為細菌聚集在一起,形成黏附因子,使得菌體細胞聚集在一起,從而增大滅菌的難度[20-21]。Bermúdez-Aguirre等[22]報道,US結合HT處理無害李斯特菌10 min的殺菌效果和單獨熱處理30 min的殺菌效果一樣。Zhu Jinyan等[23]報道,US聯合HT對大腸桿菌O157:H7的殺菌效果明顯優于單獨的US或HT的殺菌效果。Li Jiao等[11]報道,US聯合55 ℃ HT具有明顯的協同殺菌作用,二者聯合處理的殺菌效果顯著高于單獨US和55 ℃ HT的殺菌效果。US和HT具有協同殺菌作用,這種協同殺菌作用的產生主要歸因于二者單獨處理都會產生亞致死損傷細胞,當二者聯用時,這部分亞致死損傷細胞會被HT迅速滅活,從而產生協同殺菌作用[24]。
近年來,許多研究還報道了US和化學抑菌劑聯合使用具有明顯的協同殺菌作用。José等[25]報道,US與40 mg/L過氧乙酸聯合使用可以顯著滅活櫻桃和番茄上的鼠傷寒沙門氏菌,二者具有明顯的協同殺菌作用。Huu等[26]報道,低頻率的US和沒食子酸丙酯聯合處理可以顯著提高殺菌效率。He Qiao等[27]報道,US聯合百里香精油納米乳具有明顯的協同殺菌作用,二者聯合處理可顯著提高對金黃色葡萄球菌的殺菌作用。US和化學抑菌劑的結合具有明顯的協同殺菌作用,這種協同作用主要歸因于US可以破壞菌體細胞的細胞膜,從而促進抑菌劑更好滲入細胞,破壞菌體細胞的結構[28]。
通過SEM圖像可以看出,UH可以嚴重破壞金黃色葡萄球菌菌體細胞完整性。此外,CLSM圖像顯示,UH處理后菌體細胞的細胞膜通透性急劇增加,從而導致胞外ATP和核酸、蛋白質含量顯著增加[29]。許愈等[13]報道,US聯合酸性電解水處理可嚴重破壞副溶血性弧菌的細胞膜完整性,造成細胞內的蛋白質大量流出至胞外。Guo Liping等[12]報道,US與次氯酸鈉聯合使用可導致大腸桿菌細胞內K+外泄,并損壞大腸桿菌的細胞膜。Guo Mingming等[17]報道,US聯合百里香精油納米乳可以嚴重破壞大腸桿菌的細胞膜,造成胞內蛋白和核酸外泄。此外,UH顯著降低金黃色葡萄球菌生物膜胞外多糖含量,破壞生物膜的胞外基質。生物膜胞外基質一旦受到破壞,生物膜結構會迅速瓦解,加快菌體的死亡。Liu Fang等[16]報道,苯乳酸與微酸電解水的結合比單一處理能夠更有效破壞生物膜的胞外基質,降低生物膜胞外多糖含量,導致菌體死亡。上述結果表明,當細胞膜的通透性和完整性受到破壞時,細胞內的ATP、核酸和蛋白質就會釋放出來。盡管單一的US處理不足以使細菌細胞失活,但US能夠破壞菌體的細胞膜,從而導致化學抑菌劑或熱處理能夠更好地滅活細胞。
4 結 論
UH處理能有效增強對金黃色葡萄球菌游離細胞和生物膜細胞的殺菌效果,具有明顯的協同殺菌作用。此外,SEM圖像顯示,UH處理嚴重破壞了金黃色葡萄球菌游離細胞和生物膜細胞膜的完整性。CLSM圖像顯示,UH處理能夠顯著提高金黃色葡萄球菌游離細胞和生物膜細胞膜的通透性,從而導致胞內大分子物質外泄,呼吸鏈脫氫酶活性降低。因此,US與HT的結合主要通過破壞金黃色葡萄球菌游離細胞和生物膜細胞的細胞膜完整性,引起細胞膜通透性改變,造成ATP、核酸、蛋白質外泄,降低細菌呼吸鏈脫氫酶活性,來達到協同殺菌的目的。
參考文獻:
[1] 胡洋健, 鄧紹林, 張馨月, 等. 宰后不同成熟時間處理對白切雞肉食用品質的改善[J]. 現代食品科技, 2020, 36(11): 170-179. DOI:10.13982/j.mfst.1673-9078.2020.11.0505.
[2] 茹志瑩, 陳芷雯, 吳少福, 等. 冰溫氣調保鮮對雞肉保鮮的影響[J].?江西農業大學學報, 2020, 42(6): 1213-1221. DOI:10.13836/j.jjau.2020135.
[3] KANG Jiamu, JIN Wenyuan, WANG Jingfan, et al. Antibacterial and anti-biofilm activities of peppermint essential oil against Staphylococcus aureus[J]. LWT-Food Science and Technology, 2019, 101: 639-645. DOI:10.1016/j.lwt.2018.11.093.
[4] COSTA R S, LINS M O, HYARIC M, et al. In vitro antibacterial effects of Zanthoxylum tingoassuiba root bark extracts and two of its alkaloids against multiresistant Staphylococcus aureus[J]. Revista Brasileira de Farmacognosia, 2016, 27(2): 195-198. DOI:10.1016/j.bjp.2016.11.001.
[5] PREZZI L E, LEE S H I, NUNES V M R, et al. Effect of Lactobacillus rhamnosus on growth of Listeria monocytogenes and Staphylococcus aureus in a probiotic Minas Frescal cheese[J]. Food Microbiology, 2020, 92: 103557. DOI:10.1016/j.fm.2020.103557.
[6] TENDERIS B, YALCM H, SIMSEK A, et al. Impact of sodium lactate, encapsulated or unencapsulated polyphosphates and their combinations on Salmonella typhimurium, Escherichia coli O157:H7 and Staphylococcus aureus growth in cooked ground beef[J]. International Journal of Food Microbiology, 2020, 321: 108560. DOI:10.1016/j.ijfoodmicro.2020.108560.
[7] LI Qiuchun, LI Yang, TANG Yuanyue, et al. Prevalence and characterization of Staphylococcus aureus and Staphylococcus argenteus in chicken from retail markets in China[J]. Food Control, 2019, 96: 158-164. DOI:10.1016/j.foodcont.2018.08.030.
[8] CUI Haiying, ZHANG Chenghui, LI Changzhu, et al. Inhibition mechanism of cardamom essential oil on methicillin-resistant Staphylococcus aureus biofilm[J]. LWT-Food Science and Technology, 2020, 122: 109057. DOI:10.1016/j.lwt.2020.109057.
[9] KIM W J, KIM S H, KANG D H. Thermal and non-thermal treatment effects on Staphylococcus aureus biofilms formed at different temperatures and maturation periods[J]. Food Research International, 2020, 137: 109432. DOI:10.1016/j.foodres.2020.109432.
[10] WANG Huawei, WANG Huhu, LIANG Lijiao, et al. Prevalence, genetic characterization and biofilm formation in vitro of Staphylococcus aureus isolated from raw chicken meat at retail level in Nanjing, China[J]. Food Control, 2018, 86: 11-18. DOI:10.1016/j.foodcont.2017.10.028.
[11] LI Jiao, SUO Yuanjie, LIAO Xinyu, et al. Analysis of Staphylococcus aureus cell viability, sublethal injury and death induced by synergistic combination of ultrasound and mild heat[J]. Ultrasonics Sonochemistry, 2017, 39: 101-110. DOI:10.1016/j.ultsonch.2017.04.019.
[12] GUO Liping, SUN Yongcai, ZHU Yinglian, et al. The antibacterial mechanism of ultrasound in combination with sodium hypochlorite in the control of Escherichia coli[J]. Food Research International, 2019, 129: 108887. DOI:10.1016/j.foodres.2019.1088.
[13] 許愈, 張昭寰, 趙莉, 等. 應用酸性電解水聯合超聲波殺滅副溶血性弧菌[J]. 上海海洋大學學報, 2020, 29(4): 578-584. DOI:10.12024/jsou.20190402604.
[14] ACUFF J C, WU J, MARIK C, et al. Thermal inactivation of Salmonella, Shiga toxin-producing Escherichia coli, Listeria monocytogenes, and a surrogate (Pediococcus acidilactici) on raisins, apricot halves, and macadamia nuts using vacuum-steam pasteurization[J]. International Journal of Food Microbiology, 2020, 333: 108814. DOI:10.1016/j.ijfoodmicro.2020.108814
[15] LI Jiao, CHENG Huan, LIU Donghong, et al. Inactivation of Bacillus subtilis and quality assurance in Chinese bayberry (Myrica rubra) juice with ultrasound and mild heat[J]. LWT-Food Science and Technology, 2019, 108: 113-119. DOI:10.1016/j.lwt.2019.03.061.
[16] LIU Fang, TANG Chun, WANG Debao, et al. The synergistic effects of phenyllactic acid and slightly acid electrolyzed water to effectively inactivate Klebsiella oxytoca planktonic and biofilm cells[J]. Food Control, 2020, 20: 107804. DOI:10.1016/j.foodcont.2020.107804.
[17] GUO Mingming, ZHANG Lianjiao, HE Qiao, et al. Synergistic antibacterial effects of ultrasound and thyme essential oils nanoemulsion against Escherichia coli O157:H7[J]. Ultrasonics Sonochemistry, 2020, 66: 104988. DOI:10.1016/j.ultsonch.2020.104988.
[18] LIU Xue, CAI Jiaxin, CHEN Haimin, et al. Antibacterial activity and mechanism of linalool against Pseudomonas aeruginosa[J]. Microbial Pathogenesis, 2020, 141: 103980. DOI:10.1016/j.micpath.2020.103980.
[19] 林祎. 聲熱復合處理對液態乳中致病菌的殺菌效果與理化特性影響研究[D]. 杭州: 浙江大學, 2018: 36.
[20] 楊璐環, 鄧一秒, 吳希陽, 等. 阪崎腸桿菌生物膜形成條件及超聲波對其去除作用[J]. 食品與發酵工業, 2018, 44(7): 55-62. DOI:10.13995/j.cnki.11-1802/ts.016680.
[21] 張悅, 賀銀鳳, 顧悅, 等. 高產生物膜乳酸菌抗逆性及其抗氧化特性[J]. 農業工程學報, 2021, 37(6): 282-288. DOI:10.11975/j.issn.1002-6819.2021.06.034.
[22] BERMúDEZ-AGUIRRE D, CORRADINI M G, MAWSON R, et al. Modeling the inactivation of Listeria innocua in raw whole milk treated under thermo-sonication[J]. Innovative Food Science and Emerging Technologies, 2009, 10(2): 172-178. DOI:10.1016/j.ifset.2008.11.005.
[23] ZHU Jinyan, WANG Yuehua, LI Xinghe, et al. Combined effect of ultrasound, heat, and pressure on Escherichia coli O157:H7, polyphenol oxidase activity, and anthocyanins in blueberry (Vaccinium corymbosum) juice[J]. Ultrasonics Sonochemistry, 2017, 37: 251-259. DOI:10.1016/j.ultsonch.2017.01.017.
[24] 遲媛, 弓敏, 馬艷秋, 等. 超聲協同次氯酸鈉殺滅腐敗菌效果與動力學研究[J]. 農業機械學報, 2020, 51(7): 372-381. DOI:10.6041 /j.issn.1000-1298.2020.07.042.
[25] JOSé J F B S, VANETTI M C D. Effect of ultrasound and commercial sanitizers in removing natural contaminants and Salmonella enterica typhimurium on cherry tomatoes[J]. Food Control, 2012, 24: 95-99. DOI:10.1016/j.foodcont.2011.09.008.
[26] HUU C N, RAI R, YANG Xu, et al. Synergistic inactivation of bacteria based on a combination of low frequency, low-intensity ultrasound and a food grade antioxidant[J]. Ultrasonics Sonochemistry, 2021, 74: 105567. DOI:10.1016/j.ultsonch.2021.105567.
[27] HE Qiao, ZHANG Lianjiao, SONG Luyao, et al. Inactivation of Staphylococcus aureus using ultrasound in combination with thyme essential oil nanoemulsions and its synergistic mechanism[J]. LWT-Food Science and Technology, 2021, 147: 111574. DOI:10.1016/j.lwt.2021.111574.
[28] YU Hang, LIU Yang, YANG Fangwei, et al. Synergistic efficacy of high-intensity ultrasound and chlorine dioxide combination for Staphylococcus aureus biofilm control[J]. Food Control, 2021, 122: 107822. DOI:10.1016/j.foodcont.2020.107822.
[29] HE Qiao, LIU Donghong, ASHOKKUMAR M, et al. Antibacterial mechanism of ultrasound against Escherichia coli: alterations in membrane microstructures and properties[J]. Ultrasonics Sonochemistry, 2021, 73(1): 105509. DOI:10.1016/j.ultsonch.2021.105509.
收稿日期:2021-08-09
基金項目:國家自然科學基金面上項目(31871866);江蘇省農業科技自主創新基金項目(CX(21)2016);
國家現代農業(肉雞)產業技術體系建設專項(CARS-41);江蘇省蘇北科技專項(XZ-SZ202013)
第一作者簡介:孫晉躍(1995—)(ORCID: 0000-0003-0074-1370),男,碩士研究生,研究方向為畜禽產品質量安全。
E-mail: 2055163428@qq.com
*通信作者簡介:劉芳(1982—)(ORCID: 0000-0002-2302-027X),女,研究員,博士,研究方向為畜禽產品質量安全。
E-mail: fangliu82@163.com

