DRR1 與TMOD2 在人宮頸癌細胞HeLa 中相互作用的研究
蔡云龍 劉宇希 陳曉 孫曉雨 盧方晉
腎細胞癌下調蛋白 1(Down-regulated in renal cell carcinoma 1,DRR1)是一種新的肌動蛋白的結合蛋白,可以促進絲狀肌動蛋白(F-actin)的形成[1,2]。同時,DRR1 在腫瘤以及在神經系統中的生物學作用已被廣泛報道[3-7],然而關于DRR1 的相關作用機制仍尚不明確。DRR1 的氨基酸序列中存在卷曲螺旋結構域 (coiled-coil domain),表明其可以與其他蛋白質相互結合[8]。前期研究結果發現DRR1 可以與F-actin 結合并促進F-actin 的形成[6],F-actin 是一種高度保守的蛋白,參與機體多種生物學活動[9,10]。最近,通過GST pull down 實驗篩選與DRR1 相互作用的蛋白質,質譜分析結果確定TMOD2 是與DRR1 相互結合的蛋白之一[11]。結果顯示,TMOD2 與DRR1 在原代培養海馬神經元細胞中相結合,并且共同參與調節神經細胞軸突的形成[11]。TMOD 是一個肌動蛋白結合蛋白家族,包括四個成員(TMOD1,TMOD2,TMOD3 和TMOD4)[12],其中TMOD1 和TMOD3 在各種組織中高表達,而TMOD2 和TMOD4 分別在神經系統和骨骼肌中表達,TMOD2 現已被證明能調節神經元的神經突延伸和突觸密度[13]。另外,有研究證明,TMOD 蛋白家族可以通過與F-actin 結合從而調節肌動蛋白動力學[14]。本研究中,利用免疫共沉降技術深入分析不同長度的DRR1片段與TMOD2 之間在細胞內的相互作用。結果發現,不同長度的DRR1 片段與TMOD2 的結合能力存在差異。本研究成果為揭示DRR1 與TMOD2 之間的相互作用,以及兩者結合后的生物學功能提供了新的線索。
1 材料與方法
1.1 材料 兔抗Venus 抗體(日本MBL 公司)和小鼠抗血凝素抗體(抗HA、美國sigma-aldrich 公司),蛋白G 瓊脂糖凝膠(protein G sepharose,美國GE Healthcare公司),胎牛血清(美國Gibco 公司)。不同長度的DRR1 表達載體與TMOD2-HA 表達載體的構建方法按照前期研究進行[6,10]。
1.2 細胞培養 HeLa 細胞購自碧云天公司,用含有10% 胎牛血清的DMEM 培養基于37℃培養。細胞轉染實驗使用Lipofectamine 3000(美國Invitrogen 公司)按照說明書要求進行。
1.3 免疫共沉降 用RIPA 裂解緩沖液(50 mM Tris-Hcl,pH 7.4,150 mM NaCl,1% NP-40,1% sodium dexycholate,0.1% SDS)制備細胞裂解液。將細胞裂解液與相應的抗體在4℃ 孵育4 h 后,與蛋白質 G 瓊脂糖凝膠混合,然后在4℃下再孵育2 h。混合物在4℃下以15000 rpm 轉速離心10 min,用冷磷酸鹽緩沖液洗滌沉淀3 次。在最后一次清洗后,將樣品緩沖液加入到沉淀中,并將樣品煮沸5 min,再次在4℃下以15000 r/min 轉速離心10 min,收集上清液進行免疫印跡分析。
2 結果
2.1 制備不同長度的DRR1 蛋白片段 DRR1 蛋白質由144 個氨基酸組成,通過蛋白質一級結構分析軟件分析,確認了DRR1 蛋白質中有一個卷曲螺旋結構域 (coiled-coil domain)和一個核定位信號(nuclear localization signal,NLS)。根據這兩個結構域存在的位置,設計了4 個不同長度的DRR1 片段,并構建了相應的表達載體。見圖1。
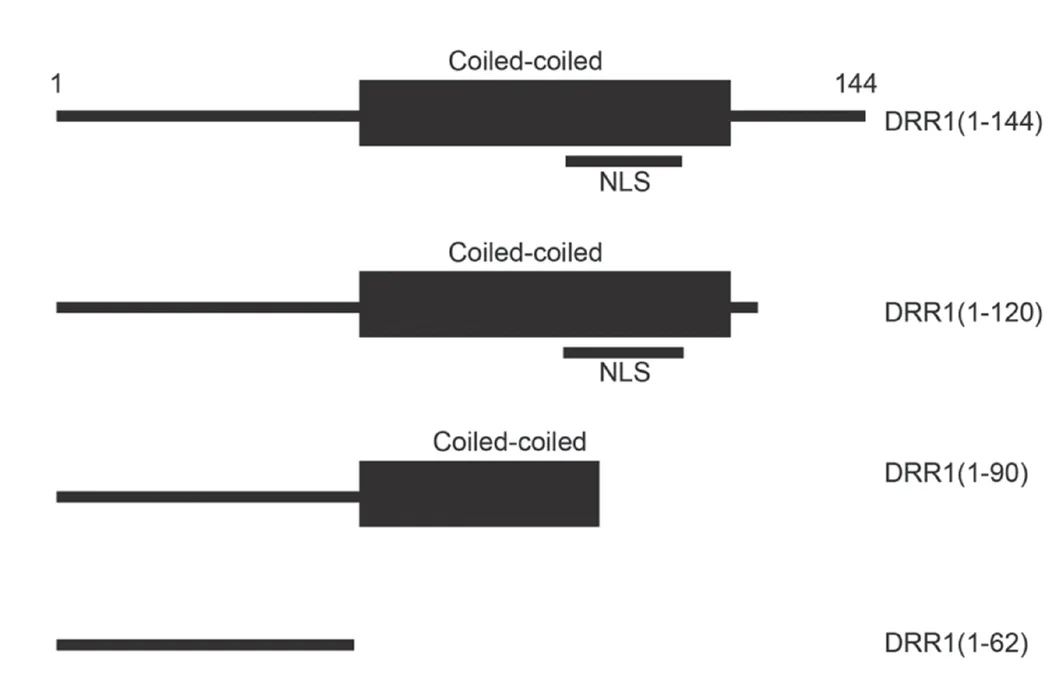
圖1 不同長度的DRR1 蛋白質片段示意圖
為了檢測不同DRR1 區域與TMOD2 在細胞中相互結合的情況,首先構建了4 種表達不同長度DRR1蛋白的表達載體:DRR1(1-62)-Venus,DRR1(1-90)-Venus,DRR1(1-120)-Venus 和DRR1(1-144)-Venus。將不同的表達載體分別轉染到HeLa 細胞,3 d 后裂解細胞獲得裂解液并進行免疫印跡試驗。結果顯示,各個不同長度DRR1 蛋白片段在免疫印跡中的條帶位置與理論預測分子量一致。見圖2。
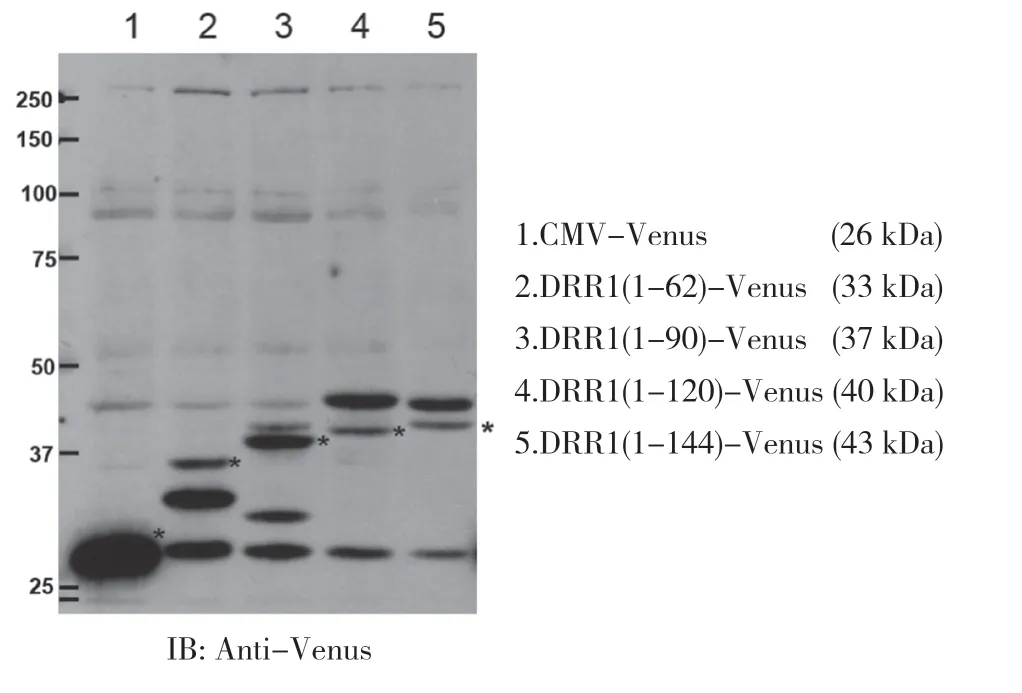
圖2 在HeLa 細胞中表達的不同長度的DRR1 蛋白片段
2.2 DRR1 與TMOD2 相互結合 前期通過GST pull down 實驗發現TMOD2 是DRR1 的結合蛋白,并通過免疫共沉降實驗進行了驗證。為了進一步確認DRR1與TMOD2 結合的區域,將表達不同長度DRR1 片段的載體分別與TMOD2-HA 載體共轉染至HeLa 細胞,3 d 后收集細胞獲得細胞裂解液,利用抗Venus 抗體進行免疫共沉降,再利用免疫印跡實驗對沉降蛋白進行檢測。結果顯示各個樣本中不同長度的DRR1 蛋白片段均能被沉降下來,其中DRR1(1-90)蛋白片段組、DRR1(1-120)蛋白片段組和全長DRR1(1-144)蛋白組,都可見TMOD2-HA 陽性條帶,而DRR1(1-62)蛋白片段組和陰性對照CMV-Venus 組未見TMOD2-HA 陽性條帶。見圖3。
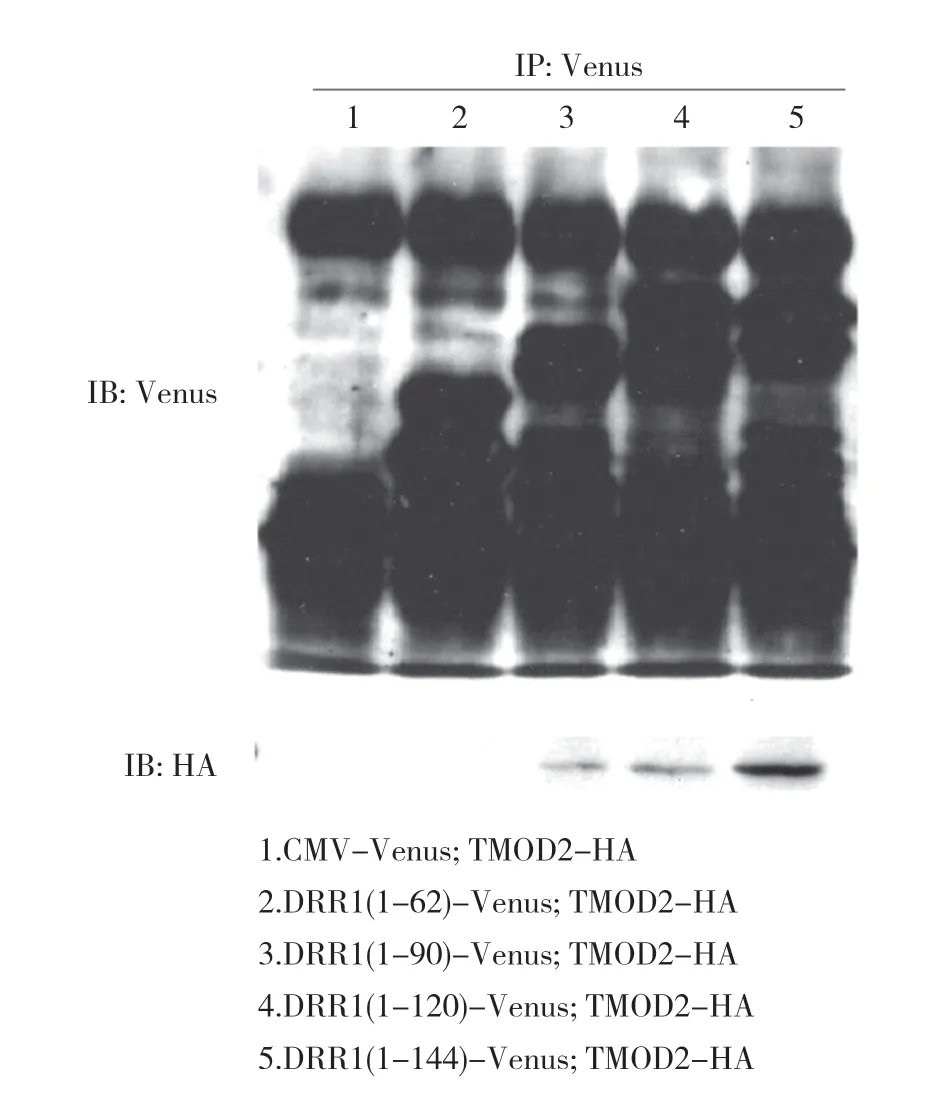
圖3 TMOD2 與DRR1 在HeLa 細胞中結合
為了進一步確認上述結果,在載體轉染后,利用抗HA 抗體進行免疫共沉降,并利用免疫印跡實驗進行分析。結果顯示各個樣本中的TMOD2-HA 都成功地被沉降下來,其中DRR1(1-90)蛋白片段組、DRR1(1-120)蛋白片段組和全長DRR1(1-144)蛋白組,可見相應的DRR1 蛋白片段的條帶,而陰性對照CMV-Venus 組和DRR1(1-62)蛋白片段組未見相應的DRR1 蛋白片段的條帶。見圖4。
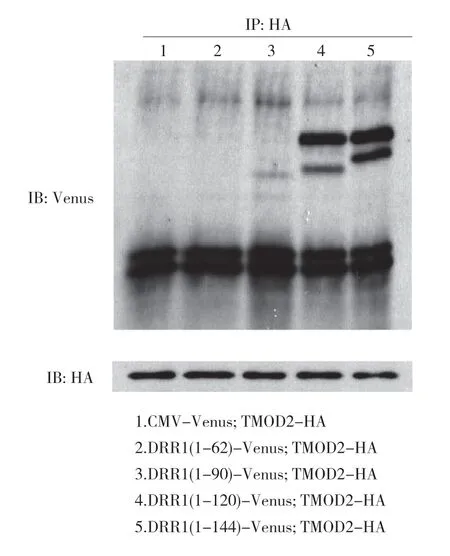
圖4 DRR1 與TMOD2 在HeLa 細胞中結合
3 討論
目前為止,多項研究結果已經證明DRR1 是肌動蛋白的結合蛋白,且已證實DRR1 與F-actin 的正端(barded end)結合[2]。而TOMD2 也是肌動蛋白的一個結合蛋白,與絲狀肌動蛋白F-actin 的負端(pointed end)結合[12]。
本研究發現DRR1(1-90)蛋白片段、DRR1(1-120)蛋白片段和全長DRR1(1-144)蛋白可以與TOMD2 結合,而DRR1(1-62)蛋白片段不能與TOMD2 結合。通過分析DRR1 蛋白質的氨基酸序列,發現DRR1(1-90)蛋白片段、DRR1(1-120) 蛋白片段和全長DRR1(1-144)蛋白均含有完整卷曲螺旋結構域,而DRR1(1-62)蛋白片段不含有該結構域,提示TMOD2 可能與DRR1 蛋白的卷曲螺旋結構域結合。
DRR1 和TMOD2 均為肌動蛋白的結合蛋白,都參與F-actin 的形成,但目前的研究發現二者在某些生物學功能上呈現相反的作用。通過過表達DRR1 會導致神經元細胞棘狀突起的密度降低[15],然而過表達TMOD2 則會增加神經元細胞棘狀突起的密度[14]。研究結果顯示,敲除DRR1 和TMOD2 基因對海馬神經元細胞早期軸突形成也起到相反的作用,DRR1 基因下調抑制神經元細胞軸突生長,而TMOD2 基因下調促進神經元細胞軸突生長,同時,TMOD2 的表達下調對DRR1 shRNA 誘導的異常軸突形成具有保護作用[11]。
以上結果提示DRR1 和TMOD2 共同參與調節肌動蛋白動力學,并且兩者對肌動蛋白動力學的調節存在一定的差異,關于TMOD2 與DRR1 在細胞中結合后如何調節肌動蛋白動力學是值得進一步研究的問題。

