大鼠腎脫細胞支架的制備研究
肖昀明,湯黎峰,耿光瑞,張 穎,朱 飛,沈婉君,李清剛,陳香美 解放軍醫學院,北京 008; 解放軍總醫院第一醫學中心 腎臟病醫學部,解放軍腎臟病研究所,腎臟疾病國家重點實驗室,國家慢性腎病臨床醫學研究中心,腎臟疾病研究北京市重點實驗室 北京008; 廣東藥科大學中藥學院,廣東廣州 0006; 南開大學醫學院,天津 0007; 解放軍總醫院第一醫學中心 超聲科,北京 008
目前終末期腎病的治療方案是以腎移植為主的腎替代治療,而腎移植受限于供體腎源短缺[1]。為解決此問題,世界范圍內展開了腎再生技術的研究。近年來,源自天然腎的細胞外基質引起研究者們的興趣,并將其作為再生支架廣泛應用于生物人工腎工程中,已成為腎再生技術的研究熱點之一。近年來經過眾多學者們的努力,2009年首次報道的通過SDS溶液制備腎脫細胞支架,能夠成功脫細胞的器官有軟骨、骨骼肌、心臟、血管、肺、肝、胰腺等[2-8]。但專家學者們對基于完整器官的脫細胞支架制備方案并沒有共識,具體的灌注洗脫的流速與方式也沒有統一標準[9],也尚無系統研究比較暴露時間和不同方法對DNA去除、脫細胞支架宏觀和微觀結構損失的影響[10]。本研究通過不同流速的洗脫劑灌注大鼠腎,從而制備脫細胞支架。并記錄不同流速下脫細胞所需要的時間、脫細胞支架的干重和鮑曼氏囊面積等,探究制備腎脫細胞支架所使用灌注液的最佳流速,評價腎脫細胞支架的完整性和安全性。
材料與方法
1 實驗動物 120只SPF級別10周齡雄性SD大鼠,購自斯貝福生物技術有限公司。飼養條件:飼養于解放軍總醫院實驗動物中心,白天12 h/黑夜12 h循環,自由飲食飲水,飼養溫度為20℃~24℃,相對濕度為40%~60%。本實驗經解放軍總醫院實驗動物倫理委員會審批通過(2020-X 16-34)。
2 主要實驗設備及材料 氣體麻醉機(MSSN6089);體式顯微鏡(TOPCON);蠕動泵(SENZ 310HT);真空冷凍干燥機(科旺達生物儀器有限公司ZLGJ-10);超聲儀(邁瑞M9,7 ~ 13 MHz線性列陣探頭);電子天平(賽多利斯科學儀器);激光酶標儀(TECAN);組織研磨儀(QIAGEN);紫外分光光度計(Nanodrop2000c);SDS(VWR 0227);磷酸鹽緩沖液(CORNING 21-031-CV);注射用六氟化硫微泡(SonoVue);24G動靜脈留置針(BRAUN);蘇木素-伊紅(HE)染色試劑盒、過碘酸-希夫氏(PAS)染色試劑盒、MASSON染色試劑盒(索萊寶生物技術有限公司);DNA提取試劑盒(QIAGEN);SDS檢測試劑盒(Sangon Biotech);細胞計數試劑盒(MCE HY-K0301);永生化人腎小管上皮細胞(ATCC HK-2);Anti-Collagen Ⅳ抗體(ABCAM a b236640)。
3 脫細胞支架的制備方法 30只大鼠用于制備腎脫細胞支架。大鼠麻醉后尾靜脈注射1 mL肝素濃度為250 U/mL的0.9%氯化鈉注射液,腹部正中切口,游離左腎及動靜脈。近心端夾閉左腎動脈后剪斷,用24G留置針插入左腎動脈,3-0絲線結扎固定。夾閉并剪斷左腎靜脈及輸尿管。將腎完全浸沒于0.9%氯化鈉注射液中,使用蠕動泵經腎動脈留置針灌注肝素氯化鈉注射液直至整個腎變為灰白色。將腎完全浸沒于在含有抗生素的磷酸鹽緩沖液中,置于-80℃低溫冰箱中。24 h后取出解凍,將解凍后的腎連接至蠕動泵,將腎整個浸沒于0.9%氯化鈉注射液中,0.5% (w/v) SDS溶液灌洗,將蠕動泵流速分別調整為0.1 mL/min(S0.1)、0.5 mL/min (S0.5)、1 mL/min (S1)、5 mL/min (S5)、10 mL/min (S10)、20 mL/min(S20),每組5個腎。觀察并記錄腎變透明時間,待腎變透明后將蠕動泵入口的液體更換為純水,灌 洗12 h。
4 脫細胞支架凍干及稱重 30只大鼠用于天然腎和脫細胞支架的凍干及稱重。純水沖洗脫細胞支架12 h后剪去留置針,和天然腎一起放置于冷凍干燥機內,開啟冷凍模式4 h后轉為真空模式,干 燥24 h后取出稱重,每個腎稱量3次。
5 常規病理學觀察 30只大鼠用于脫細胞支架的常規病理學染色、免疫組織化學染色和透射電鏡檢查。將純水沖洗12 h后的各組脫細胞支架和天然腎置于10倍組織體積的固定液中固定24 h。組織經梯度乙醇脫水后,氯仿透明、浸蠟、包埋后切片。觀察脫細胞支架是否將細胞洗脫干凈,行HE染色:常規脫蠟后蘇木素浸染2 min、鹽酸乙醇分化3 s、氨水反藍后伊紅浸染3 s,乙醇梯度脫水、二甲苯浸泡透明后封片。觀察腎中膠原纖維的保留情況、細胞核成分的殘留和計算鮑曼氏囊面積,行PAS染色:過碘酸1 h、希夫氏液40 min、溫水浸泡30 min后浸染蘇木素,經鹽酸乙醇和氨水分化反藍,脫水、透明并封片。觀察膠原纖維的保留情況行Masson染色:媒染劑20 min、蘇木素染色并分化反藍,Masson染液浸染10 min后1%醋酸洗,再經過2.5%磷鎢酸、2%橘黃G、1%苯胺藍染色,脫水、透明并封片。鮑曼氏囊面積使用image J軟件對PAS染色結果 中的進行描邊測算。
6 免疫組織化學染色 脫細胞支架和天然腎石蠟切片常規脫蠟后,1 mol/L枸櫞酸鉀溶液浸泡,微波爐加熱修復抗原。山羊血清封閉后,加入一抗CollagenⅣ(1∶100),4℃孵育過夜,二抗孵育后,DAB顯色。蘇木素復染后脫水封片。上鏡觀察并對比天然腎和脫細胞支架的Ⅳ型膠原蛋白的分 布。
7 透射電鏡檢查 脫細胞支架經固定、脫水、干燥處理,在包埋膠囊中用環氧樹脂包埋劑包埋樣本。組織固化后,超薄切片機切片,厚度50 nm。用醋酸鈾飽和溶液、枸櫞酸鉛溶液染色。上機觀察 腎小球毛細血管袢、基底膜和鮑曼氏囊的完整性。
8 DNA和SDS殘留檢測 30只大鼠用于脫細胞支架的DNA和SDS殘留檢測。脫細胞支架經純水灌洗12 h后,使用真空凍干機凍干脫細胞支架和天然腎,按照DNA提取試劑盒操作說明提取脫細胞支架和天然腎的DNA,使用Nanodrop2000c對所提取的核酸進行定量后對比DNA洗脫率。將凍干后脫細胞支架和天然腎在組織研磨儀中研磨,按照SDS殘留試劑盒說明書操作萃取組織中的SDS并轉移至96孔板中,使用酶標儀測量499 nm下各孔的OD值,根據標準曲線計算各組S DS殘留量。
9 DNA瓊脂糖電泳 配置1%瓊脂糖溶液(w/v),微波爐中大火加熱3 min至均一透明,按照1∶10 000的比例加入核酸染料,混勻后倒入配膠槽并插入梳子。將配好的凝膠轉移至水平電泳槽,倒入TAE電泳液。第1個孔內上樣6 μL DNA Ladder。將提取出的DNA加入DNA Loading Buffer,混勻后上樣,每孔上樣10 μL。第2~6孔加入天然腎提取的DNA,第7~11孔加入脫細胞支架提取的DNA。80 V恒壓電泳。上機拍照凝膠 ,觀察各組的DNA條帶的分布。
10 超聲及超聲造影檢查 脫細胞支架經純水灌洗12 h后,使用魯爾接頭將蠕動泵硅膠管與三通閥和腎動靜脈留置針相接,注射器連接在三通閥上。將腎完全浸于0.9%氯化鈉注射液中,超聲探頭伸入液面以下,進行灰階檢查觀察支架是否完整。開啟蠕動泵流速0.5 mL/min,造影檢查用0.5 mL 0.9%氯化鈉注射液稀釋50倍的微泡造影劑,1 s內推注完畢,開始推注造影劑的同時采集超聲造影視頻,觀察支架內血管網絡強化速度和支 架表面是否有造影劑滲漏。
11 細胞毒性實驗 細胞毒性實驗設置實驗組和對照組。實驗組培養基按照GB/T 16886.5-2017中的方法制備脫細胞支架浸提液:將純水灌洗12 h后的脫細胞支架浸泡在5%含血清培養基中,置于37℃恒溫箱中浸提72 h。對照組培養基不加入脫細胞支架,與實驗組放置于相同條件下72 h。96孔板中接種HK-2細胞(3 000/孔),實驗組和對照組各6個復孔,第2天待細胞貼壁后更換為各組的培養基100 μL/孔,放入二氧化碳孵箱中培養48 h,每天換液。48 h后每孔加入10 μL CCK8試劑,放入孵箱中2 h后使用酶標儀測量各孔450 nm處的OD值,對比兩組OD值判斷脫細胞支 架的細胞毒性。
12 統計學方法 采用SPSS統計軟件進行統計分析,GraphPad Prism進行繪圖,計量資料以 xˉ±s表示,組間比較使用t檢驗,多組數據之間比較使用單因素方差分析(one-way ANOVA),P<0.05為差 異有統計學意義。
結 果
1 脫細胞支架的大體觀 在脫細胞過程中,可觀察到腎靜脈有深棕色的液體排出。隨后可觀察到整個腎從皮質至髓質逐漸分段變為透明,前期腎皮質區域的脫細胞速度較快,后期髓質區域的脫細 胞速度較為緩慢,直至整個腎變為透明狀(圖1)。
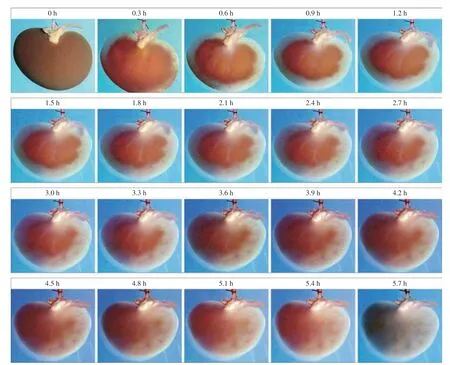
圖1 液體環境中的脫細胞時序變化(流速0.5 mL/min)Fig.1 Decellularization changes over time in liquid environment (flow rate 0.5 mL/min)
2 不同流速下腎脫細胞支架 通過不同的灌注流速洗脫腎制備脫細胞支架,可以觀察到隨著流速的增加,脫細胞的時間呈下降趨勢(圖2A)。當流速為0.1 mL/min時,脫細胞的時間約1 h,當流速大于10 mL/min時,脫細胞時間整體降為3 h以內。采用明顯超出SD大鼠腎動脈生理流速的20 mL/min時,時間減小至1 h以內,制得的腎脫細胞支架發白、透光度較差。不同流速下制備的腎脫細胞支架經凍干后稱重,各組間無明顯差異,均在10 mg左右(圖2B)。相同的天然腎干重則 高達300 mg。

圖2 不同流速下的脫細胞表現A:不同流速下各流速組脫細胞所需要的時間(n=5);B:天然腎和不同流速下制備的脫細胞支架的干重(n=5);C:天然腎和不同流速下制備的脫細胞支架的鮑曼氏囊面積(n=5)。NK:天然腎;aP<0.000 1Fig.2 Decellularization results at different flow ratesA: The time required for decellularization at different flow rates (n=5); B: The dry weight of decellularization at different flow rates(n=5); C: The area of Bowman's area decellularized at different flow rates (n=5). NK: natural kidney; aP<0.000 1
3 不同流速下脫細胞支架的鮑曼氏囊面積 經PAS染色的鮑曼氏囊面積計算發現,不同流速下腎脫細胞支架的鮑曼氏囊面積隨著流速增加而增大。以1 mL/min為分界線,當流速小于1 mL/min時,鮑曼氏囊平均面積為2 000 μm2;當流速超過1 mL/min后,腎脫細胞支架的鮑曼氏囊面積明顯增加(圖2C)。PAS染色中可見低流速各組(S0.1、S0.5、S1)中腎皮質和髓質中腎小球飽滿,基底膜完整,鮑曼氏囊完整,可見明顯的血管極和尿極。高流速組(S5、S10、S20)中發現有結構萎縮的腎小球,球內有紫色細胞核成分殘留。S20組中可觀察到鮑曼氏囊有破碎和不完整(圖3)。提示制備脫細胞支架的最佳流速應為低流速,為了保證支架微結構的完整性,我們在后續的試驗中采取了 0.5 mL/min流速。
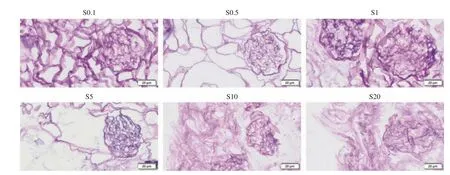
圖3 光鏡下不同流速制備的脫細胞支架的鮑曼氏囊PAS染色(200 ×)F ig.3 PAS staining of Bowman's capsule of decellularized scaffolds prepared at different flow rates under light microscope (200 ×)
4 病理染色及電鏡 病理染色可見,0.5 mL/min流速下的HE染色無細胞成分,PAS染色可見鮑曼氏囊結構完整,基底膜連續且清晰,腎小管分布均一。通過Masson染色和Ⅳ型膠原免疫組化染色可見各組脫細胞支架均有膠原纖維網狀結構保留(圖4A)。電鏡可見鮑曼氏囊和基底膜連續且完整 ,且未觀察到有細胞成分的殘留(圖4B)。
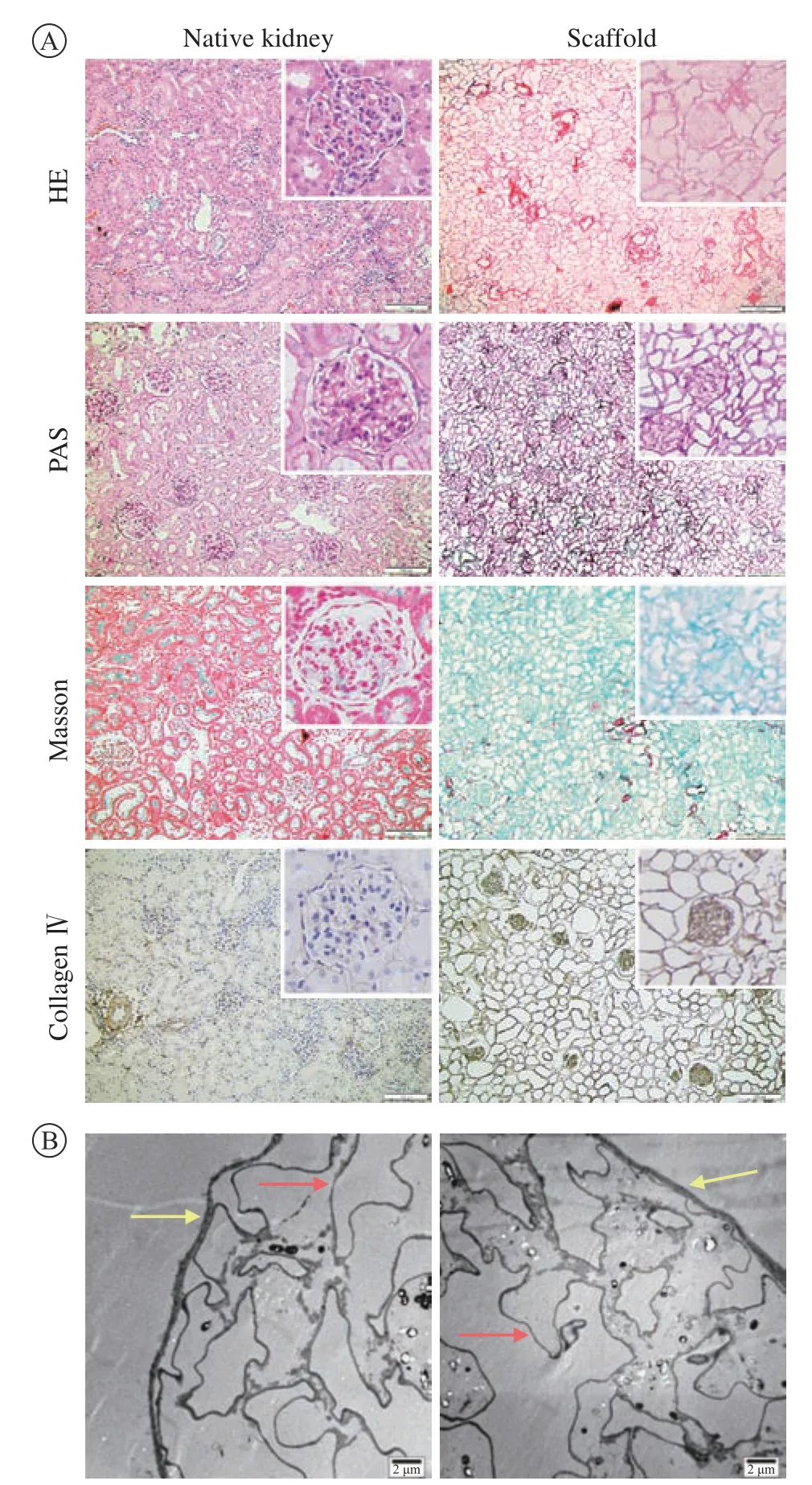
圖4 0.5 mL/min流速下制備的脫細胞支架光鏡和電鏡下形態A:光鏡下脫細胞支架的常規病理染色和Ⅳ型膠原蛋白染色顯示0.5 mL/min流速下的脫細胞支架無細胞核成分,細胞外基質結構完整,有膠原蛋白的保留(標尺=100 μm,200 ×);B:腎脫細胞支架的透射電鏡,鮑曼氏囊(黃色箭頭)和基底膜(紅色箭頭)連續且完整(標尺=2 μm)Fig.4 Light and electron microscopy results of the decellularized scaffold prepared at a flow rate of 0.5 mL/min A: The conventional pathological staining of the decellularized scaffold and Ⅳ collagen staining under light microscope showed that the decellularized scaffold at a flow rate of 0.5 mL/min had no nuclear components, the extracellular matrix structure was intact, and collagen was retained (scale bar=100 μm, 200 ×); B: the transmission of the kidney decellularized scaffold electron microscope showed that the Bowman's capsule (yellow arrow) and basement membrane (red arrow) were continuous and intact (scale bar=2 μm)
5 超聲及超聲造影表現 脫細胞支架內血管和腎盂呈高回聲影,腎實質部分呈低回聲影,脫細胞支架結構完整(圖5A)。腎脫細胞支架超聲微泡造影檢查可見整個腎均勻迅速強化,從皮質區域開始強化,逐漸擴大到腎髓質,腎皮質強化明顯,血 管網絡通暢,腎表面無造影劑泄露(圖5B)。
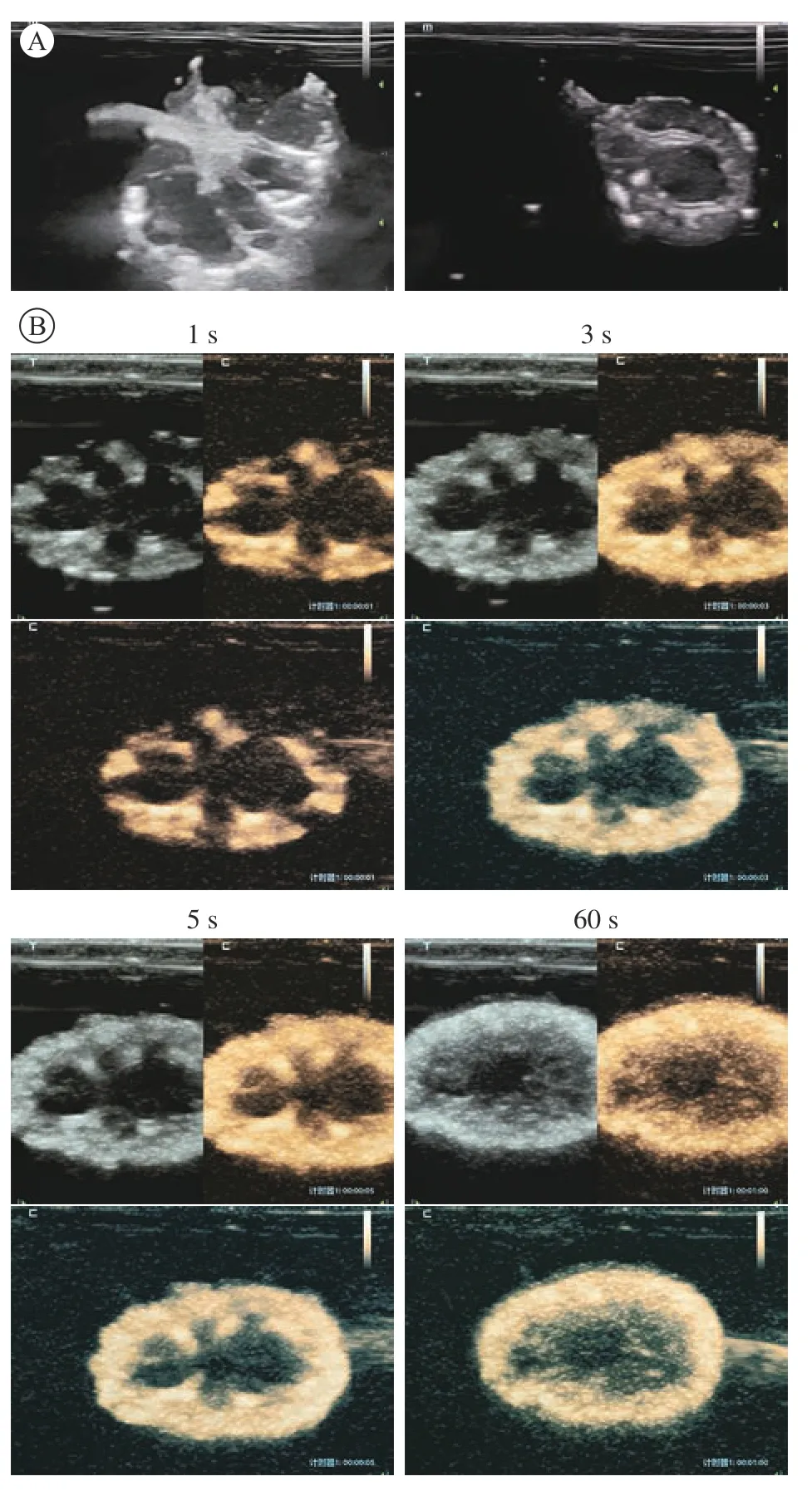
圖5 0.5 mL/min流速下制備的腎脫細胞支架超聲及造影表現A:脫細胞支架超聲檢查顯示血管和腎盂呈高回聲影,腎實質部分呈低回聲影,脫細胞支架結構完整;B脫細胞支架超聲微泡造影顯示整個腎均勻迅速強化,腎表面無造影劑泄露Fig.5 Ultrasound and contrast-enhanced ultrasound examination of kidney decellularized scaffold A: Ultrasound examination of the decellularized scaffold showed that the blood vessels and renal pelvis were hyperechoic, the parenchymal part of the kidney was hypoechoic,and the structure of the decellularized scaffold were integrity; B: Decellularized scaffold ultrasound microbubble contrast showed that the entire kidney was rapidly strengthened, and no contrast agent was leaked from the kidney surface
6 DNA及SDS殘留量 經過測量,對照組天然腎DNA含量為(1 624 ± 315.91) ng/mg干重,0.5 mL/min脫細胞組DNA含量為(35.2 ± 12.13) ng/mg干重(圖6A)。瓊脂糖電泳顯示S0.5脫細胞組未見明顯長核酸鏈(>100 bp)的殘留(圖6B)。脫細胞支架純 水沖洗12 h后,SDS殘留低至本底水平(圖6C)。
7 安全性 相比對照組,腎脫細胞支架的含血清培養基浸提液對細胞增殖無顯著影響(圖6D)。表明我們制備的脫細胞支架本身無細胞毒性,制得的腎脫細胞支架符合現行的醫療器械生物學評價標 準[11]。
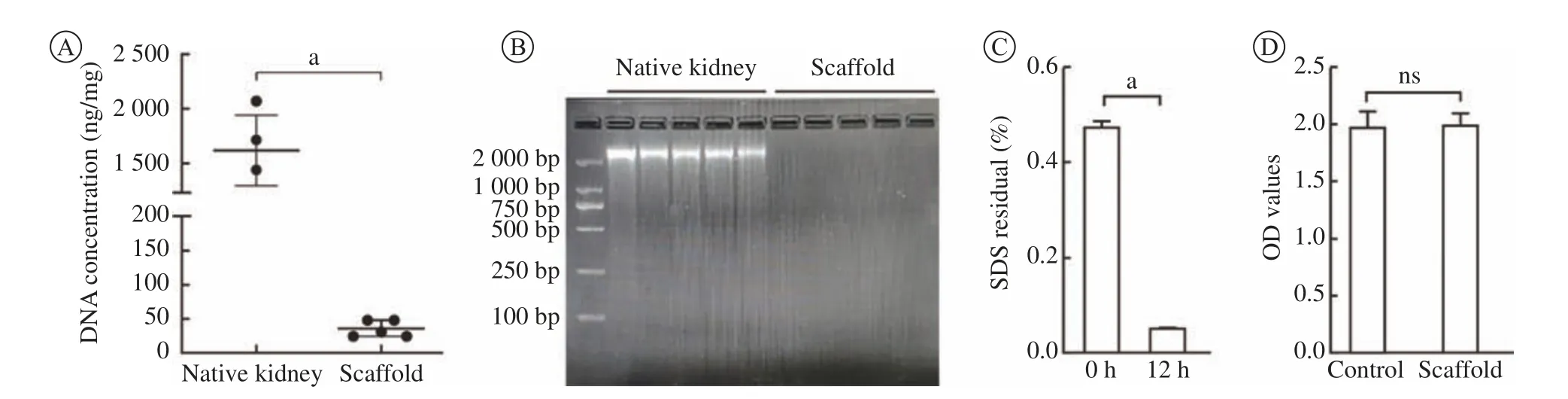
圖6 腎脫細胞支架DNA和SDS殘留檢測和安全性檢測A:脫細胞支架與天然腎相比,脫細胞支架核酸殘留低于50 ng/mg干重;B:瓊脂糖電泳未見脫細胞支架組大于100 bp DNA條帶;C:SDS溶液脫細胞后沖洗12 h,SDS殘留低至本底水平;D:脫細胞支架浸提液的細胞毒性驗證顯示與對照組無差異。aP<0.000 1Fig.6 Renal decellularized scaffold residue detection and safety detectionA:Compared with native kidney, the residual nucleic acid of the decellularized scaffold is less than 50 ng/mg dry weight; B: Agarose electrophoresis showed that there was no DNA band larger than 100 bp in the scaffold group (Scaffold); C: SDS solution was decellularized and rinsed for 12 hours, the residue was as low as the background level; D: The cytotoxicity verification of the decellularized scaffold extract showed no difference when compared with the control group. aP<0.000 1
討 論
脫細胞支架是生物組織和器官在經過表面活性劑和酶的作用下去除細胞成分,同時又不影響細胞外基質的情況下獲得的生物支架,隨后通過不同的接種策略使無細胞的支架得以再細胞化,以重現組織或器官功能[12]。與人工支架相比,腎脫細胞支架的優勢包括:1)脫細胞支架具有獨特且精細的三維結構,難以人工實現;2)脫細胞支架中包含可促進細胞生長和黏附的蛋白和生長因子;3)包含天然的動靜脈和輸尿管結構,可用于細胞植入和血液灌流[13]。
既往眾多文獻中研究者們將離體器官和組織快速冰凍后解凍,這樣可以在細胞內形成冰晶破壞細胞膜,在灌注過程中可以有效地將細胞碎片沖出腎內部,且快速冰凍形成的小冰晶不會影響后續的支架再細胞化過程[14-15]。但我們實踐發現,反復凍融并不會有效提高脫細胞效率,因此我們僅將離體腎快速冰凍24 h以保證能將腎完全冰凍。
目前灌注洗脫劑制備脫細胞支架的流速還未達成共識,我們查閱文獻發現常用的灌注流速為1 mL/min以下。因此我們主要觀察的實驗流速設定為0.1 mL/min、0.5 mL/min、1 mL/min,并同時設置了5 mL/min、10 mL/min、20 mL/min作為對比。我們通過以上不同流速對腎進行洗脫細胞,發現隨著灌注流速的增加,脫細胞時間減少,但較高的灌注速度會造成鮑曼氏囊面積增大,以至于破裂,導致腎小球的細胞無法洗脫干凈。表明脫細胞過程中在一定范圍內提高灌注流速可以有效減少脫細胞時間。我們在本研究中采用的是與傳統懸吊法脫細胞不同的脫細胞方案,即將整個腎浸泡在液體中進行脫細胞。我們發現,相較傳統懸吊法,在0.5 mL/min的流速下液體環境中脫細胞時間明顯縮短。可能原因是液體環境中的腎由于浮力的存在,可以給腎組織一個良好的支撐,使血管處于充盈狀態,洗脫試劑可以更好地灌注到腎內部。
腎脫細胞支架的完整性關系到再細胞化效率[15-16]。為了更好地觀察到脫細胞后支架內部的結構情況,我們使用了超聲檢查和超聲造影檢查評估腎脫細胞支架的結構和血管網絡。灰階檢查結果顯示支架外形結構完整,造影檢查可見整個腎在1 s內迅速強化,血管網絡通暢。由于超聲微泡無細胞毒性,殘留的微泡可在后續灌注培養中離開支架內部[17]。所以我們認為超聲微泡造影可以作為腎脫細胞支架使用前的無創預先檢查手段,有效避免在后續實驗中發現血管網絡不通暢和灌注細胞時的泄露問題。我們認為可以用于腎再生技術的合格脫細胞支架應至少符合以下條件:1)在進行脫細胞程序前對目的腎進行灰階及彩色多普勒超聲檢查,確認腎形態、結構無異常,血流通暢,排除占位性病變;2)超聲檢查可見脫細胞支架完整,可見結構完整的高回聲血管網絡;3)超聲微泡造影檢查支架迅速強化,血管網絡通暢;4)超聲造影檢查支架表面無造影劑滲漏。
由于移植后不良反應的主要原因是支架內殘留的DNA,因此支架內DNA殘留是極為關鍵的因素[16]。本研究中制備的脫細胞支架符合脫細胞指標要求。同時,SDS對細胞具有一定的毒性,在用純水灌洗脫細胞支架12 h后,支架內的SDS平均殘留量低于安全水平(133 μg/g)[18]。最后我們對脫細胞支架浸體液和對照進行細胞培養后測試毒性,兩組間無顯著差異。因此我們制備的腎脫細胞支架安全、無細胞毒性,可以用于后續的再細胞化培養。
雖然已經有膀胱和真皮等組織器官的脫細胞支架用于臨床使用階段,但由于腎脫細胞方法的不確定性以及腎脫細胞支架結構的復雜性,腎脫細胞支架的臨床應用還有很大的挑戰[19-21]。目前尚未見腎脫細胞支架應用于人體的報道,但已經有很多團隊將腎脫細胞支架應用于動物模型。在腎脫細胞支架的臨床應用之前依然有較多問題亟待解決,包括保留更多天然腎生物學特征的脫細胞方法、對腎脫細胞支架進行化學物理修飾以產生足夠的生物學活性、適當地將細胞重新種植于脫細胞支架特定區域的細胞接種方案等。相信隨著技術的進步和實驗方案的優化,會有力地促進生物人工腎的研制。
綜上,本研究通過不同流速灌注腎制備脫細胞支架,發現液體環境下0.5 mL/min是制備大鼠腎脫細胞支架的最佳流速,并提出了將超聲檢查和超聲微泡造影檢查作為脫細胞支架使用前的預先檢查手段,有助于脫細胞支架的后續應用。

