GDS-80手持基因槍在橡膠樹遺傳轉化上應用的參數優化與配件改進
范璟璋 華玉偉 范月婷 辛士超 戴雪梅 黃天帶 黃華孫 李季

摘? 要:GDS-80手持基因槍是美國Wealtec公司2009年推出的基因傳遞系統,具有操作簡便、高效的特點。已報道的橡膠樹基因槍轉化研究都是使用臺式基因槍。本文首先利用考馬斯亮藍轟擊濾紙去除明顯不適合的參數,接著以綠色熒光蛋白(GFP)基因作為報告基因,轟擊巴西橡膠樹體細胞胚以及愈傷組織,用熒光顯微鏡觀察綠色熒光,探究適合橡膠樹的轟擊參數。而且比較了Image J軟件和肉眼統計熒光斑點數及GDS-80手持基因槍與PDS-1000/He臺式基因槍的差異。結果表明:對于橡膠樹體細胞胚和愈傷組織,僅依靠原廠配件難以獲得較好的轉化效果。本文設計了直徑3 cm(與轟擊范圍相同),高度2.5 cm,孔徑60目的過濾網。同時改進裝試驗材料的培養皿,用刀片在培養皿的中心割出一個直徑3 cm的圓圈,轟擊胚狀體時,將上述設計的過濾篩網正向卡在圓圈上,胚狀體放入過濾網中,轟擊時將培養皿用試管架架高,壓力就從篩網及底部的空洞分解,微彈完全轟擊到試驗材料。轟擊胚狀體最優參數為:轟擊壓力為60 psi,針狀調節閥為3圈,目標間隔盤為6 cm。轟擊愈傷時將材料放到普通培養皿中心的轟擊范圍內,反向蓋上過濾篩網。最優轟擊參數為:轟擊壓力為50 psi,針狀調節閥為4圈,目標間隔盤為6 cm。本文采用Image J軟件進行熒光斑點計數,準確率與肉眼相當,但較肉眼省時。GDS-80手持基因槍與PDS-1000/He臺式基因槍轉化效率相當,但GDS-80手持基因槍每打一槍比PDS-1000/He臺式基因槍快12 min。研究結果為橡膠樹遺傳轉化提供了高效的基因槍轉化體系,為轉基因研究提供了一個高效的統計熒光數的軟件。
關鍵詞:巴西橡膠樹;GDS-80;基因槍;GFP基因;Image J
中圖分類號:S794.1????? 文獻標識碼:A
Parameter Optimization and Accessory Improvement of GDS-80 Handheld Gene Gun for Rubber Tree Genetic Transformation
FAN Jingzhang1, HUA Yuwei2, FAN Yueting3, XIN Shichao2, DAI Xuemei2, HUANG Tiandai2*,
HUANG Huasun2*, LI Ji2
1. College of Tropical Crops, Hainan University, Haikou, Hainan 570228, China; 2. Rubber Research Institute, Chinese Academy of Tropical Agricultural Sciences / Key Laboratory of Biology and Genetic Resources of Rubber Tree, Ministry of Agriculture & Rural Affairs, Haikou, Hainan 571101, China; 3. Xixian Senior Middle School Affiliated to Central China Normal University, Xixian, Henan 464300, China
Abstract: GDS-80 handheld gene gun is a gene delivery system launched by Wealtec Company in 2009, which is easy to operate and efficient. All the published researches on the transformation of Hevea brasiliensis by gene gun are based on desktop gene gun. In this paper, Coomassie Brilliant Blue was firstly used to bombard filter paper to screen out obviously not suitable parameters, and then the green fluorescent protein (GFP) gene was used as the reporter gene to bombard the somatic embryos and callus of H. brasiliensis, finally the green fluorescence was observed by fluorescence microscope to explore the suitable bombardment parameters for H. brasiliensis. The difference in fluorescent spot numbers calculated by Image J software and naked-eye and the difference between GDS-80 handheld gene gun and PDS-1000/He desktop gene gun was compared. The results showed that it was difficult to obtain good transformation efficiency by using original accessories for somatic embryos and callus of H. brasiliensis. In this paper, a filter screen with a diameter of 3cm (same as the bombardment range), the height of 2.5 cm and pore diameter of 60 mesh was designed. At the same time, a petri dish containing the experimental materials was improved. A circle with a diameter of 3cm was cut out in the center of the petri dish by a blade. The filter screen designed above was clamped on the circle with forwarding direction, and the embryos were put into the filter screen. When bombarding, the petri dish was put on the test tube rack, and the pressure would decompose from the mesh and the cavity at the bottom, and the micro bullet would completely bombard the embryos. The optimal parameters for embryos were as follows: bombardment pressure 60 psi, needle-shaped regulating valve 3 circles, and target spacing plate 6 cm. When the callus was bombarded, the material was placed in the center of a traditional petri dish and covered by the designed filter screen reversely. The optimal bombardment parameters for callus were as follows: bombardment pressure 50 psi, needle-shaped regulating valve 4 circles, and target spacing disc 6 cm. In this paper, Image J software was used to count fluorescent spots. The accuracy was equivalent to that counted by naked eyes, but it saved time. The transformation efficiency of the GDS-80 handheld gene gun was similar to that of the PDS-1000 / He desktop gene gun, but the GDS-80 handheld gene gun was 12 minutes faster than PDS-1000 / He desktop gene gun for one shot. The research results would provide an efficient gene gun transformation system for H. brasiliensis genetic transformation and a efficient software to count fluorescent spots.
Keywords: Hevea brasiliensis; GDS-80; gene gun; GFP gene; Image J
DOI: 10.3969/j.issn.1000-2561.2021.09.004
橡膠樹學名Hevea brasiliensis,又名巴西橡膠樹、三葉橡膠樹,隸屬大戟科(Euphorbiaceae)橡膠樹屬(Hevea Aubl.),是天然橡膠的主要來源,原產于南美亞馬遜河流域,是一種重要的戰略物資,與鋼鐵、煤炭、石油并列為我國的四大工業原料。橡膠樹具有遺傳背景狹窄、高度雜合化、育種周期長等特點,使得巴西橡膠樹育種進展非常緩慢[1],而采用轉基因技術將外源基因導入到橡膠樹組織中,能有效提高育種效率,縮短育種周期。對巴西橡膠樹的轉基因研究已有報道[2],大部分為農桿菌介導的轉化。Arokiaraj等[3]首次通過根癌農桿菌介導法轉化橡膠樹花藥脫分化愈傷組織,獲得3棵轉化新霉素磷酸轉移酶基因(nptⅡ)和β-葡萄糖苷酸酶基因(gus)的轉基因植株。Jayashree等[4]以花藥脫分化愈傷組織為受體,用農桿菌介導法將gus基因和sod基因成功轉入橡膠樹中,在轉基因后代中能穩定表達。隨后,Arokiaraj等[5]和Jayashree等[4]分別將人血清白蛋白基因(HSA)和橡膠樹超氧歧化酶基因(HbSOD)導入橡膠樹,分別獲得16棵和3棵轉基因植株。Blanc等[6-7]建立了比較有效的根癌農桿菌介導的橡膠樹遺傳轉化體系,獲得了374棵轉基因植株,同時,成功將銅鋅超氧歧化酶基因(CuZnSOD)導入橡膠樹,Leclercq等[7]在2012年發表了第1篇有關轉基因橡膠樹植株表型和所轉基因的功能進行系統研究的文章。黃天帶等[8]于2010年在我國率先建立了以花藥脫分化愈傷組織為受體的農桿菌介導的橡膠樹遺傳轉化體系,獲得10個轉基因株系。2015年以胚狀體為農桿菌侵染受體,獲得轉基因植株[9]。Lestari等[10]在橡膠樹中過表達1個擬南芥ERF1(ethylene response factor 1)的橡膠樹同源基因Hb ERF- IXc5,這與以往報道ERF1過表達植株矮化嚴重的現象明顯不同,表明Hb ERF-IXc5的功能可能有別于經典的植物ERF1。Jayashree等[11]在橡膠樹中過表達IPP甲羥戊酸合成途徑的關鍵酶HMGR基因(hmgr1),所有轉基因植株的莖圍和膠乳產量均高于對照植株,膠乳產量最高可達對照的5倍,表明通過轉基因手段培養高產甚至超高產橡膠樹的前景誘人。最近,中國熱帶農業科學研究院橡膠研究所的科研人員[12]將體外組合的Cas9/sg RNA核蛋白導入橡膠樹原生質體中,實現了對橡膠樹靶標基因FT和TFL1的有效編輯,有望將無外源DNA導入的基因編輯技術應用到橡膠樹遺傳改良中。
基因槍法,又稱為生物彈法、微粒轟擊法,是通過高速的金屬顆粒將外源基因導入細胞中的一種轉化技術。它是繼農桿菌介導轉化法之后又一種應用最廣泛的遺傳轉化技術[13]。基因槍轉化不受受體對農桿菌敏感性、外植體類型、基因型限制,篩選過程不需要抑菌。尤其是研究瞬時表達比農桿菌更有優勢。Arokiaraj等[14]首次使用基因槍法轉化橡膠樹花藥脫分化愈傷組織,獲得第1株轉基因橡膠樹。王穎等[15]用基因槍轟擊橡膠樹花藥脫分化愈傷組織,將GAI矮化基因導入巴西橡膠樹,獲得PCR陽性胚狀體。以上2個研究均使用臺式基因槍。GDS-80低壓基因傳遞系統(也稱手持基因槍),是美國Wealtec公司在2009年推出的基因傳遞工具,由低壓氦氣或氮氣驅動,氣流被壓縮入主機。當扣動扳機時,氣流會被加速到一個極高的速度攜帶生物粒子進入到靶細胞,從而完成外源基因的導入過程。相比于臺式基因槍,GDS-80手持基因槍具有以下特點:(1)低壓(10-80 psi)可執行,對細胞損害極小;(2)氦氣或氮氣均可完成;(3)低噪音,不用戴耳罩;(4)可高壓滅菌;(5)步驟簡單,省時省力,省去涂微彈和干燥2個步驟;(6)節約耗材,不需要可裂膜和載體膜;(7)體積小,省
空間。本研究首先利用考馬斯亮藍初步確定GDS-80手持基因槍的基本參數,再用包裹金粉的質粒微彈轟擊橡膠樹胚狀體及愈傷組織,研究最重要的參數對轉化效率的影響,然后比較Image J軟件和肉眼統計熒光斑點數及GDS-80手持基因槍與PDS-1000/He臺式基因槍的差異。本研究建立的GDS-80手持基因槍轟擊橡膠樹體系,為橡膠樹基因功能驗證、轉基因改良提供新的高效技術。
1? 材料與方法
1.1? 材料
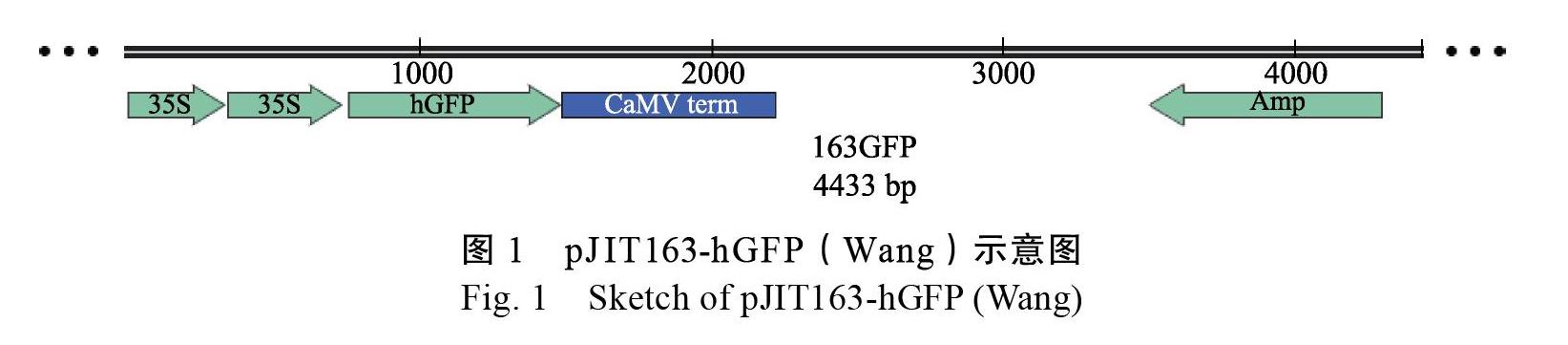
巴西橡膠樹‘熱研7-33-97次生胚狀體及‘熱墾525愈傷組織由本實驗室培養獲得。GDS-80手持基因槍,購自美國Wealtec公司,0.6 ?m直徑金粉。轉化載體pJIT163-hGFP(Wang)由中國農業科學院水稻研究所王克劍團隊饋贈[16],載體見圖1。
1.2? 方法
1.2.1? 考馬斯亮藍初篩? 稱量0.05 g考馬斯亮藍固體,溶解于50 mL 100%乙醇中。豎直方向向槍管中注入考馬斯亮藍溶液到樣本孔中。4.5 mm槍管連接GDS-80槍口到目標間隔盤上,設置氦氣壓力為1550 psi,氣流速度10~15 L/min。在濾紙上3個不同的位置扣動扳機3次,然后更換濾紙。考慮到金粉及質粒制成的微彈價格昂貴,且微彈制備耗時耗力,而考馬斯亮藍經濟實惠,制備簡單,因此通過考馬斯亮藍先過濾明顯不適合的參數,再用微彈進一步優化轉化參數。測試轟擊距離、轟擊壓力、針狀調節閥、上樣量等關鍵參數對轟擊效果的影響。
1.2.2? ‘熱墾525愈傷組織的誘導? 采集‘熱墾525花序,取出雄蕊,在愈傷誘導培養基誘導初級愈傷組織,然后轉入體胚誘導培養基,誘導易碎胚性愈傷組織并維持。愈傷誘導培養基參考Hua等[17]的文獻,體胚誘導和易碎胚性愈傷組織維持培養基參考戴雪梅等[18]的M2培養基。
1.2.3? ‘熱研7-33-97胚狀體的誘導? 采集‘熱研7-33-97花序,取出雄蕊,在愈傷誘導培養基誘導愈傷組織,然后轉入體胚誘導培養基,誘導初生胚,接著進入次生胚循環增殖階段,將胚狀體切成3 mm × 3 mm的胚塊,誘導次生胚。具體參考Hua等[17]的方法。
1.2.4? 轟擊設備的改進? 轟擊胚狀體時,在60 psi壓力下,按照說明書直接轟擊,由于轟擊壓力過大以及氣流動力很足使得胚狀體被打成碎片并分散到培養皿及間隔盤,而以愈傷為轟擊對象,在50 psi的壓力下,愈傷就四處飛濺。這種情況,可看到部分微彈轟擊到培養皿而不是試驗材料,浪費微彈、降低轉化效率的同時增加了污染風險。針對此現象,設計了直徑3 cm(與轟擊范圍相同),高度2.5 cm,孔徑60目的過濾網(圖2A,圖2B),轟擊愈傷時將愈傷置于常規培養皿轟擊范圍,篩網面朝上遮蓋試驗材料,防止材料被吹散(圖2C,圖2D)可取得較好效果。但在轟擊胚狀體過程中發現,因為壓力集中在過濾網范圍,材料分散的現象雖然仍存在,但較無篩網遮蓋有明顯降低。因此進一步改進裝試驗材料的培養皿,用刀片將培養皿中間3 cm轟擊范圍割開,漏出3 cm空洞(圖2E),轟擊時將上述設計的過濾網卡在3 cm空洞處,試驗材料裝于過濾篩網,轟擊時將培養皿架高(圖2F),壓力就會從篩網及底部的空洞分散,微彈可以與試驗材料充分接觸,提高轉化效率。
1.2.5? 橡膠樹組織手持基因槍轉化體系建立? 根據以上GDS-80手持基因槍轟擊濾紙的試驗,以pJIT163-hGFP質粒作樣本,轟擊橡膠樹‘熱墾525愈傷和‘熱研7-33-97次生胚,微彈的制備方法參照GDS-80說明書。將3 ?L質粒DNA包裹于6 mg金粉表面,重新懸浮到48 ?L 100%乙醇中。愈傷轟擊后轉入M2培養基[18],胚狀體轟擊后轉入體胚誘導培養基[17]。20 h后在Leica(Leica/M205FA)熒光體視顯微鏡下觀察,統計綠色熒光斑點數。以胚狀體為轟擊對象,轟擊距離6 cm、不遮蓋,各壓力推薦圈數時,設置30、40、50、60、70 psi 5種不同轟擊壓力,固定轟擊壓力后,測試轟擊距離,過濾篩網遮蓋(圖2D,處理時簡稱遮蓋)與不遮蓋(圖2C,簡稱不遮蓋)及培養皿底部漏氣對轉化效率的影響(圖2F,簡稱底部漏氣)。以愈傷組織為轟擊對象,轟擊壓力為50 psi,針狀調節閥推薦圈數,過濾篩網遮蓋(圖2D)時,比較轟擊距離對轉化效率的影響。每個處理打3槍。
1.3? 數據處理
采用Image J、Excel 2003軟件處理試驗數據,采用DPS軟件作統計分析。
2? 結果與分析
2.1? 考馬斯亮藍溶液轟擊濾紙
2.1.1? 轟擊距離對轟擊效果的影響? 在轟擊壓力固定為50 psi、針狀調節閥使用推薦圈數4圈及樣本體積固定為10 ?L時,使用3、6、9 cm的轟擊距離,探究最適轟擊距離。結果表明,當轟擊距離為3 cm(圖3A)和6 cm(圖3B)時,考馬斯亮藍溶液的轟擊范圍適中,均勻度好,顏色較清晰;當轟擊距離為9 cm時,槍口離樣本太遠,氣流動力不足,使考馬斯亮藍溶液打到濾紙上后較分散,轟擊范圍很大,雖然均勻度好但顏色不清晰,表明轟擊力度不足(圖3C)。所以后續試驗以3 cm和6 cm作為候選轟擊距離。
2.1.2? 轟擊壓力對轟擊效果的影響? 固定轟擊距離為6 cm,上樣體積為10 ?L時,改變轟擊壓力,使用相應的針狀調節閥推薦圈數,篩選適宜的轟擊壓力。結果表明,當轟擊壓力為20、30 psi時,轟擊范圍小,且均一度差;當轟擊壓力為40、50、60 psi時,轟擊范圍大,均勻度較好(圖4)。因此,上述條件下,轟擊壓力≥40 psi時轟擊效果較好,本試驗淘汰20 psi,后續試驗以50 psi進行優化。
2.1.3? 針狀調節閥圈數對轟擊效果的影響? 以轟擊壓力50 psi為例,上樣體積為10 ?L,轟擊距離為6 cm時,比較針狀調節閥不同圈數(不超過推薦圈數范圍)對轟擊效果的影響,確定最適圈數。結果表明:1圈時,氣流動力很小,導致考馬斯亮藍聚集,所以深色顆粒多,均勻度差,被轟擊范圍最小(圖5A);當圈數逐漸增加到2、3、4圈時(圖5B,圖5C,圖5D),氣流動力逐漸增加,打到濾紙上的范圍逐漸增加,分散性越來越好,在不超過推薦圈數的范圍時,均勻度與分布均勻校正參考結果相近,最適圈數為4圈(圖5D)。因此,使用不同轟擊壓力時針狀調節閥采用推薦圈數即可獲得理想的試驗結果。
2.1.4? 上樣體積對轟擊效果的影響? 上樣體積是轟擊參數的關鍵因素,同樣轟擊效果采用較低上樣體積有助于降低試驗成本。固定轟擊壓力為50 psi,針狀調節閥為4圈以及目標間隔盤距離為6 cm時,研究樣本體積對轟擊效果的影響。結果表明,隨著樣本體積的增加,濾紙轟擊范圍越來越大,均勻度也越來越好,顏色也從模糊到清晰。5 ?L上樣量轟擊范圍小,顏色淺,表明此上樣量作為微彈上樣量轟擊范圍太小,力度也不足(圖6A);10 ?L上樣量轟擊范圍在可接受范圍,均勻度好,顏色為清晰的淡藍色,表明力度較理想(圖6B);15、20 ?L雖然轟擊范圍比10 ?L大,但顏色也明顯比10 ?L深,所以以此作為微彈上樣量會造成轟擊力度過大(圖6C,圖6D)。因此最適上樣量為10 ?L。
2.2? 基因槍轟擊橡膠樹次生胚及愈傷組織
2.2.1? 轟擊壓力對體胚轉化效率的影響? 轟擊壓力是影響轉化效率最重要的因素。根據考馬斯亮藍試驗結果,使用官方配件,選擇6 cm目標間隔盤和針狀調節閥推薦圈數,研究不同轟擊壓力對GDS-80手持基因槍將質粒打入橡膠樹胚狀體效率的影響。當轟擊壓力為30 psi時,由于轟擊壓力過小,胚狀體完整性好,微彈幾乎無法到達胚狀體;隨著轟擊壓力的增強,轟擊后在顯微鏡下觀察的GFP熒光數隨之增加,60 psi效果最好。但轟擊壓力過高時(70 psi),GFP熒光數略有減少。當轟擊壓力為30~50 psi時,產生的氣流動力較小,氣流速度較低,橡膠樹胚狀體完整性較好,質粒只有部分能進入胚狀體中,所以只有少部分熒光數;當轟擊壓力增加至60 psi時,產生較大的氣流動力,導致橡膠樹胚狀體破碎,使得質粒與胚狀體有更多的接觸面積及可能性,所以在顯微鏡下觀察的熒光數隨之增加;而當轟擊壓力增加到70 psi時,氣流動力足夠大,橡膠樹胚狀體更加破碎,胚塊四處飛濺,太小的胚塊不能做后續試驗,且壓力太大導致破碎太快,質粒與胚狀體接觸變少,所以在顯微鏡下觀察的數目減少(表1)。
2.2.2? 轟擊距離、改進轟擊設備、受體對轉化效率的影響? 對于次生胚來說,當轟擊壓力為60 psi,針狀調節閥使用推薦圈數3圈,上樣體積10 ?L時,3 cm目標間隔盤的熒光數比6 cm目標間隔盤多,達顯著水平(表2),但胚狀體會被打成較小碎片,不利于后續體胚發生,因此6 cm更適合作為胚狀體轉化的轟擊距離。
使用過濾篩網遮蓋胚狀體,無論轟擊距離為3 cm或6 cm,篩網遮蓋處理的綠色熒光斑點數都顯著高于無篩網遮蓋(表2,圖7)。主要是由于無篩網遮蓋時胚狀體在高速氣壓的作用下吹散到培養皿和間隔盤后散落在培養皿,造成微彈的浪費,而篩網遮蓋胚狀體后,胚狀體吹散的范圍局限在篩網內,微彈浪費情況明顯改善。底部漏氣時,熒光數目在所有處理中最多,效果最好,且胚狀體打碎的碎片大部分都大于2 mm×2 mm(表2,圖7)。
因此,把過濾篩網裝在培養皿轟擊范圍鏤空處,然后裝載胚狀體到過濾篩網,扣上6 cm目標間隔盤,用60 psi的轟擊壓力,針狀調節閥使用推薦圈數,10 ?L轟擊體積可獲得理想的轉化效率。然而對于易碎胚性愈傷來說,由于愈傷顆粒很小,預試驗表明50 psi轟擊壓力無過濾篩網遮蓋時愈傷飛濺到培養皿、目標間隔盤、基因槍,以及目標間隔盤外的工作臺,造成對愈傷細胞的損害、污染風險大大增加、受體不完整、收集散落四處的愈傷組織費時費力。對于胚狀體最好的底部漏氣處理則不適合易碎胚性愈傷組織,由于愈傷組織顆粒太小,在壓力作用下,愈傷從篩孔處透過培養皿鏤空處泄露到外面。而50 psi、過濾篩網遮蓋可獲得較理想的試驗結果,愈傷組織僅在篩網內部散落,較易收集,且通過更換高壓滅菌的篩網可控制污染。在50 psi壓力下,6 cm目標間隔距離的轉化效率顯著高于3 cm。主要原因是同樣壓力下短距離瞬時壓力高于長距離,造成材料被迅速吹散。而6 cm轟擊距離轉化效率雖然比體胚底部漏氣效果稍差,但是也能獲得較好的轉化效率(表2,圖7)。
2.2.3? Image J軟件統計綠色熒光斑點數準確率
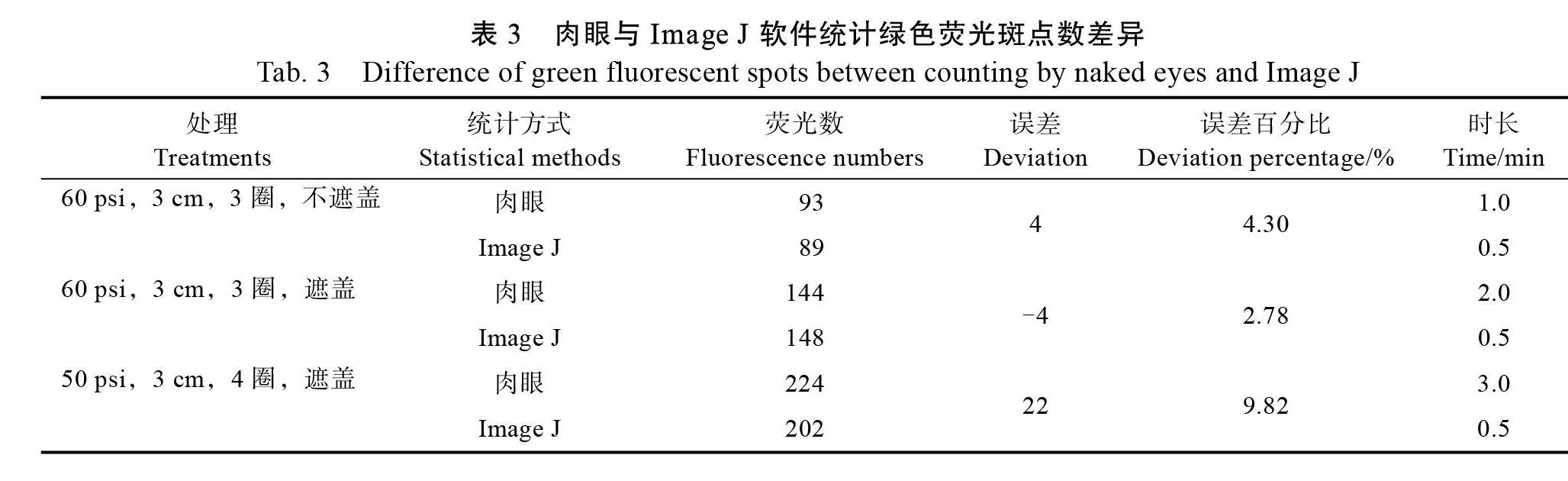
建立植物遺傳轉化體系時,需要使用GFP等報告基因以便計算轉化效率,而影響轉化效率的因素很多,因此,建立轉化體系的過程需要耗費大量時間和精力統計綠色熒光斑點。理想的圖形分析軟件有望把科研工作者從繁重的顯微觀察及計數中解放出來。Image J圖像分析軟件是美國國立衛生研究院(National Institutes of Health)開發的免費科學圖像分析工具,可計算陽性點密度和數量。準確率是衡量軟件最重要的標準。本研究通過肉眼統計的綠色熒光斑點數與Image J軟件統計的綠色熒光斑點數間的誤差為2.78%~ 9.82%,誤差在接受范圍,表明Image J軟件用于統計綠色熒光數結果可信。而肉眼統計93、144、224個綠色熒光斑點,用時分別為1、2、3 min,而Image J軟件用時均為0.5 min(表3),隨著綠色熒光斑點數的增加,人工花費的時間延長,而Image J軟件用時均為0.5 min,大大提高效率。因此,Image J軟件具有高效、準確的特點,可用于統計綠色熒光斑點數。其中圖8和表3是以圖7A、圖7B、圖7E為例來比較Image J軟件和人工統計數據所花費的時間以及準確性。
2.2.4? 手持基因槍GDS-80與臺式基因槍PDS- 1000/He轉化效率與工作效率比較? 臺式基因槍PDS-1000/He是近年來使用最廣的基因槍,廣泛應用于植物基因工程、動物基因工程、基因治療和基因免疫等[19]。通過比較PDS-1000/He和GDS-80的轉化效率和耗時差異,結果表明,二者的轉化效率無顯著差異。而臺式基因槍PDS-1000/ He與手持基因槍GDS-80從材料擺放到完成打槍所需時間,每打一槍,GDS-80比PDS-1000/He快12 min(表4)。GDS-80需要將選好的材料轉移到過濾篩網中,在篩網中盡量擺放緊密不能有太大孔隙,歷時大約55 s,然后吸取微彈加到上樣孔,迅速按下扳機開始轟擊植物組織,歷時5 s左右,由于氣流動力足夠大,材料會破碎,最后收集材料轉移到培養基所需時間60 s,所以每槍所需時間大約2 min;而臺式基因槍PDS-1000/He在選材料時直接擺放在培養皿中心,省去了轉移時間,接著需要將微彈均勻涂在微彈載體的內圈上,然后迅速蓋上培養皿蓋子,靜置10 min,讓其自由揮發,在此期間用無菌鑷子取出可裂膜并在70%異丙醇中輕蘸幾下進行滅菌,將濕潤的可裂膜放在可裂膜固定帽內,旋緊,將裝有微彈的載體支架及終止屏放入載體組件內,旋緊,最后將培養皿放在托盤上的中間圓圈內,關閉轟擊室門,按下抽真空建(Vac),當真空表讀數達到28 inches Hg時。調鍵置于“保持(Hold)”檔,按下射擊鍵(Fire),直到聽到“砰”一聲結束射擊,按下放氣(Vent)鍵,使真空表讀數歸零,完成打槍過程,取出材料即可,整個過程大概持續14 min。由此可以看出,相比GDS-80而言,PDS-1000/He不僅操作繁瑣,且用時更長,而二者的轉化效率相當,因此手持基因槍GDS-80在工作效率占顯著優勢。
3? 討論
基因槍的發展經歷了3代,第1代是1990年美國DuPont公司推出的PDS-1000臺式基因槍,解決了農桿菌不敏感的單子葉植物的轉化問題。但高壓氣體需要抽真空,壓縮機工作時噪音大,高氣壓使得臺式基因槍只能轉化細胞而不能轉化活體。且其體積大,不能靈活應用于田間地頭[20]。第2代是美國Bio-rad公司1996年推出的Helios手持式基因槍,摒棄了抽真空壓縮機,氣體壓力小(僅100~600 psi),體積小,方便攜帶,大大拓寬了基因槍的應用范圍,可以對活體動物的肌肉、皮膚直接進行轉化,但由于氣體壓力小,無法穿透成熟葉片的細胞壁,限制了其在植物中的應用[21]。第3代是美國Wealtec公司推出的GDS-80手持式基因槍,使用氦氣或氮氣于低壓狀態加速生物分子至極高的速度,完成基因傳送,解決了氣壓與粒子速度的矛盾。超低壓(10~
80 psi)推動,不僅沒有犧牲微粒子反而大大增加了微粒子的傳輸動量,因此能夠成功應用于僅在低壓狀態下才能完成的動物活體器官轉化,而且相比第2代手持式基因槍,GDS-80射出的攜基因微粒子因為其本身的高動量,能夠像臺式基因槍發射出的粒子一樣穿透植物細胞壁進入植物細胞完成轉化。GDS-80基因槍“子彈”的制備也從干式轉為濕式,節省了烘干的時間,簡化了流程。且可應用于核糖核蛋白(RNP)基因組編輯。由于不需要載體膜和可裂膜,降低了試驗成本。本研究使用GDS-80進行橡膠樹轉化,操作簡單,轉化效率與Bio-rad公司的臺式基因槍PDS-1000/ He相當。
GDS-80手持基因槍的配件包含GDS-80主機、4.5/10 mm直徑槍管、槍套、輸氣管、O型環、氣壓表調節閥與流量計、目標間隔盤、UTS-10通用目標間隔套件,對于橡膠樹再生能力最強的次生胚和易碎胚性愈傷組織,使用官方配件無法獲得理想的轉化效率和效果,僅使用目標間隔盤由于壓力太大,胚狀體很快被打成小碎片,愈傷僅少量接觸到微彈后就被吹散到培養皿和目標間隔盤內部及外部,后面的微彈打在培養皿上,影響后續體胚發生、浪費微彈、轉化效率低、污染率高;使用UTS-10通用目標間隔套件,胚狀體仍然被打得太碎,愈傷被打飛后局限在轟擊范圍,轉化效率較目標間隔盤好轉。但是UTS-10通用目標間隔套件只有1套,容易造成污染。因此亟需針對橡膠樹受體材料的特點,研制適合橡膠樹受體材料的配件。針對胚狀體,需要解決2個問題,一是材料被吹散后分散到較大范圍,二是壓力太大材料被打成小碎片;針對愈傷組織,需要解決第1個問題。本研究做了2個配件,一是設計了直徑3 cm(與轟擊范圍相同),高度2.5 cm,孔徑60目的過濾網;二是將裝材料的培養皿轟擊范圍鏤空。針對胚狀體,將過濾網底部卡到培養皿鏤空處,將胚狀體裝到過濾網,蓋上目標間隔盤進行轟擊,由于過濾網及培養皿中部均可漏氣,微彈轟擊到胚狀體后,多余的氣體從過濾網和培養皿排掉,胚狀體不至于太碎,也不會飛太遠;針對愈傷組織,只需將過濾篩網倒扣在轟擊材料上,蓋上目標間隔盤進行轟擊,由于過濾網可漏氣,可將壓力傳遞到愈傷組織,愈傷組織飛濺到過濾網同時也接受轟擊。過濾網可高溫高壓滅菌,可根據試驗需要定制所需數量,解決了污染問題。利用自主研制的配件,胚狀體轉化效率提高了近10倍,愈傷由幾乎無法轉化提高到每轟擊一次有635個綠色熒光斑點。
建立遺傳轉化體系時,需要通過報告基因以可視的方式直觀地表現轉化效率。而影響轉化效率的因素很多,每打一槍或農桿菌侵染一個外植體,需要統計成百上千的斑點,耗時耗力,且容易出錯。本文研究了圖形分析軟件Image J與肉眼統計的差異,發現Image J統計結果準確率在接受范圍內,但統計速度顯著快于肉眼。該軟件已廣泛應用于顯微圖像分析[22]。該軟件應用于轉化體系的建立,將把科研人員從繁重的顯微觀察和計數中解放出來,加快轉化體系的研發。
4? 結論
本文研究了影響GDS-80轟擊橡膠樹胚狀體和易碎愈傷組織的參數,GDS-80基因槍轟擊橡膠樹胚狀體最佳參數為使用自制的底部漏氣培養皿,套上定制的過濾網,過濾網底部朝上,裝載胚狀體,轟擊壓力為60 psi,針狀調節閥使用推薦圈數,目標間隔盤距離為6 cm,樣本體積為10 ?L,此條件下次生胚破碎效果也最好;轟擊易碎愈傷組織的參數為使用定制的過濾網遮蓋愈傷組織,轟擊壓力為50 psi,針狀調節閥使用推薦圈數,目標間隔盤距離為6 cm,樣本體積為10 ?L。Image J軟件可用于轉化體系優化時統計綠色熒光斑點。本研究用GDS-80手持式基因槍獲得了與臺式基因槍相當的瞬時轉化結果,既豐富了基因槍轟擊橡膠樹的方法,因操作方便也將加速橡膠樹基因功能驗證及轉基因育種研究。
參考文獻
[1]? 鄒? 智, 楊禮富, 王真輝, 等. 巴西橡膠樹轉基因研究現狀與展望[J]. 中國生物工程雜志, 2010, 30(1): 85-92.
[2]? 趙? 輝, 陳雄庭, 王? 旭, 等. 巴西橡膠樹遺傳轉化技術研究進展[J]. 熱帶作物學報, 2008(1): 121-125.
[3]? Arokiaraj P, Jones H, Hafsah J, et al. Agrobacterium mediated transformation of Hevea anther calli and their regeneration into plantlets[J]. Journal of Natural Rubber Research, 1996, 11 (2): 77-87.
[4]? Jayashree R, Pekha K, Venkatachalam P, et al. Genetic transformation and regeneration of rubber tree Hevea brasiliensis Muell.-Arg.) transgenic plants with a constitutive version of ananti-oxidative stress uperoxide dismutase gene[J]. Plant Cell Reports, 2003, 22: 201-209.
[5]? Arokiaraj P, Rüker F, Obermayr E, et al. Expression of human serum albumin in transgenic Hevea brasiliensis[J]. Journal of Rubber Research, 2002, 5(3): 157-166.
[6]? Blanc G, Baptiste C, Oliver G, et al. Efficient Agrobacterium tumefaciens-mediated transformation of embryogenic calli and regeneration of Hevea brasiliensis Mull Arg. plants[J]. Plant Cell Reports, 2006, 24 (12): 724-733.
[7]? Leclercq J, Martin F, Sanier C, et al. Over-expression of a cytosolic isoform of the HbCuZnSOD gene in Hevea brasiliensis changes its response to a water de?cit[J]. Plant Mol Biol, 2012, 80(3): 255-272.
[8] 黃天帶, 李? 哲, 孫愛花, 等. 根癌農桿菌介導的橡膠樹花藥愈傷組織遺傳轉化體系的建立[J]. 作物學報, 2010, 36(10): 1691-1697.
[9]? Huang T D, Li J, Li Y T, et al. Somatic embryo, an alternative target tissue for Agrobacterium-mediated transformation in Hevea brasiliensis[J]. Journa of Rubber Research, 2015, 18(3): 171-188.
[10]????? Lestari R, Rio M, Martin F, et al. Overexpression of Hevea brasiliensis ethylene response factor HbERF-IXc5 enhances growth and tolerance to abiotic stress and affects laticifer differentiation[J]. Plant Biotechnology Journal, 2018, 16(1): 322-336.
[11]????? Jayashree R, Nazeem P A, Rekha K, et al. Over-expression of 3-hydroxy-3-methylglutaryl-coenzyme A reductase 1 (hmgr1) gene under super-promoter for enhanced latex biosynthesis in rubber tree (Hevea brasiliensis Muell. Arg.)[J]. Plant Physiology and Biochemistry, 2018, 127: 414-424.
[12]????? Fan Y, Xin S, Dai X, et al. Efficient genome editing of rubber tree (Hevea brasiliensis) protoplasts using CRISPR/Cas9 ribonucleo proteins[J]. Industrial Crops and Products, 2020, 146: 112146.
[13]????? 徐淑平, 衛志明. 基因槍的使用方法介紹[J]. 植物生理學通訊, 1998, 34(1): 41-43.
[14]????? Arokiaraj P, Jones H, Cheong K F, et al. Gene insertion into Hevea brasiliensis[J]. Plant Cell Reports, 1994, 13(8): 425-431.
[15]????? 王? 穎, 陳雄庭, 張秀娟, 等. 基因槍法將GAI基因導入巴西橡膠的研究[J]. 熱帶亞熱帶植物學報, 2006, 14(3): 179-182.
[16]????? Wang K J, Tang D, Hong L L, et al. DEP and AFO regulate reproductive habit in rice[J]. PLoS Genetics, 2010, 6(1): e1000818.
[17]????? Hua Y W, Huang T D, Huang H S. Micropropagation of self- rooting juvenile clones by secondary somatic embryogenesis in Hevea brasiliensis[J]. Plant Breeding, 2010, 129(2): 202-207.
[18]????? 戴雪梅, 黃天帶, 李? 季, 等. AgNO3對橡膠樹花藥愈傷組織形態及體胚發生的影響[J]. 廣西植物, 2016, 36(12): 1426-1431
[19]????? 靳? 溪, 席? 超, 劉? 進, 等. PDS-1000/He臺式基因槍使用要點及常見問題處理[J]. 生命科學儀器, 2013, 11(Z1): 39-43.
[20]????? 王? 軍, 付愛根, 徐? 敏, 等. 基因槍法在遺傳轉化中的研究進展[J]. 基因組學與應用生物學, 2018, 37(1): 459-468.
[21]????? Hagio T. Optimizing the particle bombardment method for efficient genetic transformation[J]. Japan Agricultural Research Quarterly, 1998, 32(4): 239-248.
[22]????? 楊晚竹, 高亞男, 梁昊岳, 等. 顯微成像分析技術在中性粒細胞運動及吞噬功能研究中的應用[J]. 中國實驗血液學雜志, 2015, 23(3): 832-837.
責任編輯:謝龍蓮

