隔藥灸關元穴對原發性痛經大鼠疼痛反應與血清β-EP、子宮PGE2/PGF2α、脾臟NK細胞活性的影響*
秦中銀 陳盼碧 楊雯雯 金靈敏 唐徐韻 周楊嘉琪 侯天仙
(貴州中醫藥大學,貴州 貴陽 550002)
原發性痛經(PD)是在女性無盆腔病理情況下出現月經疼痛[1],其中疼痛是降低PD患者生活質量的主要原因之一[2]。在西醫方面,對于PD的治療尚無良好的方案,非甾體消炎藥是治療PD的一線藥物,但有諸多副作用,臨床應用范圍有限[3]。中醫藥治療PD起效快,不良反應小,尤其是艾灸治療PD療效確切[4],在改善癥狀與遠期治療效果方面具有獨特優勢。而隔藥灸是中醫外治法的重要構成部分,對治療PD有較好的鎮痛效應。關元穴作為治療PD的主穴,在治療PD的選穴頻次中排第2位[5-6],在位置上關元穴與病位胞宮鄰近,與支配子宮平滑肌的T12~L1節段交感神經有重疊[7]。臨床研究證實[8-9],隔藥灸關元穴與直接灸關元穴治療PD均具有較好療效,但其機制尚未明確,需要進一步探討。本實驗觀察隔藥灸關元穴對大鼠扭體反應、血清β-內啡肽(β-EP)、子宮組織前列腺素E2(PGE2)/前列腺素F2α(PGF2α)、脾臟NK細胞活性的變化,分析隔藥灸關元穴治療PD的可能機制以及與直接灸關元穴的效應差異。
1 材料與方法
1.1 實驗動物 SPF級雌性Wistar大鼠32只,實驗動物由貴州中醫藥大學實驗動物中心提供,動物生產許可證號:SCXK-(軍)2012-0011。動物安置在通風、自然光照環境,自由飲水和給食。本實驗遵照國家有關動物的使用及倫理學規定。
1.2 試藥與儀器 苯甲酸雌二醇由寧波第二激素廠提供[批號:(2011)lIi 0252511];縮宮素由馬鞍山豐原制藥有限公司生產(批號:34020473);艾絨與少腹逐瘀湯方藥(當歸∶川芎∶赤芍∶肉桂∶小茴香∶五靈脂∶沒藥∶生蒲黃∶延胡索∶炮姜=3∶1∶2∶1∶0.5∶2∶1∶3∶1∶1)由貴州中醫藥大學第一附屬醫院中藥房自制;K 562細胞株與大鼠脾臟NK細胞分離液試劑盒、大鼠β-EP、PGE2、PGF2α酶聯免疫試劑盒均購于武漢博士德生物公司(批號分別是:K2011,RATP,DRE2050,DRE20017,DRE2125);電子天平(美國奧豪斯);低溫冰箱(青島Haier);離心機(法國JUOAN);酶標儀(美國BIO-RAD)。
1.3 分組與造模 動物適應性喂養1周后按隨機數字表法分為空白對照組、模型組、隔藥灸關元組、直接灸關元組,每組8只。除空白對照組外,其余各組參考文獻建立痛經模型[10]:持續10 d股部皮下注射苯甲酸雌二醇(第1日和第10日0.5 mg/d,第2~9天0.2 mg/d),末次注射苯甲酸雌二醇24 h后,腹腔注射2 U縮宮素制敏。空白對照同期股部皮下注射等量0.9%氯化鈉溶液。
1.4 治療方法 艾炷統一由艾絨制備,每壯0.5 g;藥餅用少腹逐瘀湯方藥按常規成人劑量,研磨成粉末,治療時用蒸餾水+透皮劑(氮酮)手工制成寬0.8 cm、高0.2 cm的藥餅。治療前2 d剪去大鼠“關元”穴及附近被毛,蘸涂脫毛劑,紗布拭去脫下的毛發。第11日起,將大鼠仰臥位固定在特制固定籠中,在大鼠清醒狀態下進行治療。空白對照組與痛經模型組正常飼養,均不做治療。隔藥灸關元組與直接灸關元組參照《實驗針灸學》取“關元”穴,常規消毒,隔藥灸關元組將藥餅放置“關元”穴上,再將艾炷放置藥餅上;直接灸關元組將艾炷放置“關元”穴上,點燃,兩組均艾灸7壯,每日1次,連續10 d。
1.5 扭體實驗 實驗第21天,治療結束30 min內,每只動物均腹腔注射縮宮素2 U,立即記錄30 min內扭體次數。
1.6 標本采集與檢測 扭體實驗完畢后,用10%水合氯醛(3.5 mL/kg)腹腔注射,待大鼠完全昏迷后進行樣本采集。1)血清β-EP檢測:將麻醉大鼠仰臥位固定于模型板,剝離股動脈,取5 mL血液離心收集上清液,置于-70℃冰箱凍存,用于檢測β-EP含量。2)子宮組織PGE2、PGF2α含量檢測:取血完畢后,大鼠斷頸處死,迅速剖離其新鮮子宮組織,沖洗并拭干水分后精密取50 mg組織,加入提前預冷的PBS 0.5 mL,冰盒中充分研磨30 min,然后以4℃2 500 r/min離心10 min取上清液,-70℃保存,用于檢測PGE2、PGF2α含量。3)MTT比色法檢測各組動物脾臟NK細胞活性:無菌操作下取新鮮脾臟組織,預冷0.9%氯化鈉溶液沖洗血液,濾紙拭干后精密取50 mg組織,研磨、離心與保存方法同子宮組織。用含10%牛血清的1640培養液將脾細胞懸液稀釋,調至1×106/mL,靶細胞用k562(提前孵育24~48 h),調整細胞數為1×105/mL。96孔培養板用移液槍吸取效、靶細胞各100 μL,孵育30 min;效應細胞對照孔然后各滴加100 μL效應細胞、1640培養液,靶細胞對照孔各滴加100 μL靶細胞、1640培養液,每個標本3個復孔。各孔加入10 μL MTT在37℃、5%CO2培養箱條件下共同孵育4 h;孵育完成后,吸棄上清液,各孔加 DMSO 150 μL,甘氨酸緩沖液(pH 10.5)20 μL,中等速度搖床10 min。以570 nm波長的酶標儀計算各孔吸光度值,NK細胞活性計算用每個標本3個復孔測定的均值計算。
1.7 統計學處理 應用SPSS22.0統計軟件。計量資料以(±s)表示,單因素方差分析比較各組差異,進一步用LSD檢驗兩組間差異。P<0.05為差異有統計學意義。
2 結 果
2.1 各組大鼠一般情況與扭體次數比較 見表1。造模前,各組大鼠飲食、行動、精神與毛發色澤一切正常。造模后,除空白對照組無變化,模型組、隔藥灸關元組與直接灸關元組均出現改變,以模型組變化最為明顯,食欲減退,毛發暗淡,動作遲緩。如表1所示,出現注射縮宮素后,空白對照組無扭體,模型組扭體次數較空白對照組明顯增多(P<0.01),與模型組比較,兩個治療組扭體次數顯著減少(P<0.01),但兩個治療組之間扭體次數差異無統計學意義(P>0.05)。
表1 各組大鼠扭體次數及血清β-EP含量比較(±s)

表1 各組大鼠扭體次數及血清β-EP含量比較(±s)
注:與空白對照組比較,*P<0.01;與模型組比較,#P<0.01。下同。
組別空白對照組模型組隔藥灸關元組直接灸關元組n 8 8 8 8扭體次數(次/30 min)0 14.00±6.92*1.70±0.67#2.20±0.49#血清β-EP(pg/mL)205.54±26.28 103.97±28.51*178.27±22.44#139.15±22.90#
2.2 各組大鼠血清β-EP含量比較 見表1。與空白對照組比較,模型組血清β-EP顯著降低(P<0.01),與模型組比較,兩個治療組血清β-EP含量均明顯增加(P<0.01),但兩個治療組之間β-EP含量差異無統計學意義(P>0.05)。
2.3 各組大鼠子宮組織PGE2、PGF2α含量比較 見表2。與空白對照組比較,模型組子宮組織PGE2顯著降低(P<0.01),PGF2α明顯升高(P<0.01);與模型組比較,兩個治療組PGE2顯著提高(P<0.01),PGF2α明顯下降(P<0.01),但兩個治療組之間PGE2與PGF2α含量比較差異無統計學意義(P>0.05)。
表2 各組大鼠子宮PGE2與PGF2α含量比較(pg/mg,±s)
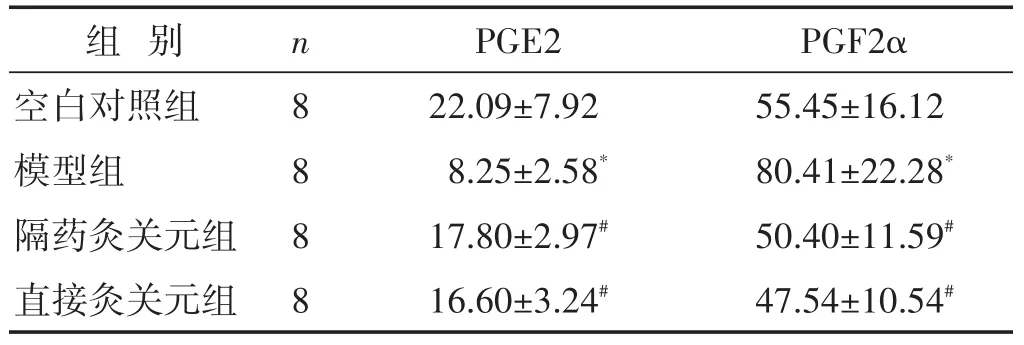
表2 各組大鼠子宮PGE2與PGF2α含量比較(pg/mg,±s)
組別n PGE2PGF2α 8888空白對照組模型組隔藥灸關元組直接灸關元組22.09±7.92 8.25±2.58*17.80±2.97#16.60±3.24#55.45±16.12 80.41±22.28*50.40±11.59#47.54±10.54#
2.4 各組大鼠脾臟NK細胞活性比較 見表3。如表3所示,與空白對照組比較,模型組脾臟NK細胞活性顯著下降(P<0.01);與模型組比較,兩個治療組脾臟NK細胞活性明顯提升(P<0.01);與直接灸關元組比較,隔藥灸關元組NK細胞活性更高(P<0.05)。
表3 各組大鼠NK細胞活性比較(%,±s)
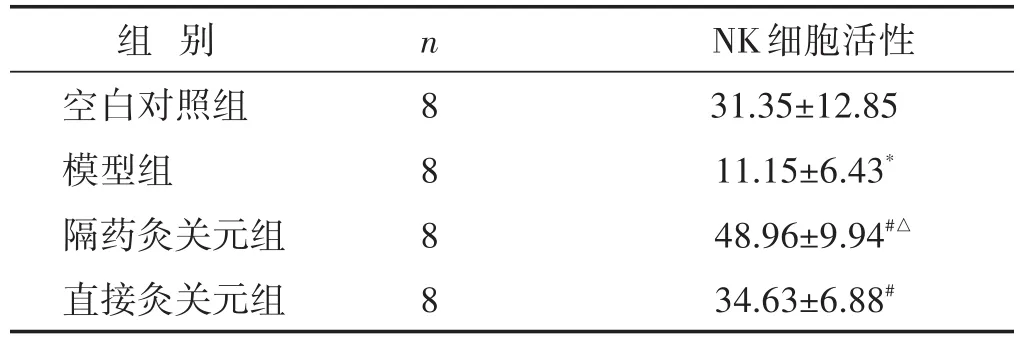
表3 各組大鼠NK細胞活性比較(%,±s)
注:與直接灸關元組比較,△P<0.05。
組別空白對照組模型組隔藥灸關元組直接灸關元組n 888 8 NK細胞活性31.35±12.85 11.15±6.43*48.96±9.94#△34.63±6.88#
3 討 論
痛經的主要病理變化是由于子宮平滑肌痙攣性收縮誘導子宮組織缺血缺氧導致疼痛[11]。在痛經動物模型研究中,扭體反應是一個重要指標,用于檢測鎮痛效應[12]。實驗結果顯示隔藥灸關元與直接灸關元均可明顯減少PD大鼠扭體次數,提示隔藥灸關元與直接灸關元均可緩解PD大鼠疼痛,有較好的鎮痛效應。
PG是機體重要的內分泌激素,PGE2和PGF2α是非妊娠子宮內膜合成與釋放的主要激素,PGF2α可激活子宮內小動脈的PGF2α受體,刺激自主神經纖維,促使平滑肌收縮引起疼痛[13],而PGE2抑制平滑肌自發痙攣緩解疼痛。本研究結果表明,痛經模型組較空白對照組子宮組織PGE2含量顯著減少,PGF2α含量顯著增加。經治療后,隔藥灸關元組與直接灸關元組的子宮組織PGE2水平明顯升高、PGF2α水平明顯降低,提示隔藥灸關元與直接灸關元均可調控PD大鼠子宮組織中PGE2與PGF2α的合成與釋放,促成子宮舒張與抑制痙攣達到止痛效果。
β-EP作為內源性鎮痛作用的神經多肽,可直接靶向子宮,調節生殖內分泌系統,其含量與痛經的發生、轉歸有密切關系[14],臨床研究發現痛經血清中β-EP含量與患者疼痛程度呈負相關[15]。本研究表明,模型組血清β-EP含量顯著降低,誘發PD大鼠疼痛產生扭體反應,而隔藥灸關元組與直接灸關元組的血清β-EP含量明顯升高,揭示隔藥灸關元與直接灸關元均可提高血清β-EP含量達到止痛作用。而β-EP作為內源性阿片肽還可作用于NK細胞膜上的阿片受體而加強其殺傷活性來減輕疼痛[16]。NK不僅是機體重要的免疫調節細胞,同時也是子宮內膜組織主要淋巴細胞,研究顯示,抑制NK細胞活性可降低疼痛閾值[17]。本研究結果顯示,隔藥灸關元與直接灸關元均可提高PD大鼠NK細胞活性,但隔藥灸關元與直接灸關元比較,前者對NK細胞活性的影響更明顯。
本實驗中隔藥灸是間接灸的一種類型,是結合灸法和藥物作用的一種中醫外治法,與同屬中醫外治法的直接灸常用于PD的治療,具有較好的鎮痛效應[8-9],本研究結果與之相符。但在本研究中,隔藥灸“關元”穴后,NK細胞的活性明顯高于直接灸“關元”,但在神經、內分泌相關因子中兩者差異無統計學意義,表明隔藥灸關元對機體免疫功能的影響要優于直接灸關元。原因可能有以下方面。1)隔藥灸關元組有藥餅的使用,藥餅的藥方為少腹逐瘀湯,該方做成隔藥灸的藥餅,結合了灸法與藥物的作用。另外在艾炷的溫熱刺激作用下,藥物經皮質層吸收增加,在相關經穴位置酶活性升高而促進藥物的吸收[18],增強了補益氣血、調經止痛的作用。相關研究也表明少腹逐瘀湯具有調節機體自身免疫的功能[19-20]。2)艾炷燃燒同時產生溫熱效應、光學輻射和艾煙產物,不同隔物介質對灸溫存在差異性影響從而獲得不同的灸效[21]。灸效也受多種因素的調控與影響,比如不同灸法、灸量等,本實驗中隔藥灸與直接灸屬艾灸中的不同灸法,對灸效會產生不同的時效性。相關研究也揭示[22-23],隔物灸不僅在經穴局部位置發揮作用,隔物介質還可滲透到皮下、肌層,起到改善局部微循環、提高免疫功能的作用。以上可能是隔藥灸對PD大鼠NK細胞活性影響優于直接灸的原因。
綜上,隔藥灸關元可通過提高血清β-EP、子宮組織PGE2含量與脾臟NK細胞活性,降低子宮組織PGF2α含量起到較好鎮痛作用,其中隔藥灸與直接灸鎮痛效應相當。本研究中隔藥灸對NK細胞活性優于直接灸的結果,隔藥灸對PD機體免疫功能的影響是否與隔物灸的介質參與、不同灸法、灸量與灸溫等有關,將是我們下一步研究的重點。

