冠心病患者CYP2C19基因快代謝型與氯吡格雷抵抗作用研究
張艷雙, 才 藝, 趙曉杰, 趙桂英, 劉文卿, 李 萍, 閆承慧
北部戰區總醫院 心血管內科,遼寧 沈陽 110016
氯吡格雷是一種廣泛使用的抗血小板藥物,能有效降低血小板活性,從而減少支架內血栓形成,對冠心病(coronary heart disease,CHD)的治療及預防具有重要意義。氯吡格雷是噻吩吡啶類前藥,需要被腸道吸收,通過肝中各種酶的代謝轉化為活性成分,發揮其抗血小板凝集作用[1]。在腸內吸收后的氯吡格雷,85%被羧酸酯酶1水解為無活性的代謝物,并隨尿液或糞便排出體外[2],只有15% 氯吡格雷通過肝中的細胞色素P450激活產生活性代謝物,活性代謝物通過與血小板 P2Y12 受體的不可逆結合來抑制二磷酸腺苷誘導的血小板聚集[3-4]。然而,由于各種遺傳和非遺傳因素導致氯吡格雷代謝發生改變,進而出現氯吡格雷抵抗(clopidogrel resistance,CR),其機制尚不清楚。相關研究表明,CR可能受多種因素影響,如種族、年齡、遺傳多態性、藥物相互作用、患者依從性等[5-7]。有研究表明,氯吡格雷反應變異性與參與代謝的細胞色素 P450酶遺傳多態性有關,CYP2C19負責將氯吡格雷轉化為其活性代謝物[8-9]。根據代謝酶功能的基因型相關個體變異性常分為快代謝型、中等代謝型與慢代謝型[10]。CYP2C19快代謝型的正常患者中,服用氯吡格雷后血小板聚集率急劇下降,很少出現氯吡格雷抵抗。然而,較多CYP2C19快代謝型患者應用300 mg氯吡格雷負荷劑量后,血小板聚集率仍沒有明顯下降。本研究主要通過測定CYP2C19快代謝型CHD患者血小板聚集率、氯吡格雷血漿藥物濃度等,旨在探討CYP2C19快代謝患者出現氯吡格雷抵抗的原因,并進一步分析研究氯吡格雷的抵抗機制,為指導臨床用藥提供科學依據。現報道如下。
1 對象與方法
1.1 研究對象 選取北部戰區總醫院心血管內科自2020年7月至2021年7月收治的202例經CYP2C19基因型檢測篩選為快代謝型CHD患者為研究對象。納入標準:典型臨床表現如胸痛、胸悶等,完善冠脈造影、心電圖及心肌酶標志物等檢查確診為CHD;符合2012歐洲心臟病學會CHD指南[11];臨床資料完整,均進行CYP2C19基因型和血小板聚集檢測。排除標準:對氯吡格雷藥物過敏;肝腎功異常;活動性消化性潰瘍;接受過大手術,腦血管意外或近期出血史。根據二磷酸腺苷誘導的血小板聚集率將其分為氯吡格雷抵抗組(CR組,血小板聚集率≥70%,n=92)與非氯吡格雷抵抗組(NCR組,血小板聚集率<70%,n=110)。本研究經醫院倫理委員會批準。所有患者均簽署知情同意書。
1.2 研究方法
1.2.1 藥物使用方法 治療方案為首次口服300 mg氯吡格雷負荷劑量后,規律口服75 mg/d[12]。
1.2.2 CYP2C19基因型檢測 采集患者清晨空腹靜脈血3 ml(EDTA Na2抗凝)。采用上海百傲科技有限公司提供的核酸提取及CYP2C19基因檢測試劑盒,提取基因組DNA并經聚合酶鏈式反應進行擴增,擴增后雜交顯色經BaiO基因芯片圖像分析軟件進行圖像掃描和數據分析,篩選出快代謝型(野生型純合子型CYP2C19 *1*1)。
1.2.3 血小板聚集率檢測 采用美國HELENA AggRAM血小板聚集儀檢測血小板聚集率。抽取患者空腹靜脈兩管藍色帽枸櫞酸抗凝血,每管3 ml,血與抗凝劑比例9∶1。一管血以748 r/min離心10 min,收集上清液淺黃色血清制備富含血小板的血漿(platelet-rich plasma,PRP)。另一管血以3 000 r/min離心10 min,收集上清液制備貧血小板血漿(platelet poor plasma,PPP),做好標記。打開儀器,吸取250 μl PPP到檢測杯準備空白,待黃色指示燈閃爍兩秒變綠后移走檢測杯。吸取225 μl PRP置于有小磁珠的檢測杯中,并將其放置在測試通道中,使用加樣槍向檢測杯中加入20 μmol/L二磷酸腺苷25 μl,然后測量二磷酸腺苷誘導的血小板聚集率并記錄。CR尚無統一定義,根據相關文獻資料,血小板聚集率相對于基線水平降低<10%為CR[13-15]。
1.2.4 氯吡格雷血漿藥物濃度測定 患者口服300 mg氯吡格雷負荷劑量后,次日采集患者清晨空腹靜脈血3 ml藍色帽枸櫞酸抗凝血,以748 r/min離心10 min,收集血漿儲存1.5 ml收集管中待檢測。
1.2.5 溶液配制 稱取適量氯吡格雷對照品,采用50%乙腈-水溶解并定容,得濃度約為1 mg/ml的儲備液,于-20℃避光保存。吸取氯吡格雷儲備液適量,采用50%乙腈-水稀釋,得濃度為100、50、25、10、4、2、1 ng/ml的標準系列溶液。
1.2.6 色譜條件 色譜柱:ACQUITY BEH C18(100.0 mm×2.1 mm,1.7 μm);流動相:0.2%甲酸的水溶液(A)和乙腈(B)組成,流速設置為0.25 ml/min;柱溫:40℃;進樣量5 μl。正離子模式下的多反應監測。參數如下:ESI正電離模式,錐孔電壓為40.0 V,毛細管電壓為3.2 kV,去溶劑化溫度為450℃,離子源溫度為100℃。去溶劑化、錐孔氣體(氮氣)的流速分別為600、50 L/h。
1.2.7 血漿樣品預處理 取待測血漿樣品200 μl置1.5 ml離心管中,分別加入10 μl內標溶液500 ng/ml和400 μl乙腈,渦旋振蕩3 min,以12 000 r/min、4℃離心20 min。取500 μl上清液在35℃氮氣流下吹干,用50 μl流動相復溶,取上清液進行高效液相液質聯用分析。

2 結果
2.1 兩組患者一般資料比較 兩組患者年齡、男性比例、體質量指數、高血壓、糖尿病、他汀類藥物、鈣通道阻滯劑、雷貝拉唑腸溶片用藥史比較,差異均無統計學意義(P>0.05)。NCR組患者吸煙史比例高于CR組,差異有統計學意義(P<0.05)。見表1。
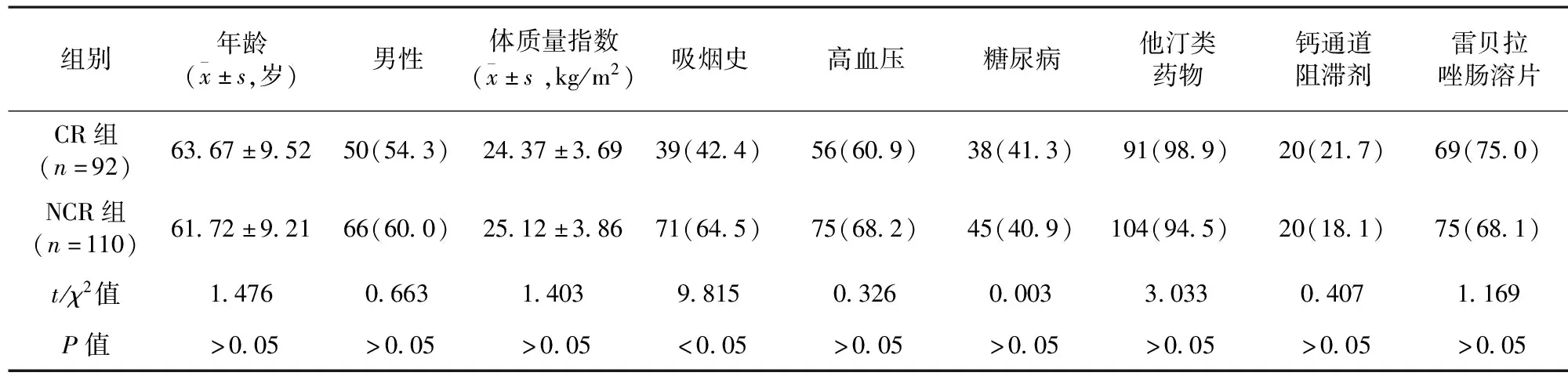
表1 兩組患者一般資料比較/例(百分率/%)
2.2 兩組患者血小板計數與血小板聚集率比較 兩組患者血小板計數比較,差異無統計學意義(P>0.05);CR組患者的血小板聚集率高于NCR組,差異有統計學意義(P<0.05)。見表2。

表2 兩組患者血小板計數與血小板聚集率比較
2.3 兩組患者氯吡格雷血漿藥物濃度比較 CR組患者氯吡格雷血漿藥物濃度為(2.52±3.34)ng/ml,低于NCR組的(3.05±5.33)ng/ml,但差異無統計學意義(P>0.05)。
3 討論
近年來,中國CHD發病率持續增加,病死率與致殘率均較高[16]。氯吡格雷是目前臨床治療CHD患者最廣泛應用的抗血小板藥物之一。據報道,超過30% 接受該藥物治療的患者出現抗血小板療效欠佳[17]。越來越多的研究表明,CYP2C19基因多態性導致對氯吡格雷的不同反應[18],具有正常野生型等位基因的 CYP2C19基因編碼一種功能性酶,可將氯吡格雷前藥轉化為其活性代謝物。與非攜帶者相比,攜帶至少1個無效等位基因的攜帶者氯吡格雷的活性代謝物減少了32.4%,血小板聚集率增加了9.0%[19]。有研究表明,CYP2C19的遺傳變異與氯吡格雷活性代謝物的生物利用度、其抗血小板作用及臨床結果的差異有關[20]。
本研究結果發現,兩組患者血小板計數比較,差異無統計學意義(P>0.05);CR組患者的血小板聚集率高于NCR組,差異有統計學意義(P<0.05)。這表明,兩組患者血小板計數正常無差異,血小板聚集功能出現差異。本研究結果還顯示,CR組患者氯吡格雷血漿藥物濃度為(2.52±3.34)ng/ml,低于NCR組的(3.05±5.33)ng/ml,但差異無統計學意義(P>0.05)。這一結果側面反映出CYP2C19 快代謝型發揮了CYP酶活性,導致氯吡格雷血漿水平降低。兩組患者氯吡格雷活性代謝物的減少,卻并沒有產生抗血小板作用可能與本研究的局限性有關。第一,本研究沒有考慮多態性CYP3A的代謝活性,包括CYP3A4與CYP3A5,二者均為氯吡格雷活化的必需酶之一。有研究結果發現,CYP3A4與CYP3A5的活性與血小板聚集率無關,其基因分型和表型分析也不能預測氯吡格雷的抗血小板作用[21-22]。第二,接受氯吡格雷治療的患者同時服用其他藥物,如阿司匹林、鈣通道阻滯劑、奧美拉唑、他汀類藥物等,除氯吡格雷外,CYP3A4通路還代謝他汀類藥物和鈣通道阻滯劑,CYP2C19通路代謝質子泵抑制劑[23]。因此,藥物相互作用也會影響氯吡格雷的代謝機制。第三,患者的依從性、糖尿病、高血壓等基礎疾病的影響,炎癥因子水平與血小板功能異常引起的CR之間也密切相關。
綜上所述,氯吡格雷在治療CHD中起到至關重要的作用,CHD患者CYP2C19快代謝型發揮酶活性能有效抑制血小板聚集,但也會產生氯吡格雷抵抗,然而多種因素會影響對該藥物的反應,如遺傳多態性,藥物相互作用、患者依從性、糖尿病等,為更好優化氯吡格雷抵抗防治策略仍需進一步探索研究。

