類風濕關節炎實驗性動物模型研究進展
李利青,張 逢,彭馥芝,羅前穎,李 鑫,劉 良,3
(1.右江民族醫學院桂西高發病防治重點實驗室,廣西 百色 533000;2.湖南中醫藥大學中藥粉體與創新藥物省部共建國家重點實驗室(培育基地),湖南 長沙 410208;3. 澳門科技大學中藥質量研究國家重點實驗室,中國 澳門 999078)
類風濕關節炎(rheumatoid arthritis,RA)是一種以慢性、對稱性、多關節病變為特征的自身免疫性疾病,主要表現為滑膜炎、軟骨及骨破壞。遺傳因素(如易感基因HLA-DRB1)是影響RA的主要因素(約占60%),40%是吸煙、飲食、環境等非基因因素。RA的發生發展與細胞因子之間的相互調控失衡有關:自身抗原持續作用,打破正常機體的免疫耐受,免疫細胞(如T細胞)異常激活與分化,釋放多種促炎因子,激活B細胞分泌自身抗體,使關節部位免疫復合物過度形成并持續處于慢性炎癥狀態。早期RA以滑膜炎為主,出現紅腫熱痛經典炎癥表現,持續性滑膜炎導致滑膜細胞快速分裂增殖,逐漸形成增厚的血管翳。晚期RA關節部位有大量的免疫細胞及相關酶浸潤,致軟骨和骨破壞,關節功能受損[1-2]。據統計,RA的全球患病率為0.5%-1%,女性患者多發于男性,死亡率通常是正常人的2倍,被列為全球致殘的危害疾病之一[1, 3]。RA病因不明,發病機制復雜,尚無特效治療藥物,一直是國內外研究的熱點和難點。動物模型很大程度上模擬了RA的致病因素和疾病特點,是研究發病機制和藥物研發的重要工具。目前,RA動物模型主要是以嚙齒類大小鼠為研究對象,其優勢在于遺傳背景穩定,操作方便且經濟。根據模型造模情況,大致可將RA動物模型分為誘導型和自發性轉基因型。本文對相關文獻進行歸納總結,著重選擇最具有代表性的RA動物模型,全面系統地從RA實驗性動物模型的構建方法、免疫機制、致病靶點、疾病特點等方面展開論述,同時對這些實驗誘導型動物模型進行綜合比較,以期為合理選擇實驗動物模型作為RA的基礎研究與藥物研發提供依據和參考。
1 誘導型RA動物模型
誘導型RA動物模型是根據動物品系和發病特點選擇不同的造模物質,采用不同的免疫方法進行誘導,常見的有外源性抗原佐劑誘導型(adjuvant-induced arthrtis,AIA)、內源性抗原Ⅱ型膠原誘導型(collagen Ⅱ-induced arthritis,CIA)、在CIA基礎上發展的膠原抗體誘導型(collagen antibody-induced arthritis,CAIA)、非免疫原性物質降植烷誘導型(pristane-induced arthritis,PIA)及鏈球菌胞壁誘導型(streptococcal cell wall-induced arthritis,SCWIA)。不同誘導型RA動物模型所反應的RA特征和免疫機制也有所不同。
1.1 佐劑誘導型AIA模型AIA最早由細菌學家Pearson CM于1956年在大鼠上建立,是較早使用的經典RA動物模型,廣泛用于RA致病機理研究與抗關節炎藥物評價[4]。AIA通過大鼠尾根部或足跖部皮下注射含有滅活分枝桿菌或減毒卡介苗的完全弗氏佐劑(complete Freund’s adjuvant,CFA)進行免疫誘導。早期造模選用的主要是近交系Lewis大鼠,而遠交系Wistar和SD大鼠等研究報道對AIA敏感性較低[5]。Cai等[6]2006年報道了AIA大鼠模型制備影響因素及SD和Lewis大鼠AIA模型平行比較的系統研究,發現選擇結核分枝桿菌(MycobacteriumtuberculosisH37Ra,Mtb),采用手工研磨制備CFA,并于尾根部皮下免疫,成功建立成模率100%、重復性好及病理程度差異性小的♂ SD系大鼠AIA模型,其在臨床表現、血清學[血沉(erythrocyte sedimentation rate,ESR)]、C反應蛋白(C-reactive protein,CRP)、組織病理和放射學改變以及免疫改變等方面與人RA有許多相似特征[6]。與Lewis大鼠AIA模型比較,該SD大鼠AIA模型具有更接近人類雜合性基因背景、價格便宜、易獲得性等優勢,從而得到國內外風濕免疫學界公認[7]。
RA的特征是以大量CD4+T細胞浸潤為主的慢性滑膜炎癥反應,而大鼠AIA也是一種T 細胞依賴、細胞免疫介導的炎癥性動物模型,在臨床表現和病理機制等方面與人RA 有許多相似特征,是研究外源性誘因引起RA自身免疫反應機制的較理想動物模型[8]。AIA模型發病機制是分子模擬作用,Mtb H37Ra是一個相對分子量為65-kD 熱休克蛋白(heat-shock protein 65,HSP65),與大鼠關節軟骨(CII)的自身抗原HSP60有高度相似的保守序列,通過分子模擬或交叉反應,激活原來處于靜止狀態的針對CII抗原為主的T淋巴細胞,從而引起關節的自身免疫反應,但是過量的Mtb H37Ra易造成模型動物免疫部位嚴重潰爛,出現腹膜炎、脾臟及尾根部皮下結節等關節外表現[9]。AIA易感性與MHC基因的依賴性相關,輔助性T細胞亞群間的平衡紊亂是其主要特點,因此適合T細胞及亞群間的分子機制研究[8]。
1.2 膠原誘導型CIA模型CIA由Trentham等[10]于1977年在遠交系和近交系的大鼠上建立,通過關節軟骨主要構成蛋白Ⅱ型膠原蛋白(collagen type Ⅱ,CII)與非完全弗氏佐劑(incomplete Freund’s adjuvant,IFA)(大鼠)或CFA(小鼠)等量混合制備成乳劑進行免疫誘導,通常在動物的免疫部位(尾根部、背部和跖部)進行多點皮下注射,可根據實驗需要在d 7或d 21加強免疫以確保誘發CIA高發病率,與RA具有相似的滑膜炎和骨破壞等特征,但該模型不存在類風濕因子(rheumatoid factor,RF)[11-12]。CIA是一種內源性自身抗原介導自身免疫性疾病,主要特征是自身膠原的耐受性破壞和自身抗體的產生,是研究RA的金標準體內模型[12]。該模型的易感性受到MHC相關基因和其他細胞因子調控,大多數易感菌株品系發病率在80%-100%[12]。Ⅱ型膠原一般采用異源性CII(雞、小牛和大鼠等動物),通常對Lewis、SD和Wistar大鼠,及敏感性DBA/1(H-2Q)和B10.RIII(H-2R)小鼠有很高的致炎作用。與CIA大鼠不同的是,CIA小鼠是不會通過IFA乳化的Ⅱ型膠原蛋白誘導產生關節炎,其疾病程度與CFA中的Mtb H37Ra濃度有很大的關系,對于低敏感度品系如B10(H-2B)、C57BL/6(H-2B)所需的Mtb H37Ra量會比敏感系小鼠多[12]。另外,免疫乳液的質量和穩定性對于誘導高發病率的關節炎至關重要,制備過程建議全程在冰水浴中,過多的熱量易使膠原蛋白變性[13]。
DBA/1(H-2Q)小鼠品系是CIA經典小鼠模型,d 0和d 21于尾根部免疫乳化的牛CII/CFA乳液,初次免疫后d 26-d 35發病,其優勢在于發病率高,可重復性好,但價格昂貴。經濟性低敏感C57BL/6小鼠對雞CII較敏感,對牛CII膠原不敏感,雞CII/CFA乳化劑免疫也可產生關節炎(踝關節和足掌明顯紅腫),但發病率低于高敏感品系DBA/1小鼠[10-11]。Cai等[14]通過牛CII/IFA乳劑在大鼠尾部進行免疫誘導,以比較不同品系大鼠對CIA的敏感性,發現Wistar大鼠對CIA最敏感,其中♀ Wistar大鼠出現高發病率(>83%)和嚴重的關節炎,其次是Wistar Furth大鼠,SD大鼠最不敏感,d 30可見Wistar大鼠踝關節和足掌明顯紅腫、增生性滑膜炎、血管翳形成、關節軟骨和骨破壞。隨后,該模型成功用于抗關節炎中藥復方制劑青附關節舒及中藥活性單體化合物的藥效評價與機理研究。CIA大鼠對不含結核桿菌的IFA或石蠟油乳化的Ⅱ膠原就能產生自身免疫,且不易對免疫部位產生嚴重的炎癥反應,對藥物評估和免疫指標的檢測也不像 AIA 大鼠或CIA小鼠受其細菌或其組分影響。
1.3 膠原抗體誘導型CAIA模型CAIA模型是經典CIA模型的擴展,通過靶向Ⅱ型膠原蛋白的各種表位的抗體混合物來誘導關節炎的發生,其發病關鍵在于免疫復合物的形成和補體的激活,快速啟動與RA相似的臨床特征[15]。Terato K等[16]用Ⅱ型雞膠原蛋白免疫的DBA/1小鼠中分離出具有識別CB11簇表位的gG亞型多種單克隆抗體,成功構建CAIA模型。隨后Hutamekalin等[17]在4種抗Ⅱ型膠原單克隆(mAb)混合物的基礎上添加具有識別Ⅱ型膠原蛋白LyC1片段的單克隆抗體(CII-3),制成更強致關節炎性的5種抗Ⅱ型膠原單克隆混合物,改善了4種抗Ⅱ型膠原單克隆抗體局限性,不僅減少所需mAb混合物的劑量,還能在多種低反應品系動物(C57BL/6、B10等)中誘導。研究表明,在抗體混合物誘導后給予脂多糖(lipopolysaccharide,LPS)可增強關節炎的免疫效果,起到一定的協同作用。這種CAIA模型采用mAb-LPS聯合誘導,已被廣泛用于自身免疫性關節炎和相關藥物的研究[18]。
CAIA與有限MHC單倍型的CIA不同,幾乎可以在大多數小鼠品系(DBA/1、Balb/c、C57BL/6、B10等)中誘導關節炎發展[15]。于d 0小鼠尾靜脈注射150 μL(1.5 mg/小鼠)抗Ⅱ型膠原單克隆抗體混合物,d 3再注入20 μL(10μg/小鼠)的LPS加強免疫。初次免疫后d 4有炎癥跡象,d 6-d 8關節炎達到最嚴重,足踝和足趾明顯紅腫、炎癥細胞浸潤、血管翳形成、軟骨和骨骼降解,隨后幾天,關節炎的嚴重程度下降[16-17]。腹膜內注射也可用于CAIA高應答菌株,但關節炎的嚴重程度往往較低。對于低反應品系,mAb混合物和LPS的劑量可適當增加,具體取決于小鼠品系。該模型與CIA相似,都是自身抗原誘導,臨床癥狀與RA相似。與CIA相比,CAIA的一個特別優點是該模型適用于不適合CIA的菌株或基因型,在短時間內迅速發病(CIA一般是4周),在發病過程中具有高度的同步性,且模型的復制率高,對快速篩選和評估抗炎藥物具有重要意義[17],有望成為研究人RA的有效模型。但是,CAIA模型很難觀察RA慢性變化,其昂貴的成本也令很多人望而卻步。
1.4 降植烷誘導型PIA 模型PIA由Potter等[19]于1981年在近交系BALB/cJ小鼠建立,是一種非免疫原性致炎物質(降植烷)介導免疫系統產生類似RA慢性復發性關節炎模型。DA大鼠對PIA高度敏感,易形成PIA模型,一次性尾根部皮內注射降植烷后2-3周發生急性關節炎,可見四肢足趾、趾間及踝關節紅腫、關節活動障礙,6-8周后出現反復發作和慢性關節炎,破骨細胞大量形成和炎性細胞浸潤,骨侵蝕及新骨骼形成,發病率接近100%[20]。PIA小鼠以60 d間隔腹腔注射一定量降植烷進行誘導,發病較大鼠晚,注射后2-6月發病[21]。PIA主要是由T淋巴細胞活化引起自身免疫性疾病,依賴于CD4+T淋巴細胞和主要組織相容性復合體Ⅱ(major histocompatibility complex Ⅱ,MHC-Ⅱ)分子聯合調控的慢性特異性炎癥疾病,其病程可遷延數月,急性炎癥發作后隨即進入慢性反復性發作階段[22]。
PIA與RA病程非常相似,其特征是慢性復發性炎癥,骨和骨腐蝕也發生在慢性階段,炎癥僅限于關節,涉及滑膜增生和血管翳形成,RF、軟骨寡聚基蛋白(cartilage oligomeric matrix protein,COMP)和靶抗原(RA33抗原)等抗體高表達。PIA疾病的發生受到不同的基因調控,主要是由MHC區域(Pia)影響該疾病的發展,染色體4和6(Pia2和Pia3)上的基因影響關節炎的發作,而染色體12(Pia4)上的基因與關節侵蝕有關[22]。PIA是RA的高度可復制動物模型,與更廣泛使用的AIA模型相比,PIA的誘導依賴于烷類化合物而不是Mtb抗原,可減少動物的不適(結分枝桿菌感染)。該模型非常適合急性和慢性治療性干預措施,并且考慮到動物福利時更容易接受。
1.5 鏈球菌胞壁誘導型SCWIA模型SCWIA早期由Schwab等[23]將鏈球菌細胞壁片段直接注射到膝關節中誘發兔的關節炎模型,證明鏈球菌細胞壁的肽聚糖多糖(peptidoglycan-peptidoglycans,PG-PS)具有很高的炎癥活性和抗原潛能。后來在嚙齒動物身上得到了發展,SD大鼠單次腹膜內注射SCW的水懸浮液可誘發急性關節炎,隨后完全或部分緩解,后期出現糜爛性滑膜炎,關節畸形和強直[24]。SCWIA的嚴重程度與PG-PS復合物的分子量和結構有關。SCWIA疾病的發展一般分急性期、緩解階段和慢性期,急性期在免疫24 h后有明顯的臨床癥狀,主要是由抗原刺激B細胞產生特異性抗原抗體免疫復合物,沉淀在關節軟骨上激活補體,介導關節急性炎癥,與嗜中性粒細胞浸潤滑膜有關。慢性炎癥期主要因T細胞異常活化和巨噬細胞功能失衡,促進多種免疫因子的釋放,侵蝕性單核細胞累積,導致周圍骨和軟骨破壞[24-26]。
SCWIA常選擇易感性Lewis大鼠和C57B1/10、BALB/c小鼠等構建模型。♀Lewis大鼠通過腹腔注射PG-PS可誘導大鼠多關節炎,并伴有肝脾肉芽腫性病變的形成,24-48 h內發展成急性炎癥和關節腫脹,持續4-5 d后部分消退,2周后T細胞依賴性激活,形成慢性關節炎,表現出滑膜增生,炎性細胞浸潤,對稱性關節受累和復發性炎癥[26]。于C57BL/6J小鼠膝關節內單次注射鏈球菌細胞壁懸浮液可誘發單側急性關節炎,隨后每周重復注射會將該急性炎癥轉變為慢性破壞性關節炎[25]。由于小鼠模型在發病后炎癥表現方面沒有大鼠模型理想,因此常采用大鼠作為模型。SCWIA模型的動物易感性與人類RA相似,但無RF產生,SCWIA誘導關節炎再活化模型有助于闡明免疫性細胞炎癥機制,但是該模型誘導劑經濟成本較高,關節腔注射技術存在一定的難度,不同的PG-PS 結構SCWIA發展程度也有所不同,導致研究使用的頻率偏低[24-25]。
1.6 幾種常見誘導型RA動物模型的比較RA實驗動物模型盡可能地在某些方面模擬RA疾病的發展和特征,不同的造模方法和誘導物所構建的RA動物模型疾病特點也有所不同(Fig 1),通過比較可以發現:①AIA和SCWIA模型的免疫物質主要是細菌性致炎性抗原,易在免疫部位形成潰爛或皮下結節,且易影響關節外其他臟器(如肝脾肉腫大),早期疾病侵襲性較大,對動物體質量影響較大[6, 24];②CIA和CAIA都是模擬內源性物質Ⅱ型膠原進行的免疫誘導,符合RA自身介導的自身免疫性關節炎[6, 12]。CIA對MHC單倍型動物敏感,具有一定的局限性[12],CAIA可在多種小鼠品系誘導,在短時間內迅速發病,且發病率較高,可快速篩選相關的抗炎藥物,但是由于CAIA模型所需的膠原抗體混合物昂貴,CIA乃是目前常用的經典RA模型;③PIA和SCWIA發病趨勢很相似,具有急性炎癥轉變為慢性炎癥的病理過程,非常適合急性和慢性治療性干預措施,與SCWIA和AIA相比,PIA的病程侵襲性較小,但是構建的模型耗時久[13, 17];④從模型的發病病程來看,最早發病的是SCWIA,免疫后48 h后具有明顯的臨床癥狀[24],CAIA(約d 3)>AIA(約d 9)>CIA(約d 14)>PIA(大鼠約d 12,小鼠d 60-d 80發病)。PIA病程持續的時間最長,非常適合針對慢性RA疾病的研究[20];⑤AIA和CIA仍然是學術界最廣泛使用的經典模型,AIA模型更符合經濟性原則,其模型的構建方法也簡單(CIA造模過程繁瑣,免疫混合物的制備要求全程在冰上操作),CIA的病理特征及自身抗原免疫機制與RA最為相似。
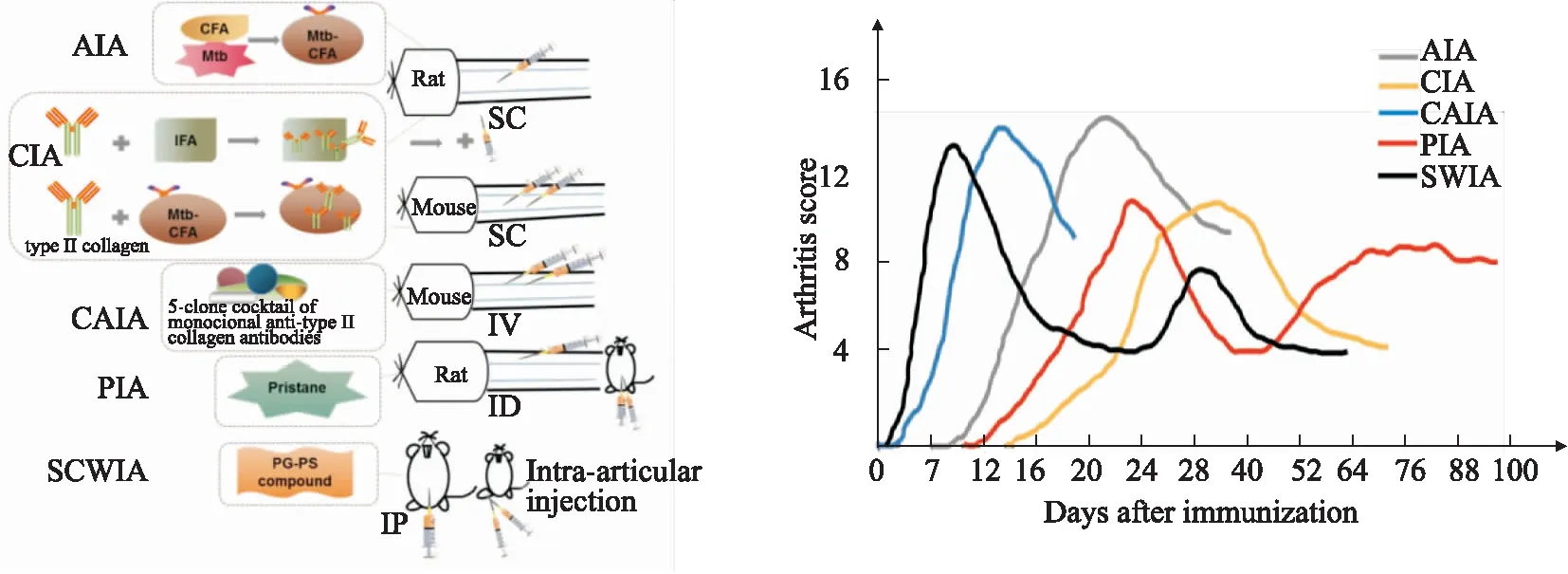
Fig 1 Induction methods and clinical progression of AIA, CIA, CAIA, PIA, and SCWIA
2 轉基因型RA動物模型
轉基因型RA動物模型主要選用嚙齒類小鼠作為受體,利用轉基因技術將特定基因轉移到動物體內,使其自發性發展具有關節炎特征的疾病。目前該模型發展有很多類型,主要有K/BxN轉基因模型、人TNF轉基因小鼠模型和SKG小鼠轉基因模型,是研究分子靶向免疫制劑和發病機制的良好模型。
2.1 K/BxN血清轉移(K/BxN STA)小鼠模型K/BxN關節炎小鼠模型最早由Kouskoff等[27]于1996年發現,是通過轉TCR基因的KRN-C57BL/6T小鼠與易患自身免疫性非肥胖糖尿病(NOD)小鼠雜交而成,3-4周齡自發形成慢性、進行性和對稱性關節炎疾病。該模型RA發展與T細胞免疫機制及自身抗原葡萄糖-6-磷酸異構酶(G6PI)的調控有關。Korganow AS[28]等將K/BxN小鼠的血清轉移到B細胞缺陷型K/BxN-μmol·L-1/小鼠,2 d內出現嚴重關節腫脹,組織病理學發現關節部位出現明顯的炎癥細胞浸潤,滑膜細胞增生,血管翳形成和軟骨破壞。這種以K/BxN血清或抗體轉移(腹腔注射)到首次接受試驗(原始)小鼠體內誘發的關節炎模型,稱K/BxN血清轉移關節炎(K/BxN STA)模型,是研究自身抗體介導的RA或其他關節炎及致病機制的有效工具。K/BxN STA易感性受chr2和chr1基因調控,chr2的C5區域是誘導關節炎發病的主要因素。此外,不同品系的小鼠對K/BxN血清的敏感度也有所不同,Balb/c等高易感小鼠在注射血清24 h后可見踝關節腫脹,C57BL/6和DBA/1等小鼠在d 3-d 4出現關節炎癥發展,而NOD小鼠不敏感。研究表明K/BxN STA模型誘發的關節炎具有短暫性,在單次免疫的小鼠中,約d 15后關節炎癥逐漸消退,但可通過反復注射抗體或血清使關節炎持續存在[28]。K/BxN STA模型和CIA或CAIA相似,都是自身抗體介導的自身免疫性疾病,疾病的發展趨勢和易感性與CAIA有很多共性,可以在多種小鼠品系(ALB/c、C57BL/6和DBA/1等)中誘發,且在短時間內迅速發病,對快速篩選抗關節炎藥物及新靶點治療至關重要。K/BxN STA模型發病率高達100%,對于同品系小鼠其病理變化具有差異性小的特性。
2.2 人TNF轉基因小鼠模型Kollias等[29]于1991年利用基因載體將腫瘤壞死因子(tumor necrosis factor, TNF)基因ARE的3’-UTR端由β球蛋白的3’-UTR端代替,建立慢性持續性過表達人TNF-α (TNF-Tg)動物模型。該模型約3-4周可出現自發性慢性炎癥,在10周齡時發展成RA,表現出與人類RA相似的臨床特征,如對稱性關節炎、滑膜增生及炎癥細胞浸潤、關節軟骨和骨骼破壞等。TNF-Tg小鼠模型表型穩定,病程進展呈現慢性炎癥,有利于藥物的開發及診療技術的改進,與基因敲除小鼠(無T細胞和B細胞)雜交后仍然表現關節炎癥狀。該模型適合做靶向RA的淋巴細胞反應或細胞因子TNF-α等抗體的靶向治療及相關免疫機制的研究。
2.3 SKG小鼠轉基因模型Sakaguchi等[30]通過對BALB/c小鼠進行ZAP-70基因編碼,使SH2結構域自發突變發展T細胞介導的慢性自身免疫性關節炎(SKG小鼠模型)。SKG小鼠約2月齡可見小關節(足趾、足踝)明顯腫脹,進而出現對稱性關節炎和滑膜炎,骨密度及活動性能受到嚴重損害,與人類RA因慢性炎癥而致骨質疏松癥相似,屬于T細胞介導的慢性自身免疫性多關節炎。6月齡以上大部分小鼠可發展為間質性肺炎,并伴有不同程度的血管周圍炎,還有少部分具有皮下壞死性小結節等關節炎表現。SKG小鼠的自發性關節炎發展緩慢,且與可變發病率相關,用β-葡聚糖或酵母多糖A干預有利于模型的控制和復制,且♀SKG小鼠關節炎發生率高于♂ SKG小鼠。
3 總結與展望
RA動物模型研究結果的可靠度取決于與人類RA的可比擬度,好的動物模型在遵守動物福利的基礎上應盡可能與人類疾病相似,最好能在兩種動物體內復制該疾病,且易控制,符合經濟原則。RA動物模型主要是嚙齒類大小鼠,因造模方式和動物品系各異,不同動物模型所表現的疾病特點也有所不同。據上文所示,無論是實驗誘導型還是自發性轉基因型RA模型,都不能反映人RA疾病的全部特性,只能在某一方面或多個方面體現人類RA的部分特征。研究者應仔細評估各種模型的優缺點,以便為要解決的科學問題提供適當的選擇。
研究T細胞及亞群相關機制又考慮經濟性,可選擇AIA模型;CIA因能較好地模擬人類RA的病理特征,仍是目前公認研究RA病理機制和評價治療藥物的最佳動物模型。CAIA造模方便,可快速發病,便于抗原免疫機制和新藥研究,但所需費用昂貴;PIA和SCWIA的病理主要特征是由急性炎癥轉為慢性反復性炎癥,PIA病程較長,具有多種自身抗體升高的特性,適合慢性炎癥及自身抗原相關的研究。轉基因關節炎小鼠模型主要表現為自發的慢性進行性多發關節炎,其中K/BxN STA模型在眾多研究中將其歸為基因型模型,實際上是轉基因模型和實驗誘導型的結合體,主要是以K/BxN小鼠的血清為自身抗體進行免疫誘導,可快速自發性形成關節炎[28],和轉基因關節炎一樣也可用于分子生物層面上的RA 病因病機及靶向藥研究。
目前,盡管對RA的病因及發病機制有了一定的了解,但模型制備方法及評價標準均無統一、規范的實施標準。毫無疑問,動物模型顯然為RA發病機制和藥物篩選提供參考。隨著動物模型研究和實驗方法的發展,有望進一步探尋更具有RA特點的動物模型。