心肌細胞條件性Ppara敲除小鼠模型中他莫昔芬安全有效劑量的篩選*
王晶晶 池亞菲 喬 欣 盧 靜
(首都醫科大學,北京 100069)
條件性基因敲除技術常用于具有胚胎致死性或具有特定的組織細胞生理學與病理生理學功能的目的基因研究,且基因靶向或轉基因小鼠中條件和組織特異性重組系統的出現允許以時間調控和細胞特異性方式評估單個基因的功能。誘導型條件性基因打靶系統的建立,使得對基因在時間和空間上的靶位修飾更加明確,且效果也更加精確可靠。該技術已發展為生物醫學領域一個全新且強有力的研究手段。
心肌細胞特異性表達ERT2Cre(Myh6-ERT2Cre)小鼠是Jackson Laboratory構建的心肌細胞特異性表達他莫昔芬(tamoxifen)誘導的Cre重組酶的轉基因小鼠,代表了在發育中和成年心臟內,任何loxP靶向基因的時間調控失活或在心臟中特異性指導loxP失活的心臟轉基因重組和表達的工具鼠[1]。表達Myh6-ERT2Cre的小鼠心肌細胞在未給予他莫昔芬處理時,并不發揮Cre重組酶的活性,而給予他莫昔芬后,Cre重組酶發生構象改變,并入核與loxP位點特異性結合而發揮基因重組的功能。Hall等[2]研究報道,使用他莫昔芬會造成小鼠短暫性的心臟功能損傷,所以合適且有效的他莫昔芬使用劑量有待探究。
為了得到誘導型心肌細胞特異性Ppara敲除小鼠,同時規避使用他莫昔芬造成心臟功能損傷而影響實驗結果,本研究通過給予Pparafl/fl, Myh6-ERT2Cre小鼠不同劑量的他莫昔芬,驗證Ppara基因敲除效率及對心臟功能影響,從而成功構建誘導型心肌細胞特異性Ppara基因敲除小鼠。
1 材料和方法
1.1 材料
1.1.1實驗動物:Myh6-ERT2Cre小鼠經由北京維通利華實驗動物技術有限公司代理購自Jackson Laboratory(005657),實驗動物生產許可號:SCXK(京)2016-0006。Pparafl/fl來自于美國Gonzalez教授課題組。實驗所需Pparafl/fl和Pparafl/fl, Myh6-ERT2Cre小鼠飼養于首都醫科大學SPF級動物房獨立送回風凈化籠(Individual ventilation cage,IVC)內,相對濕度:50%~60%,溫度:22~24 ℃,12 h/12 h明暗交替,自主飲食和飲水。所有實驗操作嚴格遵守動物倫理和動物福利的要求,按照美國國立衛生研究院制定的《實驗動物管理和使用指南》和首都醫科大學實驗動物管理委員會的相關規定進行實驗,倫理委員會審批號:AEEI-2018-127。
1.1.2主要試劑:他莫昔芬(T5648)乙醇油溶液(含20%乙醇的他莫昔芬玉米油溶液)及玉米油(C8267),購自Sigma;TRIzol(15596018),購自Invitrogen;反轉錄試劑盒(A5001),購自Promega;SYBR Green(RR420A),購自Takara;核蛋白提取試劑盒(78835),購自Thermo;麗春紅、酸性品紅及苯胺藍,購自國藥集團化學試劑有限公司;Nuclear and Cytoplasmic Extraction Reagents(78835),購自Thermo;PVDF膜(ISEQ00010),購自Millipore;脫脂牛奶(P1622),購自普利萊;PPARα一抗(ab97609)和LAMIN B1一抗(ab133741),購自Abcam。
1.1.3主要儀器:小動物超聲影像系統(Vevo 2100,Visual Sonics);實時定量熒光PCR儀和Western blot垂直電泳系統(Bio-Rad);倒置(熒光)顯微鏡(OLYMPUS)。
1.2 方法
1.2.1小鼠模型的建立:6~7周齡的雄性Pparafl/fl, Myh6-ERT2Cre小鼠,隨機分為:對照組(腹腔注射含20%乙醇的他莫昔芬玉米油溶液)、A組(單次腹腔注射他莫昔芬2 mg/只)、B組(20 mg/kg,連續注射他莫昔芬5 d)和C組(40 mg/kg, 連續注射他莫昔芬5 d),n=8。注射后繼續飼養兩周。
1.2.2小鼠心臟超聲監測:所有實驗小鼠在實驗結束當日使用Vevo 2100TM高分辨率小動物超聲影像系統進行心臟超聲,主要檢測心臟橫切面,留取1~2個清晰穩定的影像圖像進行后期測量統計分析,包括反映心臟功能狀態的左心室射血分數(EF%)、左心室短軸縮短率(FS%)等指標。
1.2.3Masson染色:將心臟于4%多聚甲醛中固定24 h后,進行常規組織脫水、石蠟包埋、病理切片及染色。對切片進行Masson染色后,封片及觀察。根據METAVIR評分標準按照F0~F4等級進行評分。
1.2.4Real-time qPCR:TRIzol提取組織總RNA,使用Promega GoScript TM反轉錄系統將2 μg 總RNA反轉錄為cDNA。 Real-time qPCR使用SYBR Green和Bio-Rad CFX Connect系統進行,反應程序:95 ℃、 3 min,95 ℃、 45 s,60 ℃、40 s進行擴增,共40個循環。熔解曲線:55~90 ℃,每個循環增加0.5 ℃。PCR結束后,將數據導至Excel表,分析結果:以Actb為內參基因,采用公式 2-△△CT計算PparamRNA的相對表達量,并進行組間統計學比較分析。引物序列如下:Ppara5′-CCCTGAACATCGAGTG CGAA-3′,Ppara5′-TTCGCCGAAAGAAGCCCTTA-3′,Actb5′-ATGGAGGGGAATACAGCCC-3′,Actb5′-TTC TTTGCAGCTCCTTCGTT-3′。
1.2.5Western blot:按照Nuclear and Cytoplasmic Extraction Reagents試劑盒的使用說明從心臟組織中提取核蛋白,并進行蛋白濃度的測定、定量及變性。10% SDS-PAGE凝膠電泳分離50 μg核蛋白,使用Trans-Blot Turbo Transfer System轉移至PVDF膜在5%脫脂牛奶中封閉,PPARα一抗和LAMIN B1一抗4 ℃孵育過夜。過夜后,進行常規洗滌及孵育HRP二抗,ECL顯影。
1.3 統計學分析
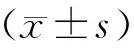
2 結果
2.1 小鼠的交配及基因型鑒定
Pparafl/fl, Myh6-ERT2Cre小鼠來源于Pparafl/fl小鼠和Myh6-ERT2Cre小鼠的雜交后代。將Pparafl/fl小鼠和Myh6-ERT2Cre小鼠進行雜交及回交,根據基因型鑒定結果獲得Pparafl/fl, Myh6-ERT2Cre小鼠和同窩對照Pparafl/fl小鼠,之后將Pparafl/fl, Myh6-ERT2Cre小鼠和Pparafl/fl小鼠進行交配繁殖以滿足實驗所需(見圖1)。

圖1 小鼠的交配及基因型鑒定Fig.1 Mating and genotyping of mice
2.2 小鼠注射他莫昔芬后心臟超聲結果
Pparafl/fl, Myh6-ERT2Cre小鼠注射他莫昔芬兩周后進行心臟超聲監測,檢測結果顯示4組小鼠的室壁厚度(LVST)、心室容積等指標未見改變,而對心臟功能指標EF%和FS%進行統計分析發現:與對照組相比, A組及B組小鼠的心功能均未見有所改變,而C組小鼠的心功能有所下降,但沒有統計學意義(P>0.05)。此結果提示C組的注射方式對Pparafl/fl, Myh6-ERT2Cre小鼠的心臟功能產生一定程度的損害(見圖2)。

圖2 小鼠注射他莫昔芬后EF%和FS%值Fig.2 EF% and FS% of mice after administration with tamoxifen
2.3 注射他莫昔芬后心臟組織中Ppara mRNA的表達水平
Pparafl/fl,Myh6-ERT2Cre小鼠注射他莫昔芬兩周后檢測其心肌組織中PparamRNA的表達水平。Real-time qPCR結果顯示:給予Pparafl/fl, Myh6-ERT2Cre小鼠他莫昔芬兩周后心肌組織中PparamRNA的表達水平均會降低,尤其是B組和C組的小鼠心肌組織中PparamRNA的表達水平極低,說明劑量為20 mg/kg或40 mg/kg連續5 d的他莫昔芬注射方法可以達到誘導性敲除心肌細胞中Ppara的效果(見圖3)。

圖3 小鼠注射他莫昔芬后心肌組織中Ppara mRNA的表達注:與對照組相比,*P<0.05,****P<0.0001Fig.3 Expression of Ppara mRNA in myocardium after administration with tamoxifenNote: Compared with the vehicle group, *P<0.05,****P<0.0001
2.4 注射他莫昔芬后非心臟組織中Ppara mRNA的表達水平
為了明確給予他莫昔芬兩周后是否會影響Pparafl/fl, Myh6-ERT2Cre小鼠除了心肌外的其余組織細胞中PPARα的正常表達,提取了血管、肝臟、腎臟、骨骼肌、肺、白色脂肪和棕色脂肪總RNA,Real-time qPCR檢測這些組織中PparamRNA的表達改變,結果顯示:給予他莫昔芬不會影響Pparafl/fl, Myh6-ERT2Cre小鼠非心肌組織中PparamRNA的表達水平(見圖4)。

圖4 小鼠注射他莫昔芬后非心肌組織中Ppara mRNA的表達改變Fig.4 Expression of Ppara mRNA in non-myocardium after administration with tamoxifen
2.5 注射他莫昔芬后心臟Masson染色結果
Pparafl/fl, Myh6-ERT2Cre小鼠注射他莫昔芬兩周進行心臟組織石蠟切片Masson三色染色,觀察心肌組織纖維化的改變情況。對Masson三色染色結果進行統計分析顯示:與對照組相比,A組和B組小鼠的心肌組織形態未見改變,而C組小鼠的心肌纖維化面積增加,此結果說明高劑量他莫昔芬40 mg/kg注射5 d的給予方式對Pparafl/fl, Myh6-ERT2Cre小鼠的心肌造成了一定程度的損害(見圖5)。

圖5 他莫昔芬注射后心肌組織Masson染色注:與對照組相比,*P<0.05Fig.5 Masson staining of myocardium after administration with tamoxifenNote: Compared with the vehicle group,*P<0.05
綜上所述,連續5 d腹腔注射20 mg/kg他莫昔芬的給藥劑量可以達到建立誘導型心肌細胞特異性Ppara敲除(Ppara△CM)小鼠的效果。
2.6 他莫昔芬誘導型心肌細胞特異性Ppara敲除小鼠心肌組織中PPARα蛋白表達水平
為了進一步明確Ppara△CM小鼠的成功建立,給予Pparafl/fl, Myh6-ERT2Cre小鼠連續5 d腹腔注射20 mg/kg他莫昔芬兩周后提取心肌組織中核蛋白,檢測心肌組織中PPARα的表達改變。Western blot結果顯示:連續給予20 mg/kg他莫昔芬5 d,兩周后Pparafl/fl, Myh6-ERT2Cre小鼠心肌組織中PPARα的表達殆盡,達到了誘導性敲除心肌細胞中Ppara的效果(見圖6)。

圖6 Western blot檢測Ppara△CM小鼠心肌組織中PPARα的表達Fig.6 Expression of PPARα in myocardium of Ppara△CM mice by Western blot
3 討論
傳統的基因敲除小鼠是在DNA同源重組、胚胎干細胞等技術基礎上進行基因打靶制備的,但并不適用于具有胚胎致死性或調控生理與病理生理關鍵基因的研究。使用Cre-loxP技術控制小鼠基因缺失組織特異性的能力具有極為先進的小鼠遺傳學和檢測體內單個基因功能的能力[3]。但是,Cre-loxP方法的一個重大局限性是無法暫時控制遺傳重組,而利用組織或細胞特異性啟動子和藥物誘導劑的Cre重組酶的表達可對基因重組事件進行空間和時間限制。Myh6-ERT2Cre小鼠就是可以利用他莫昔芬實現心肌細胞特異性和時間調控的基因重組工具小鼠[1]。
在Myh6-ERT2Cre小鼠中,Cre重組酶與兩個突變的雌激素受體域融合,當與雌激素類似物他莫昔芬結合后此融合蛋白便從細胞質穿梭到細胞核中發揮基因重組的功能[4-5]。Myh6-ERT2Cre小鼠在條件性基因敲除實驗中得到了廣泛的應用[6]。然而,Hall等[2]和Lexow等[7]報道表明,帶有心肌細胞特異性Cre重組酶給予他莫昔芬后可造成小鼠劑量依賴性的急性心臟功能障礙、心肌死亡、炎癥及纖維化,甚至死亡。Andersson等[8]研究表明,可以利用瞬時效應或減少他莫昔芬的總劑量來最大程度地降低其心臟副作用。因此,本研究根據Gopal等[9]和Liang等[10]報道,對所選擇的不同方案從Pparafl/fl, Myh6-ERT2Cre小鼠心臟功能、組織形態學及PPARα的誘導性敲除水平進行綜合評估,建立有效穩定的可誘導型心肌細胞特異性Ppara敲除小鼠。研究發現三種他莫昔芬給藥劑量均不會造成心臟收縮功能障礙,但單次給予2 mg/只他莫昔芬腹腔注射組不能充分敲低心肌細胞中Ppara的表達。雖然高劑量的40 mg/kg連續給藥5 d的方案可以達到心肌細胞中Ppara的敲除效果,卻造成了一定程度的心功能影響及心肌纖維化增加。因此,20 mg/kg連續腹腔注射他莫昔芬5 d的給藥方案可以充分敲除心肌細胞中的Ppara,并且不會造成小鼠心功能和心肌的損傷,成功構建的Ppara△CM小鼠,這將為研究成年心臟中PPARα的基因調控功能提供了基礎。

