新生兒微小化心肺轉流策略的臨床應用
吳柯葉,孟保英,周 星,張設設,張 程,丁以群
隨著心肺轉流(cardiopulmonary bypass,CPB)、外科及術后監護技術的不斷發展,先天性心臟病直視手術逐漸出現低齡及低體重化的趨勢,同時對CPB技術提出了更高的要求[1]。目前兒科CPB策略大多源自成人CPB經驗,尤其新生兒CPB缺乏統一、規范的管理方法[2]。本文擬通過描述和比較本中心心臟直視手術中新生兒微小化CPB管理策略,為改善術后臨床結局、減少血制品的使用提供依據。
1 資料與方法
1.1 一般資料回顧性分析2015年5月至2020年10月于本中心行CPB下心臟直視手術的新生兒(年齡≤28天)共243例,其中男143例(58.9%),女100例(41.2%);平均年齡(11.8±7.6)d,平均體重(3.2±0.6)kg。術中使用的CPB策略包括傳統組(n=55)和微小化組(n=188);為評價微小化CPB中選擇性不使用超濾的效果,進一步分為傳統超濾組(n=55)、微小化非超濾組(n=63)和微小化超濾組(n=125)進行結局比較;序貫療法僅在主動脈縮窄(coarctation of aorta,COA)矯治術、大動脈調轉術(arterial switch operation,ASO)和主動脈弓離斷(interrupted aortic arch,IAA)矯治術中使用,CPB微小化組中行此三種手術的新生兒共96人,分為序貫療法組(n=36)和非序貫療法組(n=60);再根據手術種類的不同,分別在三種手術中作亞組分析。
1.2 CPB策略患兒均使用Stokert-S5型(Munich,Germany)人工心肺機,選用FX05(Terumo Corp,Tokyo,Japan)或Micro/VKMO11000(Maquet,Rastatt,Germany)氧合器。CPB中灌注壓力維持在30~50 mmHg,在足夠的灌注流量下,如果灌注壓力始終低于30 mmHg,則給予去氧腎上腺素。主動脈阻斷后,以20 ml/kg的單次劑量給予改良St.Thomas心臟停搏液,若主動脈阻斷時間超過60 min,則加灌一次,劑量同前。
傳統CPB策略:2016年之前采用傳統CPB策略;靜脈儲血罐的高度在手術臺下方20~30 cm;所有管道內徑均為1/4英寸,管道長300 cm,預充量300 ml;預充液常規使用乳酸林格液、紅細胞懸液(1~1.5 U)、50 ml新鮮冰凍血漿或50 ml人白蛋白,預充藥物包括烏司他丁(10 000 IU/kg)、肝素(2 500 IU)和呋塞米(速尿)(注射1 mg/kg,最大10 mg/次);此外,新生兒均采用改良超濾。
微小化CPB策略:本中心自2016年12月起應用微小化CPB管路,策略的具體內容如下:①靜脈儲血罐的高度與手術臺高度相等,泵頭懸掛、盡量靠近手術臺;②平面報警貼片貼于氧合器液面標志的25~30 ml處,保證開機前儲血罐內液平面幾乎為零;③CPB管道長110 cm,新生兒CPB管路中的主泵管、動、靜脈管路及左心引流管內徑均為3/16英寸,預充量80 ml,其中使用自體血逆預充技術(retrograde autologous priming,RAP)時預充量為65 ml;④使用負壓輔助靜脈引流裝置(vacuum assisted venous drainage,VAVD),維持壓力≤-25 mmHg;⑤預充液采用復方電解質溶液(Baxter healthcare Corp,Shanghai,China),預充藥物為烏司他丁(10 000 IU/kg)和肝素(1 500~2 000 IU),當術前紅細胞壓積(hematocrit,HCT)低于0.38時,預充0.5 U的紅細胞;⑥在手術消毒切皮前靜脈推入呋塞米注射液1 mg/kg(最大5 mg/次),CPB管路中不常規接入超濾器,僅在以下情況下選擇性使用超濾:手術時間短、術中術野吸回大量晶體液或利尿效果不滿意,導致停機前貯血器液平面較高,則臨時加裝常規超濾器;患兒術前存在嚴重心功能衰竭導致嚴重水鈉潴留,或CPB結束后需要輸注血小板、冷沉淀等則使用改良超濾;⑦采用目標導向灌注,灌注師通過監測患者腦氧飽和度、混合靜脈氧飽和度、有創動脈血壓和乳酸等來確定灌注時最合適的流量;⑧應用序貫療法:停CPB后即刻由外周靜脈快速輸注血小板(0.5 U/kg),同時進行改良超濾,血小板輸注結束后停改良超濾,予以魚精蛋白中和,依次輸注冷沉淀(1 U)、纖維蛋白原(0.2 g)、凝血酶原復合物(100~150 U)。根據醫院血小板的配備和供給情況決定是否進行序貫治療,即能匹配到合適的血小板即采用序貫療法。⑨溫度管理:手術前對手術室和手術臺進行預熱,使其溫度保持在30℃左右;注意在麻醉期間保持患兒體溫;在CPB前保持預充液的溫度;CPB中縮短超濾時間或在超濾過程中予以血液保溫,防止體溫下降;主動脈開放后保持室溫在30℃左右,手術臺使用溫毯持續保溫,提前加熱轉運輻射臺,防止停機后核心溫度下降,保持核心溫度不低于36℃;⑩超快通道臨床應用。
1.3 麻醉管理患兒手術由同一麻醉及外科醫生團隊完成,均采用靜吸復合麻醉,氣管插管和機械輔助通氣。患兒術前出現心功能衰竭或伴有肺部疾病或其它遺傳代謝病,則采用常規心臟麻醉;其余患兒均采用超快通道麻醉。超快通道麻醉方案為:靜脈注射咪達唑侖0.1 mg/kg、舒芬太尼1μg/kg、丙泊酚1.5 mg/kg、順阿曲庫銨0.3 mg/kg誘導,術中持續給予瑞芬太尼及右美托咪啶泵注,并吸入七氟烷維持麻醉。患兒均采用胸骨正中切口,肝素化后(400 U/kg),待ACT達到480 s時開始CPB。超快通道是指在手術室內拔除氣管插管;對實行超快通道麻醉的患兒,根據術后血氣和麻醉機呼吸參數進行評估是否實施超快通道。
1.4 資料收集觀察指標包括一般臨床資料、CPB預充量、術中尿量、無血預充率、入ICU即刻動脈血氣分析指標、術后機械通氣時長、超快通道率、超濾使用率、血制品輸注情況、12 h及24 h胸液引流量、術后ICU時長、住院時長及院內死亡率等。
1.5 統計學分析采用Stata 12.1統計軟件進行數據統計分析,P<0.05為差異有統計學意義,所有檢驗均采用雙側檢驗。計量資料采用均數±標準差(±s)或中位數和四分位間距[Q(Q1,Q3)]表示,兩組之間比較采用t檢驗或Wilcoxon秩和檢驗;計數資料采用頻數和百分比[n(%)]表示,組間比較采用卡方檢驗(χ2)或Fisher確切概率法。
為了確定CPB策略與手術結局的相關性,構建多因素回歸模型調整了患者的性別、手術年齡、術前體重、術前肺炎、術前機械通氣、手術復雜度評分、CPB時間、主動脈阻斷時間和手術時長,分類性結局指標采用多因素logistic回歸模型,連續性結局指標采用多因素線性回歸模型進行分析。
2 結 果
2.1 一般情況CPB傳統組和微小化組策略下,兩組患兒的性別、手術年齡、術前體重、術前是否肺炎、術前有無機械通氣、手術復雜度評分、主動脈阻斷時間及手術時長的差異均無統計學意義(P>0.05)。傳統組的CPB時間明顯短于微小化組(P<0.05),見表1。
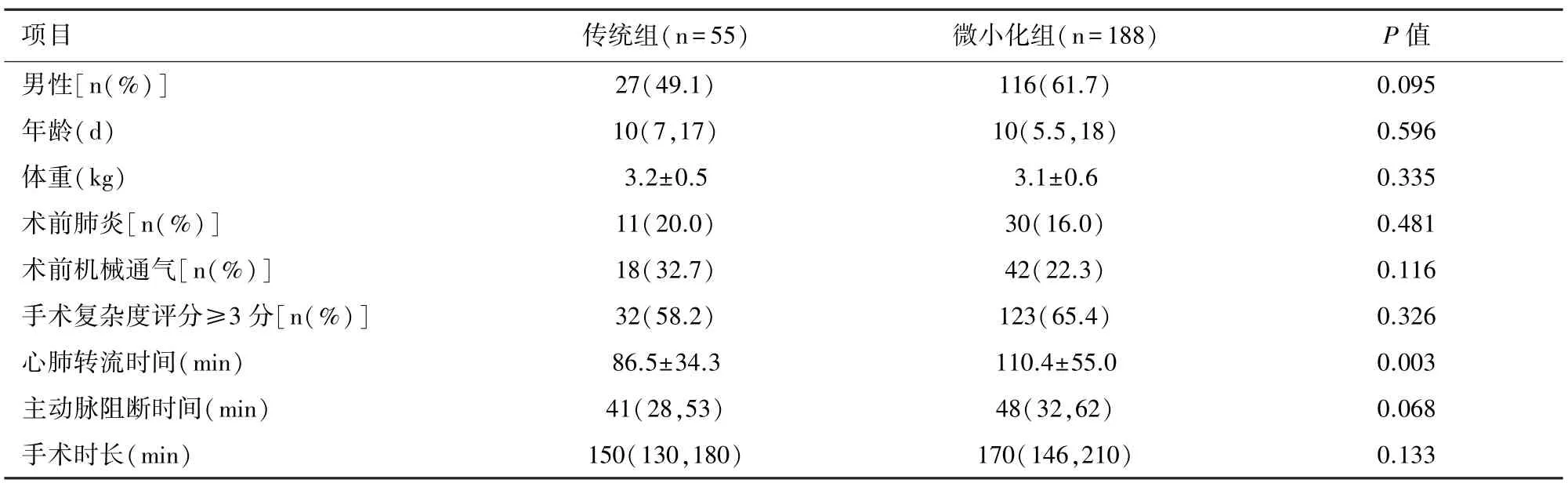
表1 兩組患兒的一般情況比較
2.2 傳統組和微小化組策略的結局指標比較微小化組ICU時長明顯短于傳統組(P=0.007);傳統組新生兒全部實施改良超濾,微小化組的患兒的超濾率明顯低于傳統組(P<0.001);兩組在無血預充率、術后HCT、超快通道率、術后機械通氣時長、再插管率和住院時長方面差異均無統計學意義(P>0.05)。見表2。
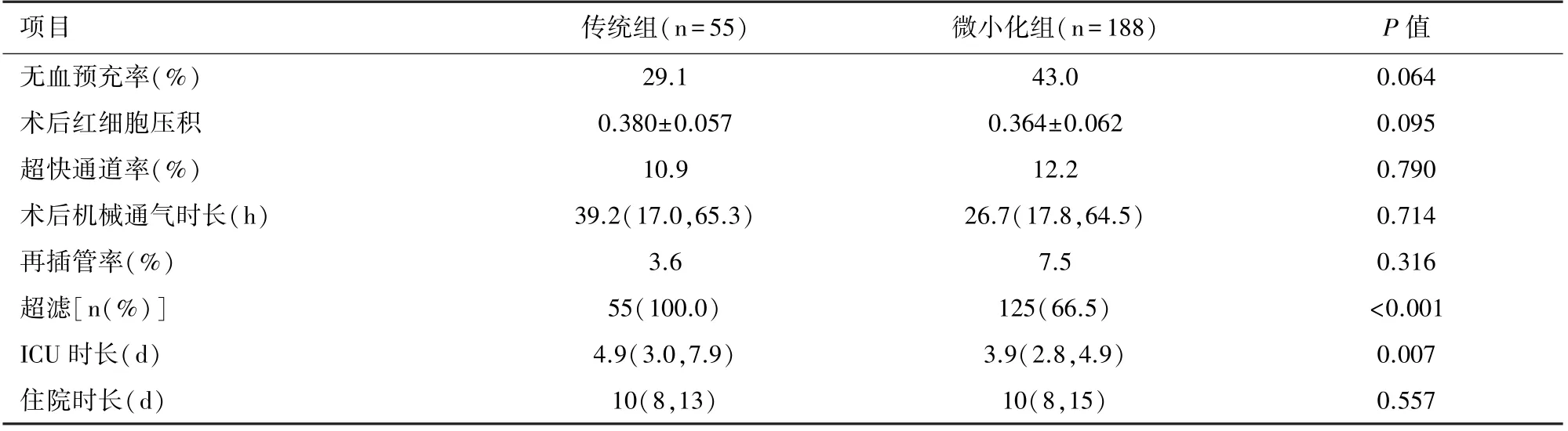
表2 兩組患兒的結局指標比較
2.3 兩種CPB策略對手術結局的影響分析CPB策略僅與患兒無血預充率顯著相關(P=0.035),即微小化組與無血預充率高獨立相關;但是在超快通道、再插管、院內死亡、術后機械通氣時長、ICU時長和住院時長等兩組間差異均無統計學意義(P>0.05);見表3和表4。
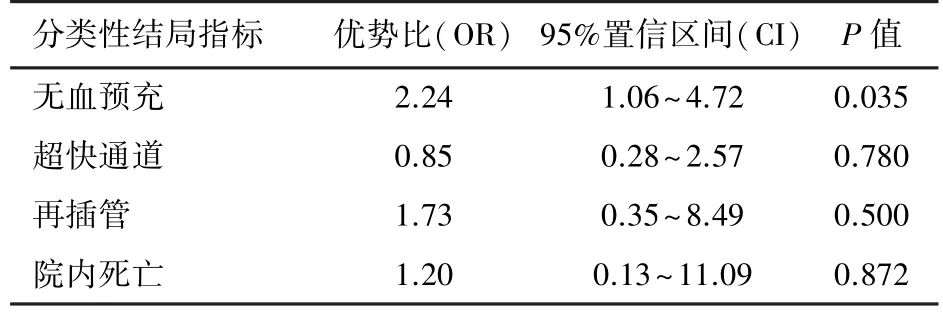
表3 CPB策略對分類性結局指標的影響分析
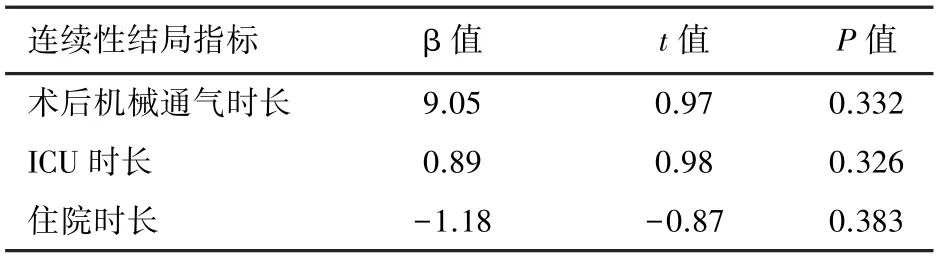
表4 CPB策略對連續性結局指標的影響分析
2.4 超濾組和非超濾組的結局比較與傳統超濾組相比,微小化非超濾組患兒尿量明顯更高(P=0.017);兩組在其他指標如無血預充率、術后HCT、超快通道率、術后機械通氣時長、ICU時長、住院時長方面差異均無統計學意義(P>0.05)。與微小化非超濾組相比,微小化超濾組患兒尿量明顯更少(P<0.001),ICU和住院時間明顯更長(P<0.05)。見表5。
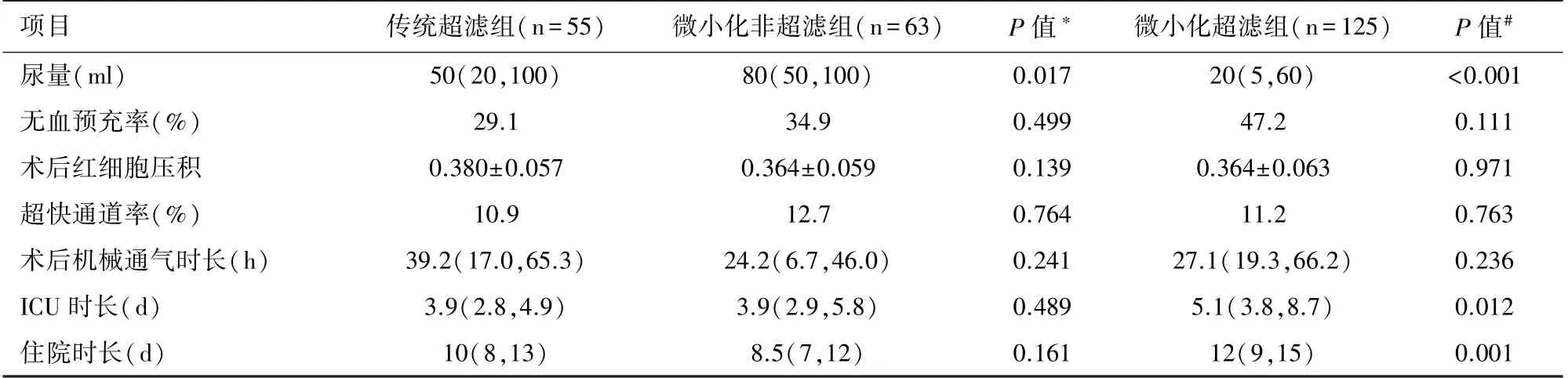
表5 超濾組和微小化非超濾組結局的比較
2.5 序貫療法的效果分析采用序貫療法的患兒12 h和24 h胸引量明顯低于未采用序貫療法的患兒(P<0.05);對3種手術方式做亞組分析,采用序貫療法的患兒12 h和24 h胸引量均明顯低于非序貫療法者(P<0.05)。見表6。
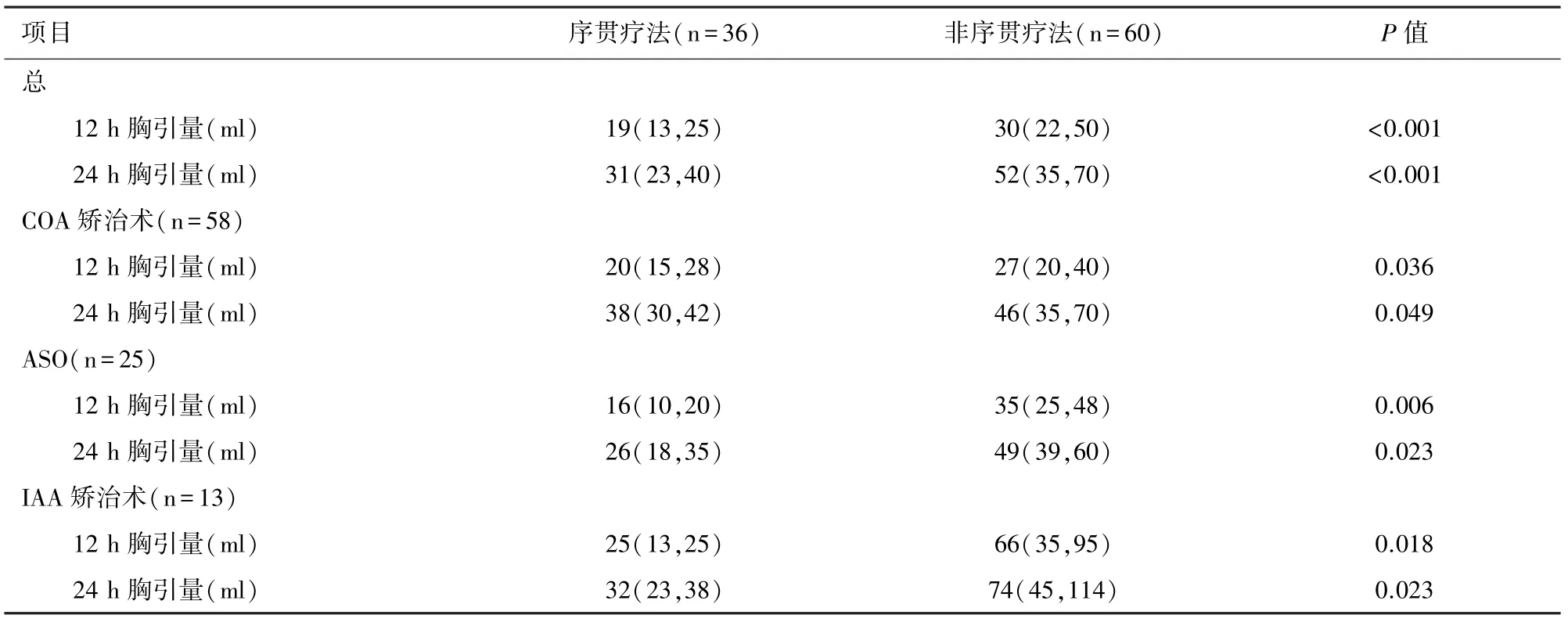
表6 兩組患兒術后胸引量的比較
3 討 論
相較于成人CPB,兒童管路的預充量占自身血容量比例更大,容易導致血液稀釋和組織水腫,而在新生兒心臟手術中表現則更為明顯[3],因其各器官系統發育尚不成熟,對血液稀釋和組織水腫的耐受性較差,進而導致血液攜氧能力下降和術后出血;與此同時,新生兒的心臟手術往往更加復雜,手術時間相對較長,因此新生兒在CPB下行心臟手術更容易發生不良結局[4]。為了應對這一問題,有研究者提出應用超濾或輸血等措施,然而這些措施也存在一些潛在的缺點[5];應用超濾會增加CPB的預充量,以及血液與非內皮材料的接觸面積,從而增加血液稀釋和炎癥反應的程度;庫存血液的輸注同樣可能會引發一系列炎癥反應,增加器官功能障礙、術后早期發熱和過敏的風險,影響患兒預后[6-7]。也有研究[8]報道輸血會增加嚴重并發癥的風險,且與輸血相關的急性肺損傷會增加術后機械通氣時間,是造成發病和死亡的主要原因之一。因此近年來也有很多學者提出了多種CPB節血策略[9]。
本中心自2016年起應用微小化CPB及RAP技術,將新生兒預充量降至65 ml,且逐步形成了一套具有特色的微小化CPB策略[10]。本研究結果證實了微小化CPB策略與無血預充率獨立相關,說明微小化管路及選擇性使用超濾能顯著降低紅細胞預充量,大大減少了新生兒心臟直視手術中血液制品的使用;與傳統的CPB系統相比,微小化CPB系統在減少預充量方面表現出了顯著的優勢。
術后機械通氣時間延長與呼吸機相關性肺炎、ICU和住院時間以及住院費用的增加緊密相關,且新生兒群體更容易發生延遲拔管或拔管失敗的情況[11]。在本中心,新生兒中同樣實行圍術期快通道麻醉策略,盡早拔管以減少機械通氣時間。本研究中,微小化組患兒的術后機械通氣時長(26.7 h)略低于傳統組患兒(39.2 h),但統計學分析發現差異無統計學意義,說明微小化CPB策略在新生兒的應用并不能顯著減少患兒術后機械通氣時長。然而,相比于傳統組CPB策略下患兒(4.9 d),微小化組CPB策略下新生兒的術后ICU滯留時長(3.9 d)顯著降低。
本中心實行微小化組CPB中選擇性使用超濾[12],本研究中,微小化組CPB策略下有33.5%的新生兒未使用超濾,這部分患兒的尿量(80 ml)明顯高于傳統組CPB策略下超濾的患兒(50 ml),然而其他結局指標未發現明顯差異。說明部分新生兒CPB手術在微小化CPB策略下也可以實現不超濾;這種基于微小化CPB的選擇性不使用超濾的策略不會延長術后機械通氣時長、術后ICU停留時長和住院時長。
術后出血與不良事件的增加緊密相關,如透析、體外膜氧合支持等[5]。新生兒凝血系統發育不成熟,出生后易出現維生素K1依賴的凝血因子缺乏,易導致術后出血;且新生兒CPB預充量較大,導致血液稀釋后凝血因子濃度的稀釋,同時新生兒心臟手術的時間較長等原因也更易導致術后出血[13]。有研究者提出:輸注紅細胞、血小板、冷沉淀和凝血因子是目前恢復止血平衡的標準護理[14],然而,對于心肺儲備能力有限的幼兒,往往無法耐受短時間內大量輸入血制品[15]。本研究中,在出血量較大的COA矯治術、ASO和IAA矯治術三種復雜性手術過程中,序貫性輸注血小板、冷沉淀或纖維蛋白原,術后注意體溫管理,維持核心溫度不低于36℃,結果顯示術后胸引量明顯低于非序貫療法的患兒,三種手術分別比較也有相似的結果,故充分說明序貫療法能顯著降低COA矯治術、ASO和IAA矯治術患兒的術后出血量、改善患兒凝血功能,且不會在短時間內造成較大的容量負擔。
近年來,目標導向灌注的概念逐漸引入兒科CPB中,有研究已證實目標導向灌注在減少心臟手術相關急性腎損傷的發生率方面是有效的[16]。本團隊微小化CPB策略中實施了目標導向灌注,通過監測腦氧飽和度、混合靜脈氧飽和度、有創動脈血壓和乳酸等指標,為每個患者制定個性化的CPB策略[17]。然而,目前目標導向灌注的概念僅用于CPB的操作、監測與管理過程中,并未具體評價目標導向灌注對患兒各器官功能的影響及術后康復的作用。
綜上所述,本中心新生兒微小化CPB策略主要包括縮短CPB管路、選擇性不使用超濾、體溫管理、目標導向灌注及序貫療法。微小化CPB策略可以減少臨床用血、縮短ICU時長、不延長術后機械通氣時長和住院時長,且序貫療法可以顯著降低復雜心臟手術患兒術后出血量,改善臨床結局。期待目標導向灌注對新生兒術后康復作用的評價研究,從而為每個新生兒實現真正的個性化CPB管理。

