小兒體外膜氧合期間重度血小板減少與不良預后相關
李藝萱,靳 雨,胡金曉,童媛媛,國勝文,柏利婷,張沛瑤,高 鵬,劉晉萍
血小板是一種具有釋放、收縮、聚集、黏附功能的血液有形成分,主要參與機體凝血、調節血栓形成、參與炎癥反應以及介導免疫調控,持續且嚴重的血小板減少反映嚴重的循環失衡[1]。
體外膜氧合(extracorporeal membrane oxygenation,ECMO)是一種重要的體外生命支持手段,通過動力泵將血液泵入氧合器,將經氧合的動脈血回輸,由于在該過程中存在泵剪切力、異物接觸、血小板活化、炎癥和凝血級聯活化等多方面因素,血小板不可避免地被破壞[2]。一篇針對多項研究的Meta分析指出,血小板減少是ECMO輔助治療期間的一種常見現象,平均發生率約21%[3];同時,Griffin等[4]提出機械輔助治療后血小板減少是不良預后事件發生的獨立危險因素;Fatih Bolat等人也發現:不同程度的血小板減少與不良預后的發生有著顯著相關性:輕度、中度、重度和極重度血小板減少發生時,各組的死亡率分別為3.1%、4.7%、18.2%和42.9%,血小板計數未及時恢復的患者死亡率更高[5]。因此,了解ECMO輔助治療期間血小板減少的發展規律,有助于預測患者的預后情況。
本研究主要探討先天性心臟病患兒ECMO輔助治療期間血小板計數的變化規律以及重度血小板減少與不良預后事件發生的相關性。
1 資料與方法
1.1 研究對象與分組回顧性研究2010年1月到2018年12月期間中國醫學科學院阜外醫院接受ECMO輔助治療的76例先天性心臟病術后患兒(≤6歲)臨床資料。結合我國臨床實際情況,血小板計數<100×109/L稱為血小板減少,其中(50~100)×109/L為輕度血小板減少,<50×109/L為重度血小板減少[6-7]。本研究根據ECMO輔助治療期間的中位數血小板計數進行分組(中位數血小板為每日測得血小板計數中的最低值的中位數):重度血小板減少組(ST組,n=25,中位數血小板計數<50×109/L)和非重度血小板減少組(非ST組,n=51,中位數血小板計數≥50×109/L)。
1.2 臨床資料采集與定義收集研究對象的一般資料、ECMO期間相關血小板計數、血制品輸注以及預后情況。根據4Ts評分以及免疫學檢查排除肝素誘導的血小板減少癥。不良預后包括出血、溶血、血栓形成、急性腎損傷、術后感染以及院內死亡。出血是指臨床手術部位或插管部位出血、消化道出血、肺出血和顱內出血,常需進行再次探查手術;血栓形成表現為肢體缺血、心內血栓、肺栓塞、顱內梗死或其他部位血栓栓塞;溶血的診斷標準為血漿游離血紅蛋白>500 mg/L;急性腎損傷指KDIGO(改善全球腎臟病預后組織)標準的3期腎損傷[8];感染需通過血培養、痰培養或病毒核酸檢測證實。
1.3 ECMO安裝及管理患兒均在開胸直視下通過右心房-升主動脈插管。ECMO系統預充復方電解質平衡液,根據需要添加20%人血清白蛋白、濃縮紅細胞、新鮮冰凍血漿、5%NaHCO3和500~1 000 U普通肝素。ECMO系統包括離心泵(Rotaflow,德國),膜肺為Hilite 800/2400 Lillit(Medos,德國),管道套包(惠普公司,北京)。初始流量一般設置為80~120 ml/(kg·min)。
ECMO安裝后持續監測患兒心電圖、經皮血氧飽和度、有創動脈壓以及中心靜脈壓等血流動力學指標。ECMO期間每日晨常規檢測血常規、血生化及凝血全項,ECMO系統每小時檢查一次,查看是否有血栓形成和血漿泄漏等機械并發癥,如有必要及時更換。普通肝素抗凝劑量維持活化凝血時間(activated clotting time,ACT)在160~200 s、活化部分凝血活酶時間(activated partial thromboplastin time,APTT)在50~70 s,每3 h檢測一次ACT和APTT。出血風險高的患者應及時給予人凝血酶原復合物和人纖維蛋白原,輸注新鮮冰凍血漿補充凝血因子,輸注懸浮紅細胞維持紅細胞壓積(hematocrit,HCT)在0.30以上,每12 h檢測一次血小板計數,當血小板計數低于50×109/L時輸注血小板。
根據心功能恢復情況緩慢降低流量輔助并增加正性肌力藥物支持,當流量降低至血流量的10%~25%,且超聲提示心臟搏動有力,即可考慮撤除ECMO。
1.4 統計學分析本研究采用SPSS 21統計軟件進行統計學分析。正態分布的計量資料以均數±標準差(±s)表示并進行t檢驗,分類變量用n(%)表示,卡方檢驗或Fisher精確檢驗進行分析,單因素Logistic回歸分析重度血小板減少與不良預后發生風險。P<0.05為差異有統計學意義。
2 結 果
2.1 基線資料本研究納入76例患兒,ST組25例,非ST組51例,兩組患者一般資料無統計學差異,具有可比性,見表1。
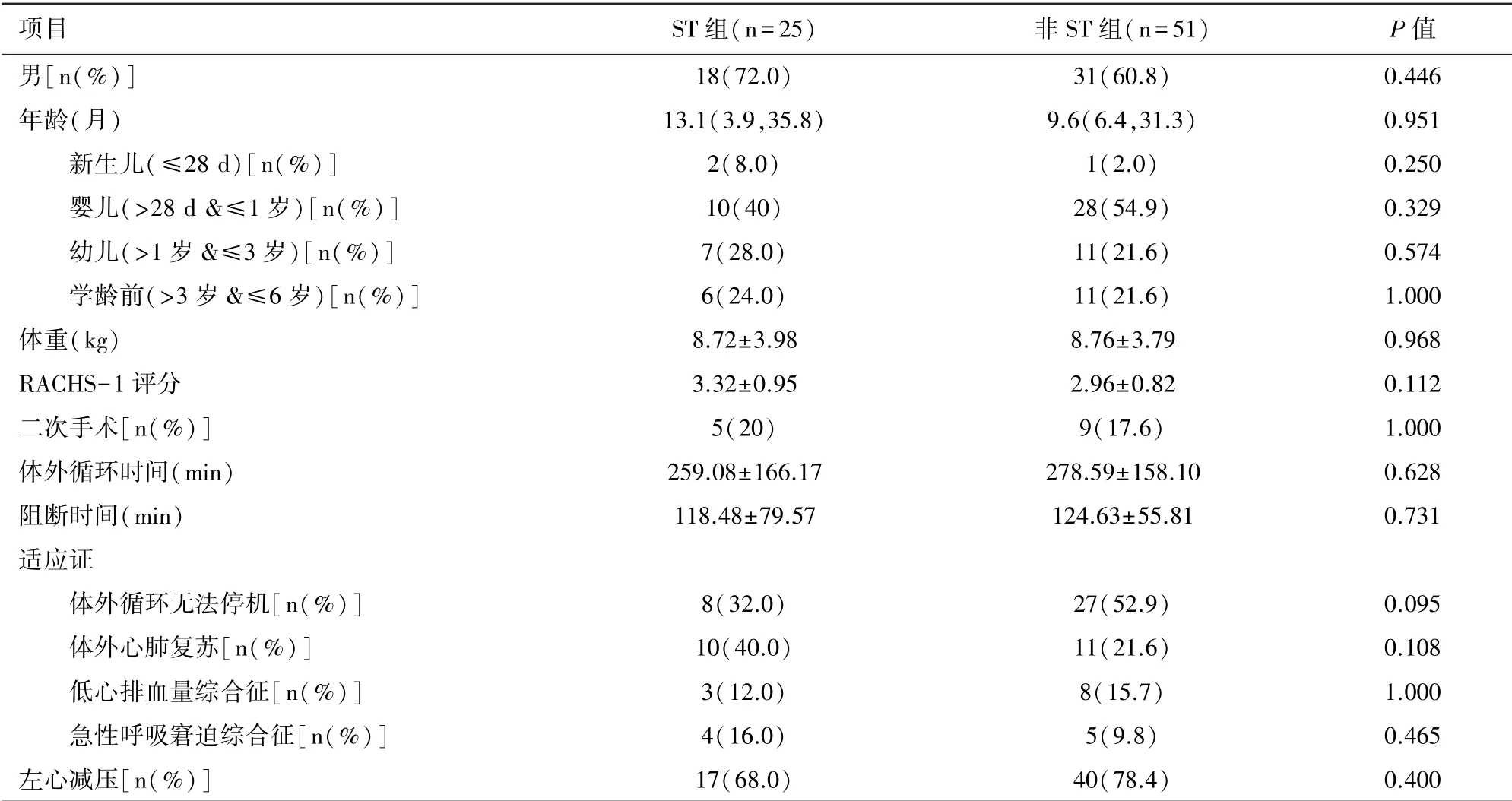
表1 患者臨床一般資料比較
2.2 ECMO輔助期間血小板相關指標的變化分析ECMO運行期間兩組血小板均會減少,兩組初始血小板計數差異無統計學意義,中位數血小板計數以及撤機時血小板計數有統計學意義,見表2。
2.3 ECMO輔助期間兩組患兒血制品輸注情況在ECMO輔助治療期間,ST組的血制品總輸注量、懸浮紅細胞、新鮮冰凍血漿及血小板的輸注量更多;ST組人凝血酶原復合物、人纖維蛋白原的輸注率高于非ST組。見表2。
2.4 重度血小板減少對不良預后的影響ST組出血、溶血、院內死亡發生率更高,見表2。出血部位情況:ST組手術及插管部位出血21例、胃腸道出血4例、肺出血2例、腦出血1例;非ST組手術和插管部位出血29例、胃腸道出血3例、肺出血4例。單因素Logistic分析不良預后的影響因素得出ST組的患兒發生出血、院內死亡的風險更大。見表3。
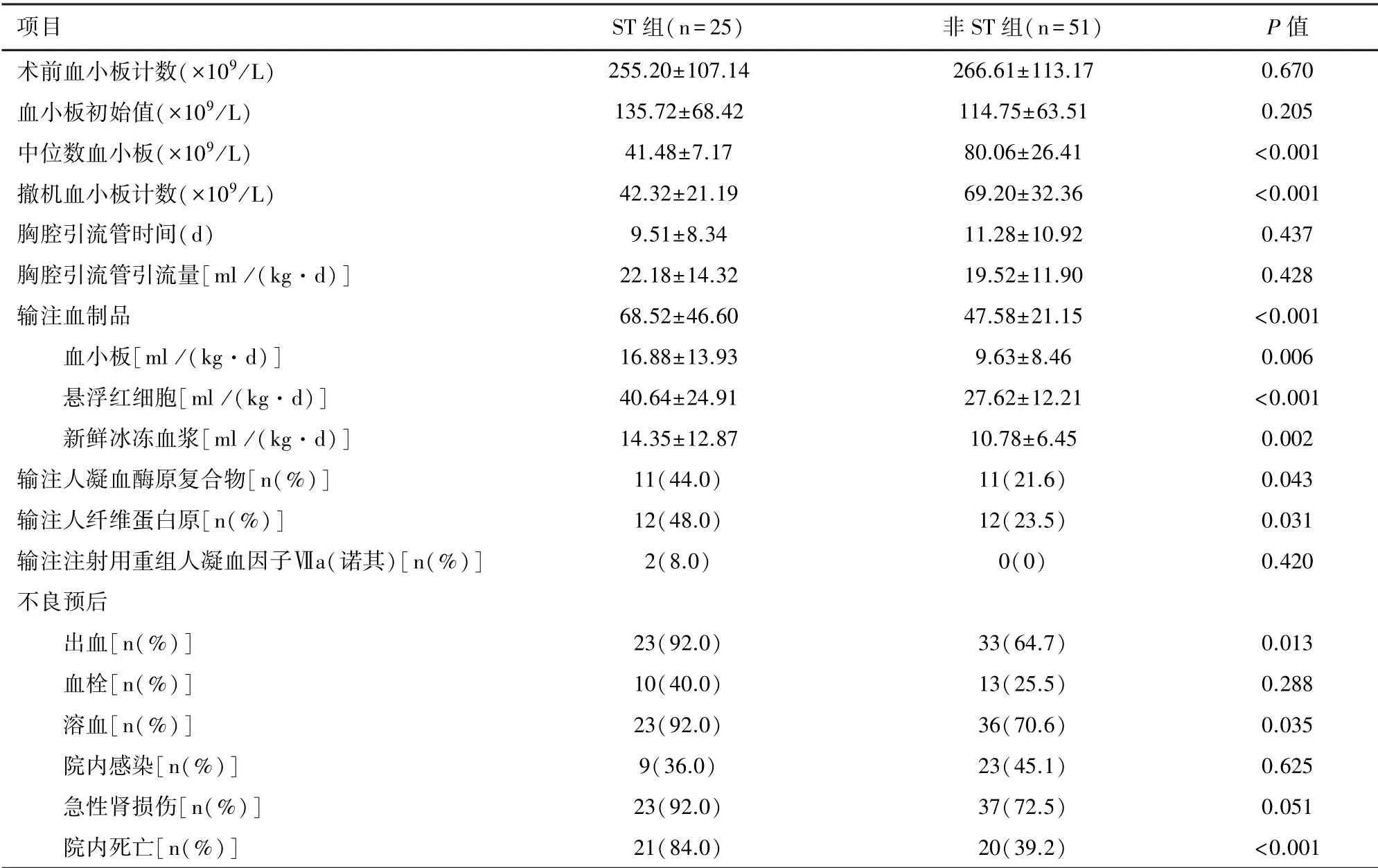
表2 ECMO期間兩組血小板變化、血制品輸注及不良預后比較
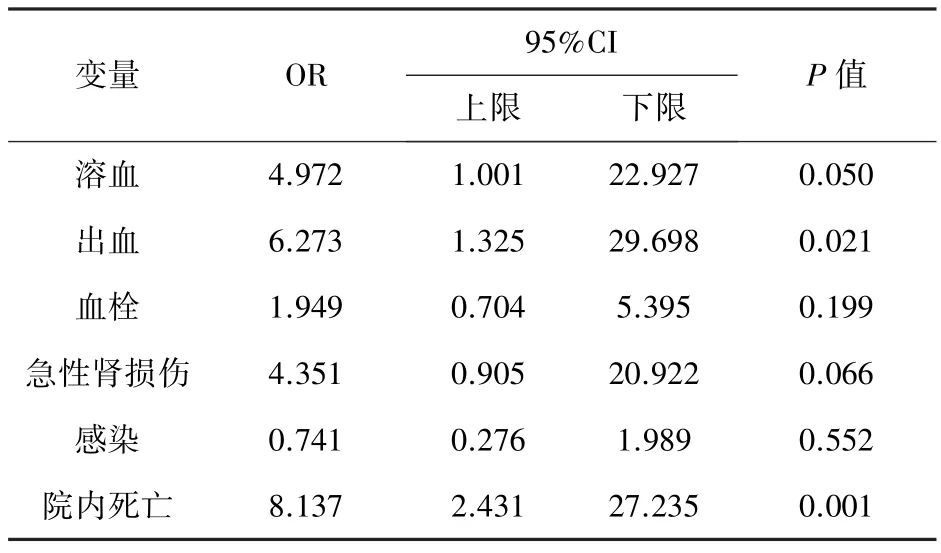
表3 重度血小板減少對不良預后的影響
3 討 論
本研究中,所有患兒血小板計數在ECMO輔助治療初期即會發生不同程度下降。直至ECMO輔助治療的中后期階段,ST組血小板計數下降趨勢較非ST組更加明顯(P<0.001)。有文獻報道能夠支持解釋該現象:ECMO輔助治療前的血小板計數通常顯著高于ECMO運行期間的血小板計數[9-10]。血小板在ECMO運行期間長時間遭受非生理性接觸、機械破壞、炎癥和血液稀釋[11-12]。這些因素都將造成血小板計數持續性減少。
本次回顧研究分析得出,ST組患兒出血事件與院內死亡的發生率更高。Dalton在一項前瞻性隊列研究中發現,在ECMO支持期間,出血事件的發生率很高,514名接受ECMO治療的患者中,有70.2%的受試者發生了出血相關并發癥,死亡率高達45.1%[13]。Opfermann等發現血小板減少是接受ECMO輔助患者不良預后的獨立危險因素,且減少程度越嚴重,患者90天死亡率越高[14]。Aubron等人提出:院內死亡率與血小板輸注量獨立相關,死亡患者常常伴有更嚴重的血小板減少,同時血小板減少持續的時間更長[15]。在這些過程中,血小板減少和出凝血紊亂之間的影響是雙向的,它們會互相促進彼此進展:在生理條件下,血小板的邊緣化依賴于血液的層流,而機械輔助裝置產生的湍流打破了血管內生理狀態,血小板不再聚集于血管內皮邊緣,改變血管內血小板正常的形態和功能,從而造成血小板止血能力降低,繼而啟動凝血機制更加消耗血小板,血小板進行性減少引發嚴重出血事件發生,使患者病情進一步加重甚至死亡[16-17]。
本研究發現,ST組患兒的血制品需求量以及促凝藥物的輸注量更大。本研究的結論與Tauber等的結論相似,在ECMO輔助治療期間患者血小板計數普遍減少且治療期間患者輸血需求明顯增加[9]。主要原因可能是重度血小板減少往往伴隨出血事件高發生風險、出血過程中凝血因子以及血容量的丟失,出凝血功能嚴重紊亂、使得病情更加危重。解決出血首先要避免血液繼續丟失。因此在出血過程中人凝血酶原復合物、人纖維蛋白原作為促凝止血藥物使用量更大。止血后應當及時補充丟失的血液成分,保證血容量,補充凝血因子改善自身出凝血功能障礙。輸注血小板通常為了預防并治療血小板減少;輸注懸浮紅細胞能夠增加有效血容量、改善機體攜氧功能;新鮮冰凍血漿用于糾正失血或大量輸血造成的多種凝血因子缺乏,改善凝血功能紊亂。因此,出血更多則意味著輸入的血小板、懸浮紅細胞以及新鮮冰凍血漿也更多。
本研究為回顧性研究,存在一定局限性:未能深入研究血小板減少、輸注血制品等可能伴有相關凝血指標的變化結果;醫學研究的ECMO標準存在不同,這可能會限制本研究結果的普適性。
綜上所述,患兒接受ECMO輔助治療期間血小板會顯著減少,重度血小板減少的患兒發生出血及院內死亡不良預后的風險更大。同時,血制品和止血藥物的需求量更多。因此,ECMO期間對患兒進行定期血小板計數監測,對早期識別血小板下降程度和保護血小板對降低不良預后發生風險具有重要意義。

