慢性頸內動脈長節段閉塞殘端形態與原位開通效果研究
蔡棟陽,楊博文,趙同源,許崗勤,薛絳宇,李天曉
慢性頸動脈閉塞是引起缺血性卒中的常見原因之一,存在嚴重血流動力學障礙的患者,即使經過積極的藥物治療,年卒中復發率仍有10%[1]。頸動脈閉塞外科研究(carotid occlusion surgery study,COSS)證實顱內外搭橋對于缺血性卒中的效果并不優于藥物治療[2],部分研究認為血管內原位開通閉塞血管可行性好、安全性高[3-4],短節段的局限閉塞可采取單純頸動脈內膜切除術或單純血管內介入治療,但長節段閉塞的原位開通技術仍存在挑戰[5-7]。有效的術前評估可幫助篩選合適的病例,本文通過分析頸動脈閉塞近端殘端形態預測頸動脈閉塞原位開通的結果,期望為臨床治療方案的決策提供參考。
1 對象與方法
1.1 研究對象 回顧性分析河南省人民醫院腦血管病科2015年3月-2018年10月完成的慢性頸內動脈長節段閉塞原位開通患者的病歷資料。納入標準:①頸內動脈閉塞,同側大腦中動脈管腔通暢;②閉塞時間超過3周;③有頸動脈閉塞相關的缺血性卒中表現;④閉塞節段從頸內起始向上,超過兩個頸內動脈解剖節段(Bouthillier 1996頸內動脈分段分型[8]),術前灌注成像(PWI、CTP)提示達峰時間升高、平均通過時間升高、腦血流量下降。
1.2 分組及數據采集
1.2.1 資料收集 從電子病歷系統及醫院影像數據庫中收集患者的資料,包括患者一般資料(性別、年齡、高血壓、糖尿病、冠心病、既往卒中史、吸煙、術前mRS、末次事件距手術時間等)、術前影像學資料(代償情況、閉塞節段、閉塞側別)、術中影像學、手術記錄(手術方式、剝離斑塊的情況、術中并發癥)、術后復查影像學資料(超聲、CTA、DSA,主要觀察指標:再閉塞)、術后患者并發癥情況。
1.2.2 頸動脈閉塞殘端分型 根據術前DSA頸內動脈閉塞近端殘端形態將患者分為有殘端組(有明顯錐形殘端,殘端管壁相對光滑)和無殘端組(無殘端,或僅有線樣不規則殘端或淺鈍殘端)兩組(圖1)。
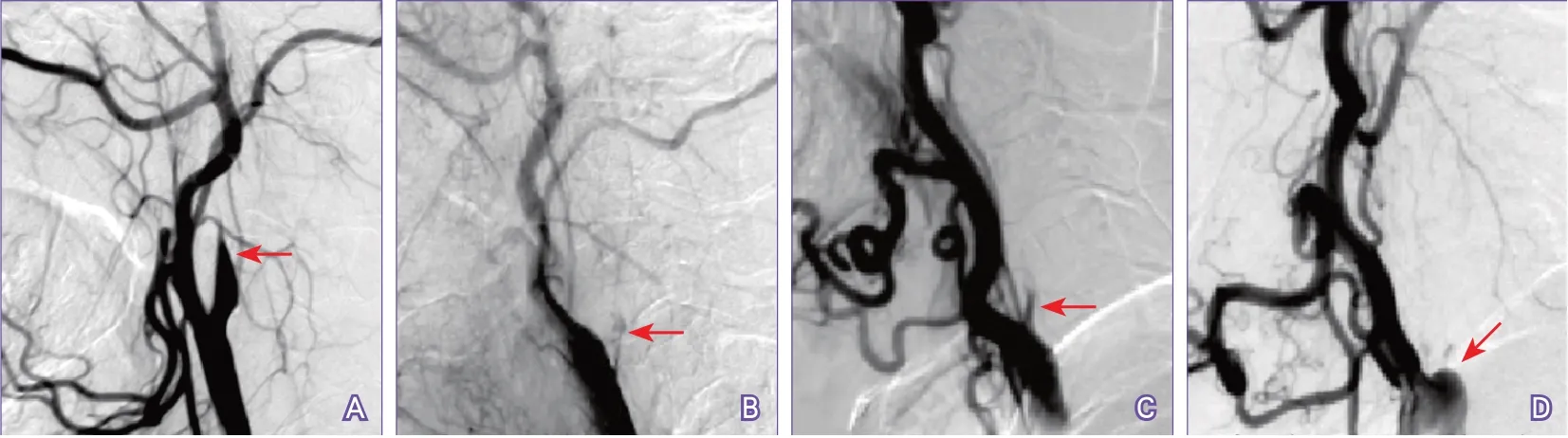
圖1 頸內動脈閉塞近端殘端形態DSA檢查
1.2.3 重點觀察指標定義 ①再通成功:指閉塞的頸內動脈恢復正向血流。②并發癥:指所有與手術操作相關的不良事件,包括神經系統并發癥和非神經系統并發癥。神經系統并發癥主要包括術中血栓移位、術中導絲損傷顱內血管導致顱內出血、醫源性動靜脈瘺、術后高灌注出血、術后支架內血栓形成;非神經系統并發癥包括心血管事件和頸部切口并發癥如術中顱神經損傷、術后頸部急性血腫形成。③再閉塞:指開通成功的頸內動脈再次發生原位閉塞。
1.3 手術治療及隨訪
1.3.1 術前評估 所有患者術前均行頭顱MRI、灌注成像(PWI或CTP)、頭頸部CTA及DSA檢查,明確缺血性梗死灶的分布、血流動力學狀態、閉塞節段,結合頸動脈超聲分析頸動脈閉塞起始段管腔內情況,推測閉塞起因。
1.3.2 單純血管內介入治療 將指引導管置于患側頸總動脈,微導絲配合微導管通過頸內動脈閉塞段,到達閉塞遠端后,微導管造影證實位于真腔內,交換300 cm微導絲。選用小球囊由遠及近擴張,擴張后頸段引入頸動脈支架,將指引導管跟進至頸動脈支架內。根據血管條件選擇不同類型支架,若血管迂曲嚴重選擇自膨式顱內支架,若血管較平順則選擇球擴式支架。由閉塞遠端向近端依次置入,要求支架兩端盡可能完全接頭,完全覆蓋管壁不光滑處。
1.3.3 復合手術 將患側頸總動脈切開,取出頸內動脈閉塞起始部位管腔內斑塊或血栓,使用forgaty取栓球囊導管在X線透視下嘗試取出頸內動脈巖骨段以下的血栓,取栓后觀察血液反流情況,縫合頸動脈及頸部切口。經股動脈穿刺將指引導管置于頸總動脈,造影觀察頸內動脈有無正向血流:若無正向血流,微導絲配合微導管嘗試通過閉塞段,通過后按照“1.3.2單純血管內介入治療”的操作進行;若有正向血流,可根據血管腔內情況選擇是否置入支架,若管腔內壁光滑,可暫停介入治療,若管腔內壁不光滑,應將不光滑處全部貼入支架。
1.3.4 圍手術期管理 術前常規進行雙抗治療:阿司匹林100 mg/d、氯吡格雷75 mg/d,口服超過7 d。術后繼續雙抗治療半年,服用劑量同術前,之后長期單抗(阿司匹林100 mg/d)治療。
1.3.5 隨訪 對于再通成功的患者,要求其術后3 d復查頸動脈超聲或頭頸部CTA,術后半年復查頭頸部CTA或DSA,之后每年復查頸動脈超聲。
1.4 統計學方法 使用SPSS 20.0(IBM Corp.US)統計軟件處理數據。呈正態分布的定量資料用表示,組間比較采用獨立樣本t檢驗,呈非正態分布的定量資料采用M(P25~P75)表示,組間比較采用Wilcoxon秩和檢驗;定性資料用例數(%)表示,組間比較采用χ2檢驗、連續性校正的χ2檢驗或Fisher確切概率法。以P<0.05為差異有統計學意義。
2 結果
2.1 一般資料 共納入48例患者,其中有殘端組22例、無殘端組26例,男性45例、女性3例,平均年齡55.7±8.8歲。兩組性別、年齡、高血壓患者比例、糖尿病患者比例、冠心病患者比例、既往卒中史患者比例、吸煙患者比例、術前閉塞節段、隨訪時間、末次事件距手術時間、術前mRS 1~3分構成比例、代償情況、閉塞側別比較,差異均無統計學意義(表1)。
2.2 圍手術期情況 兩組共41例(85.4%)開通成功,有殘端組6例開通失敗,無殘端組1例開通失敗,有殘端組開通技術成功率為72.7%(16/22),低于無殘端組的96.2%(25/26),差異有統計學意義(表1)。
共4例(4/48,8.3%)出現并發癥,有殘端組3例(13.6%)出現并發癥,其中1例術中血栓移位導致大腦中動脈完全閉塞,術中取栓不成功,術后大面積腦梗死,患者死亡;1例術中頸動脈切開患者術后出現喉頭水腫,引起窒息,進行氣管切開;1例開通失敗患者,因術中低血壓導致術后梗死面積擴大;無殘端組1例(3.8%)出現圍手術期并發癥,為術中出現海綿竇區動靜脈瘺,術后1個月瘺口流量變大引起突眼、耳鳴,進行了二次動靜脈瘺栓塞。兩組并發癥發生率差異無統計學意義(表1)。
共25例采取復合手術(頸動脈內膜切除術+血管內介入治療)的方式開通:有殘端組共有11例采用復合手術開通,所有病例管腔閉塞均以血栓為主;無殘端組14例采用了復合手術開通,其中13例(92.9%)管腔閉塞以斑塊為主。
2.3 隨訪結果 再通成功的41例患者均進行了彩超、CTA、DSA復查,中位隨訪時間6(4~10)個月,再閉塞5例(5/41,12.2%)。有殘端組16例復查患者中4例(25.0%)出現再閉塞,其中2例術后3 d復查(1例超聲檢查、1例CTA)發現,2例術后半年復查(CTA)發現;無殘端組25例復查患者中1例(4.0%)在半年復查(CTA)時發現再閉塞。有殘端組再閉塞率[25.0%(4/16)]明顯高于無殘端組[4.0%(1/25)],差異有統計學意義(表1)。
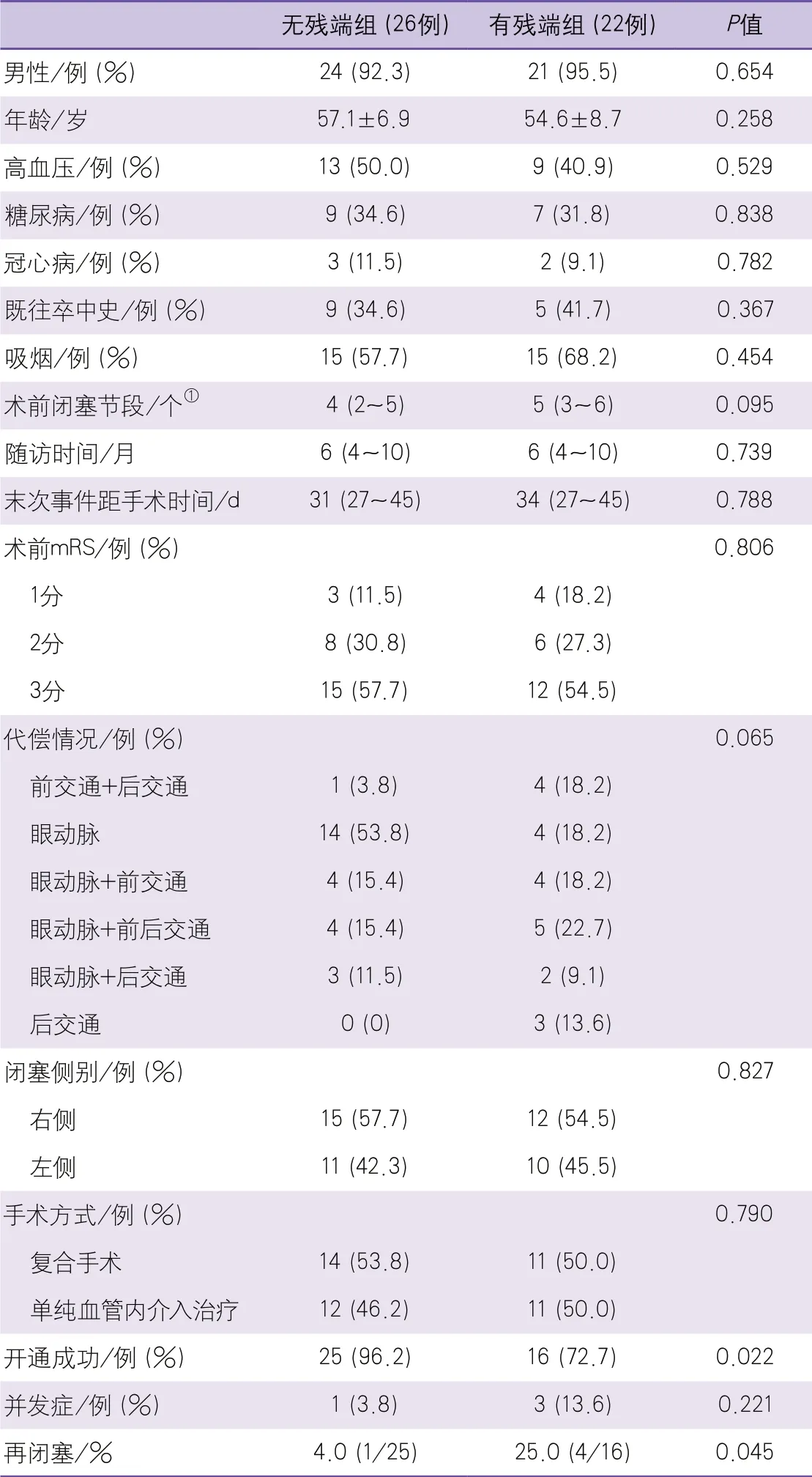
表1 兩組慢性頸內動脈長節段閉塞患者一般資料及手術結果
3 討論
對于累及一個解剖節段的單純的頸內動脈起始段閉塞,單純血管內治療或單純頸動脈內膜切除術成功率高、安全性好[9],而單純的頸內動脈顱內段閉塞只能采取血管內治療,研究顯示有較好的臨床效果[10]。累及兩個及以上解剖節段的相對長節段的慢性頸內動脈閉塞原位再通治療仍然充滿挑戰,閉塞節段長,單純頸動脈內膜切除術難以實現一次復流,單純血管內介入治療對部分病例而言再通技術成功率低,頸動脈內膜切除聯合血管內治療的復合手術可能提高開通率[11]。如何選擇合適的病例及治療方式仍存在爭議,有效的術前評估可能對臨床決策的制訂提供幫助。
現有的術前評估方式很多,多數研究認為閉塞節段越長開通成功率越低、再閉塞率越高,閉塞近端殘端明顯的病例更容易成功[4-11];而本中心的經驗與其他研究不同,閉塞近端殘端是明顯的錐形殘端的病例相比無殘端、線樣殘端、淺鈍殘端的病例更易開通失敗、遠期再閉塞風險更高,可能的原因是有明顯錐形殘端的病例原始閉塞點更可能是頸動脈起始段以上的病變,如頸動脈夾層、巖骨段/海綿竇段/床突段動脈硬化,原始閉塞點的近端和遠端可能是繼發的陳舊血栓,而無殘端、線樣殘端、淺鈍殘端的病例原始閉塞點可能是頸內動脈起始段的斑塊,閉塞點遠端管腔內可能是繼發的陳舊血栓。本研究頸動脈切開病例的管腔閉塞病因結果也驗證了這一推測。有殘端組頸動脈切開病例的管腔內均為陳舊血栓性質,而無殘端組頸動脈切開病例管腔內以斑塊為主,說明頸動脈殘端形態可以比較有效地預測頸動脈閉塞起始段的病因。
對于有錐形殘端的病例,頸動脈起始段可能沒有斑塊,管腔內可能是陳舊血栓性質,切開頸動脈似乎對整體的再通手術意義不大,因為切開后僅僅取出繼發的少部分陳舊血栓,并不能有效提高再通率,因此,這些病例更應考慮單純血管內介入治療,但是這些原始閉塞點位于上段的病例,病因往往不清楚,導絲通過過程中更易進入夾層,而一旦進入夾層,導絲頭想要找回真腔將會很困難,這些病例易因為找不到真腔而導致再通失敗,或是從夾層中實現血管再通,可能遠期易再閉塞。對于無錐形殘端的病例,頸動脈起始閉塞段管腔內可能以斑塊為主,一般推測原始閉塞點位于頸動脈起始段,這些病例行頸動脈切開術在直接取出斑塊的同時可拉出部分遠端繼發血栓,從而有效提高開通效率,據此推斷此類病例更適合以復合手術的方式進行開通,遠期也相對不易再閉塞。
總之,通過殘端形態可評估慢性頸內動脈長節段閉塞原位開通的效果,為手術方案的制訂提供依據。但本組病例數較少,憑殘端形態推測頸動脈病變性質的基礎上,通常臨床還應結合頸動脈超聲檢查、患者其他病史及動脈硬化危險因素等進行綜合評估,以提高判斷的準確性。
【點睛】慢性頸內動脈長節段閉塞的再通治療存在挑戰,有效的術前評估可幫助篩選合適的病例、選擇合適的手術方式。本研究顯示,頸動脈閉塞近端殘端形態可有效預測頸動脈閉塞起始段的病因,錐形殘端閉塞起始段以血栓為主,更應考慮單純血管內介入治療。

