基于Nrf2/ARE信號通路探討白藜蘆醇治療非酒精性脂肪性肝炎大鼠的作用機制
馮成軍, 周艷萌, 田應娟
1.遵義醫科大學第三附屬醫院感染科,貴州 遵義 563000; 2.遵義醫科大學微生物學與免疫學實驗室,貴州 遵義 563000; 3.遵義市播州區中醫院B超科,貴州 遵義 563000
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)是最常見的肝病之一,高發于高熱量飲食人群,全世界患病率約25%[1,2]。NASH是由過多的甘油三酯(triglycerides,TG)誘導累積導致肝脂肪變性,繼而發展為非酒精性脂肪性肝炎,最后導致肝硬化甚至肝癌[3,4]。目前為止,尚無有效的治療非酒精性脂肪性肝炎的方法。從脂質積累分子機制來看,氧化應激可能會引起脂肪變性。抗氧化劑可調節脂肪生成、脂質氧化和過氧化以及炎癥,氧化環境的改善可能改善肝損傷和纖維化,從而降低脂肪肝風險[5]。因此抗氧化可能成為一種有前景的治療方法。白藜蘆醇(resveratrol,RSV)是一種天然多酚,提取自葡萄、漿果和紅酒,具有抗氧化作用[6],可控制能量代謝。白藜蘆醇通過熱量限制,激活關鍵的代謝調節通路,如AMP活化激酶(AMP-activated protein kinase,AMPK)[7]、核 因 子 紅 系 衍 生 樣2(nuclear factor erythroid 2-related factor 2,Nrf2)[8]。Nrf2是調節細胞氧化應激反應的重要轉錄因子,也是維持細胞內源性氧化還原穩態的調節因子。Nrf2可降低活性氧和親電體對細胞的損傷,誘導抗氧化應激酶,使細胞保持穩定狀態。Nrf2在細胞質通過與其負性調節因子Kelch樣ECH結合蛋白1(kelch-like ECH-associated protein 1,Keap1)結合,促進Nrf2泛素化。在活性氧作用下,Nrf2以Keap1-Nrf2復合物的形式從細胞質轉移到細胞核,然后與抗氧化反應元件(antioxidant response element,ARE)結合。該復合物激活多種解毒劑和抗氧化劑酶基因的表達,如醌氧化還原酶1(NADPH quinone oxidoreductase 1,NQO1)、血紅素加氧酶1(heme oxygenase-1,HO-1),保護細胞免受氧化壓力以及其他毒素危害[9]。最近的數據表明,Nrf2/ARE途徑在抗氧化和凋亡損傷的保護作用中起著核心作用[10]。本實驗主要基于Nrf2/ARE信號通路探討白藜蘆醇治療非酒精性脂肪性肝炎大鼠的作用機制。
1 材料與方法
1.1 實驗材料
1.1.1 主要試劑 RSV(純度>98%)購自美國Sigma公司;OAD85(Nrf2/ARE抑制劑齊墩果酸衍生物)由云南民族大學云南民族大學-香港浸會大學傳統天然藥物研發聯合實驗室惠贈;HE試劑盒購自北京索萊寶科技公司。 丙氨酸氨基轉移酶(alanine aminotransferase,ALT)、天門冬氨酸氨基轉移酶(aspartate aminotransferase,AST)、膽 固 醇(total cholesterol,TC)、甘油三酯(TG)、高密度脂蛋白(high density lipoprotein cholesterol,HDL)、低密度脂蛋白(low density lipoprotein,LDL)和 游 離 脂 肪 酸(free fatty acid,FFA)試劑盒購自美國雅培公司。Keap1、Nrf2、ARE、NQO1、HO-1、GAPDH、H1兔抗鼠一抗,IgGHRP羊抗兔二抗購自美國Abcam公司。Favorgen試劑盒購自臺灣Favorgen生物科技公司。
1.1.2 實驗動物 雄性SD大鼠(體重200~260 g),購自北京華阜康生物科技有限公司,生產許可證號:SCXK(京)2016-0041。大鼠保持有規律的12 h光/暗循環(24±2)℃。CD飼料的能量組成含10%脂肪(可可脂4%,大豆油6%),20%蛋白質以及70%碳水化合物。HCD飼料的能量來自65%脂肪(可可脂59%和大豆油6%),20%蛋白質,10%碳水化合物,2%膽固醇,0.5%膽酸鹽等。
1.2 實驗方法
1.2.1 動物分組及模型構建 雄性SD大鼠32只,適應性飼養1周后,取8只繼續喂養普通飼料作為CD組,其他采用高脂飲食法構建大鼠NASH模型[11]。實驗第4周末從高脂造模動物中隨機抽取2只大鼠處死取其肝行肝組織病理學診斷,有明顯脂肪肝改變視為造模成功,并隨機分為高脂飲食組(HCD)、白藜蘆醇組(HCD+RSV)及(白藜蘆醇+OAD85)組(HCD+RSV+OAD85),每組取6只。各組大鼠干預情況如下:(HCD+RSV)組及(HCD+RSV+OAD85)組在喂養第4周灌胃給予10 mg/kg RSV或10 mg/kg RSV+100μg/kg OAD85[12,13],灌胃劑量3 ml,每日1次,連續給藥28 d,CD組和HCD組給予等量生理鹽水,觀察病理情況并測試相關評價指標。
1.2.2 肝HE染色病理學評價 取大鼠肝組織,于4%多聚甲醛溶液中固定,脫水,石蠟包埋,組織切片。進行HE染色觀察肝組織病理學改變。脂肪變性程度主要觀察肝含脂肪面積的百分比。肝組織學參數分級按照非酒精性脂肪性肝炎臨床研究網絡NAFLD活動評分。脂肪變性分級(0級,<5%受影響;1級,5%~33%;2級,34%~66%;3級,66%以上);小葉炎性活動(0~3級)和腫脹程度(0~2級);門靜脈炎癥分級為(0,無;1,輕度;2,中度;3,嚴重)。NASH總分采用非酒精性脂肪性肝炎臨床研究評分,是脂肪變性(0~3)、小葉炎癥(0~3)和腫脹(0~2)得分的未加權總和[14]。
1.2.3 肝組織冰凍切片油紅O染色觀察脂肪量變化冰凍切片厚5μm,用10%中性緩沖福爾馬林固定5 min,隨后進行脂質染色。脂類使用油紅O染色法檢測。1 g油紅O染料溶解于100 ml 70%乙醇/丙酮混合溶液中。切片在70%乙醇中進行適應沖洗,然后在工作溶液中培養10 min。切片在70%乙醇中進行分化,然后用HE復染進行對比。
1.2.4 血液生化指標檢測 腹主動脈取大鼠全血,4000 r/min離心10 min得到血清,利用試劑盒測試血清酶指標(ALT、AST)以及血脂水平(TC、TG、LDL、HDL和FFA),操作嚴格按照試劑盒說明進行。
1.2.5 qRT-PCR檢測mRNA表達 使用Favorgen試劑盒分離肝組織總RNA,測試RNA純度。將其逆轉成cDNA,進行實時定量PCR。反應條件:95℃預變性10 min,95℃變性10 s,60℃退火15 s,72℃延伸20 s;第2步開始讀板,5 s讀板1次,共39個循環,溶解曲線65~95℃。 U6作 為 內 參(上 游 引 物 為 5′-CCTGAGCAGGAACAGCTTGA-3′,下 游 引 物 為5′-CGTACGTAGTCGAACCGAGA-3′),keap1(上游引物為5′-CCATATCGCTGGATGACGAT-3′,下游引物為5′-GTGCAGGGTCCGAGGT-3′),Nrf2(上 游 引 物 為5′-AGGACATGGATTTGATTGAC-3′,下 游 引 物 為5′-TACCTGGGAGTAGTTGGCA-3′)、ARE(上游引物為5′-GTTTCAACGAACAGTGGTA-3′,下 游 引 物 為5′-CTAGCTTGGAATGACATTG-3′)、NQO1(上游引物為5′-CCCTGCGAACTTTCAGTATCC-3′,下游引物為5′-CTTTCAGAATGGCAGGGACTC-3′)、HO-1(上游引物為5′-GGCAGCAAGGTGCAAGA-3′,下 游 引 物 為5′-GAAGGAAGCCAGCCAAGAG-3′),相對表達量用2-△△CT表示。
1.2.6 Western blot檢測Nrf2/ARE蛋白表達 從各組肝細胞中提取蛋白質。肝細胞研磨成為單細胞混懸液,在RIPA緩沖液中裂解。用BCA蛋白質分析法測定蛋白質濃度。每組上樣蛋白質含量(50μg),用10%聚丙烯酰胺凝膠電泳分離并電轉移至硝化纖維素膜。5%脫脂牛奶在室溫下封閉2 h。抗體的非特異性結合被阻斷。然后加入稀釋的一抗Keap1(1:1000),Nrf2(1:200),ARE(1:200),NQO1(1:200),HO-1(1:2000)、H1(1:1000)或GAPDH(1:2000)在4℃孵育過夜。第2 d膜在室溫下復溫1 h,加入IgGHRP二抗孵育2 h,滴加ECL發光液顯影,利用成像系統拍照,Image-J軟件定量光密度值。最后細胞質蛋白以目的蛋白與GAPDH蛋白的表達量比值作為相對表達水平,細胞核蛋白以目的蛋白與H1蛋白的表達量比值作為相對表達水平。
1.3 統計學分析
所有數據以(均數±標準差)表示。兩組間的比較采用單因素方差分析。采用Graghpad 5和SPSS進行數據分析,P<0.05代表具有統計學差異。
2 結果
2.1 肝組織HE染色病理學評價
實驗28 d后進行肝組織HE染色,結果如圖1所示。CD組顯示正常的肝組織學形態。HCD組大鼠肝組織表現出廣泛的大量的脂肪變性,最明顯的肝脂肪變性出現在3區周圍,出現微泡和少量的大泡脂肪變性,同時伴有小葉炎癥、少量的門靜脈炎癥且細胞有輕微腫脹,這也是纖維化的開始,符合NASH組織病理形態。而(HCD+RSV)組表現出較少的脂肪變性,小葉炎癥和門靜脈炎癥減輕,腫脹有一定程度的改善。NADH評分結果顯示,HCD組肝脂肪變性、小葉炎癥、門靜脈炎癥、腫脹程度評分最高(P<0.05),(HCD+RSV)組各項評分較之降低(P<0.05),(HCD+RSV+OAD85)組與HCD組類似,如表1。
表1 肝組織病理評分表(±s)Tab.1 Liver pathology score sheet(Mean±SD)
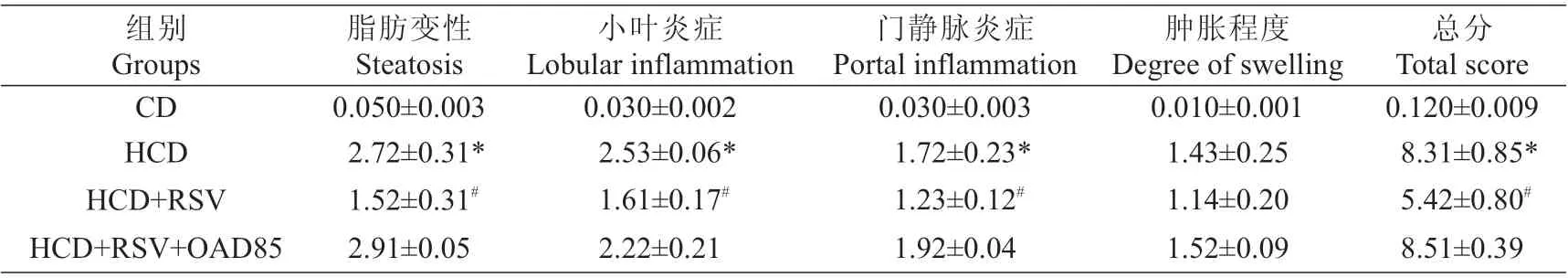
表1 肝組織病理評分表(±s)Tab.1 Liver pathology score sheet(Mean±SD)
注:*P<0.05,與CD組相比#P<0.05,與HCD組相比Note:*P<0.05 vs CD group;#P<0.05 vs HCD group
總分Total score 0.120±0.009 8.31±0.85*5.42±0.80#8.51±0.39組別Groups CD HCD HCD+RSV HCD+RSV+OAD85脂肪變性Steatosis 0.050±0.003 2.72±0.31*1.52±0.31#2.91±0.05小葉炎癥Lobular inflammation 0.030±0.002 2.53±0.06*1.61±0.17#2.22±0.21門靜脈炎癥Portal inflammation 0.030±0.003 1.72±0.23*1.23±0.12#1.92±0.04腫脹程度Degreeof swelling 0.010±0.001 1.43±0.25 1.14±0.20 1.52±0.09

圖1 肝組織HE染色Fig.1 HEstaining of liver tissue
2.2 肝組織油紅O染色觀察脂肪量變化
結果如圖2所示,CD組幾乎沒有觀察到脂肪的含量,與CD組相比,HCD組脂肪含量明顯升高(P<0.05)。與HCD組相比,(HCD+RSV)組脂肪含量明顯降低(P<0.05)。(HCD+RSV+OAD85)組與HCD組相比差異無統計學意義(P>0.05)。
2.3 血液生化指標檢測
血液生化指標檢測結果顯示(圖2~3),與CD組相比,HCD組血清中酶指標ALT、AST顯著升高(P<0.001),血脂水平TC、TG、HDL、LDL、FFA明顯升高(P<0.01),與HCD組相比,(HCD+RSV)組酶指標與血脂水平顯著下降(P<0.01)。
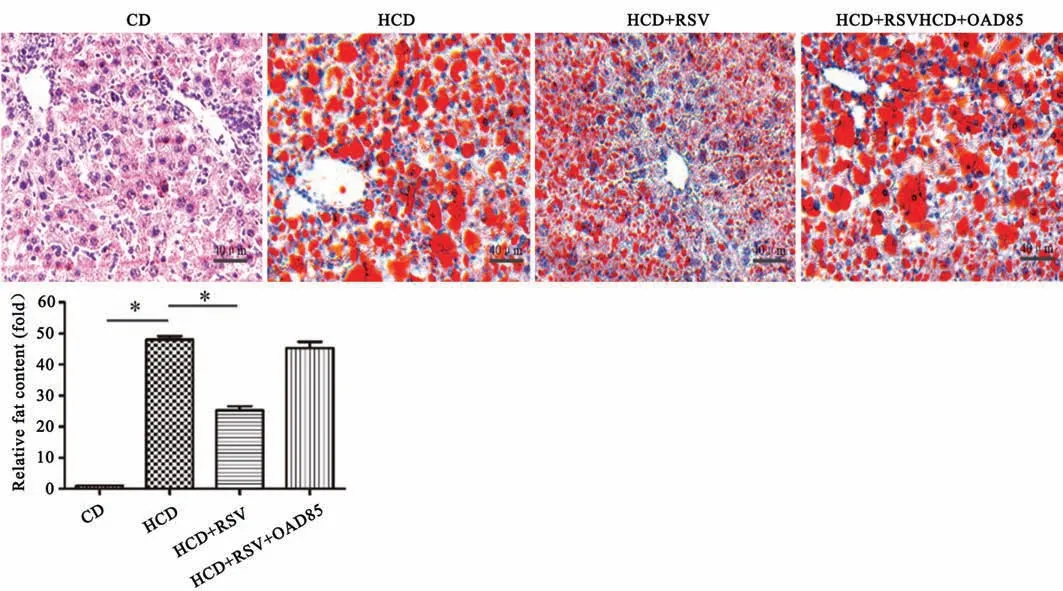
圖2 RSV對肝脂肪量的影響 *P<0.05 n=6Fig.2 Effect of RSV on liver fat mass *P<0.05;n=6
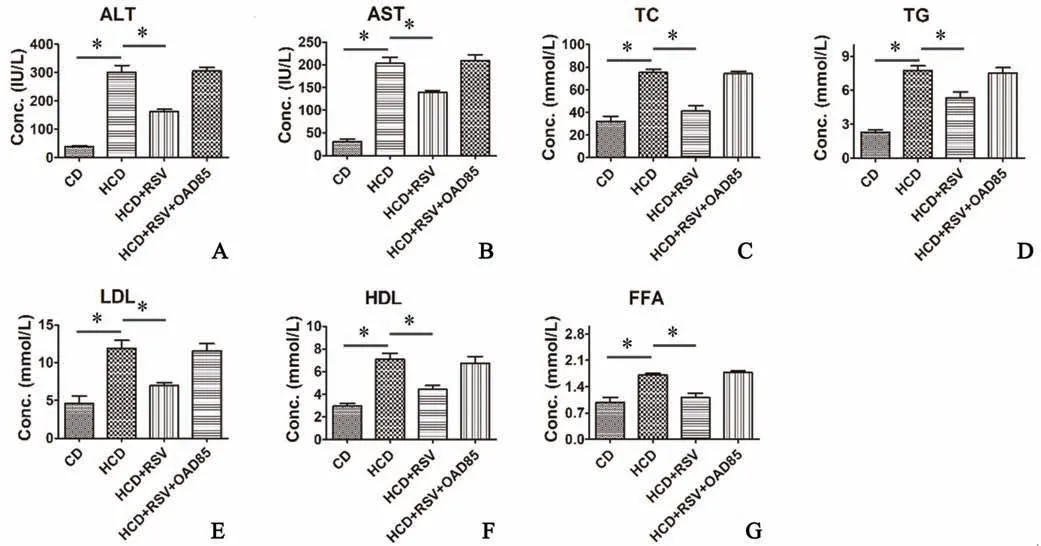
圖3 RSV對血液生化指標ALT(A),AST(B)及TC(C),TG(D),LDL(E),HDL(F),FFA(G)的影響 *P<0.05 n=6Fig.3 Effect of RSV on blood biochemical indexes ALT(A),AST(B),TC(C),TG(D),LDL(E),HDL(F)and FFA(G) *P<0.05;n=6
2.4 qRT-PCR測試mRNA表達
對Nrf2/ARE通路的mRNA檢測結果顯示(圖4),與CD組 相 比,HCD組Nrf2、ARE、NQO1、HO-1 mRNA的表達均升高(P<0.05),Keap1 mRNA明顯下降(P<0.01);與HCD組相比,(HCD+RSV)組中Nrf2、ARE、NQO1、HO-1 mRNA的表達均降低(P<0.05),Keap1 mRNA升高(P<0.05);HCD組與(HCD+RSV+OAD85)組差異無統計學意義(P>0.05)。
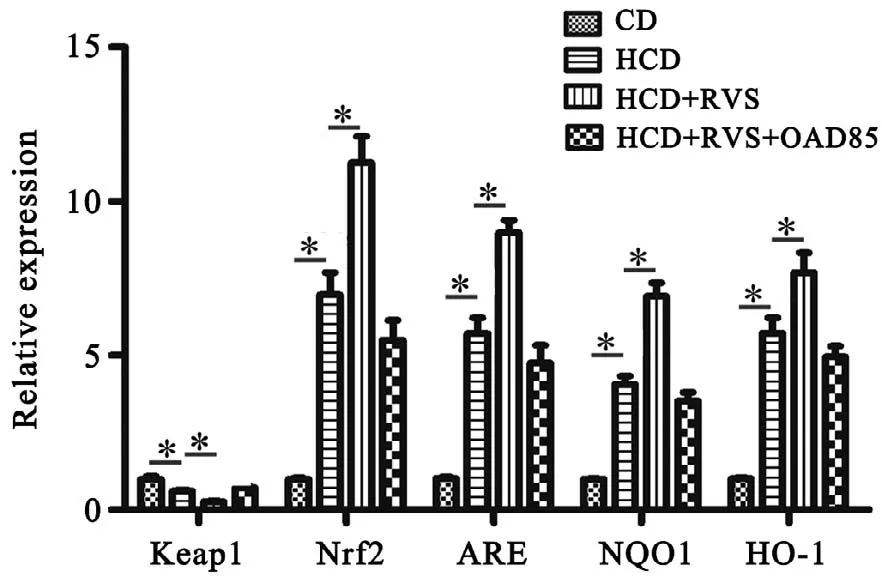
圖4 mRNA在各組的表達水平 *P<0.05 n=6Fig.4 mRNA expression levels in different groups*P<0.05 n=6
2.5 Western blot檢測Nrf2/ARE蛋白表達
Western blot檢測Nrf2/ARE蛋白表達結果發現(圖5),與CD組相比,HCD組及(HCD+RSV)組NQO1、HO-1、Nrf2、ARE蛋白表達均升高(P<0.05);與HCD組對比,(HCD+RSV)組NQO1、HO-1、Nrf2、ARE蛋白表達均增加(P<0.05),Keap1蛋白表達降低(P<0.05)。HCD組與(HCD+RSV+OAD85)組差異無統計學意義(P>0.05)。
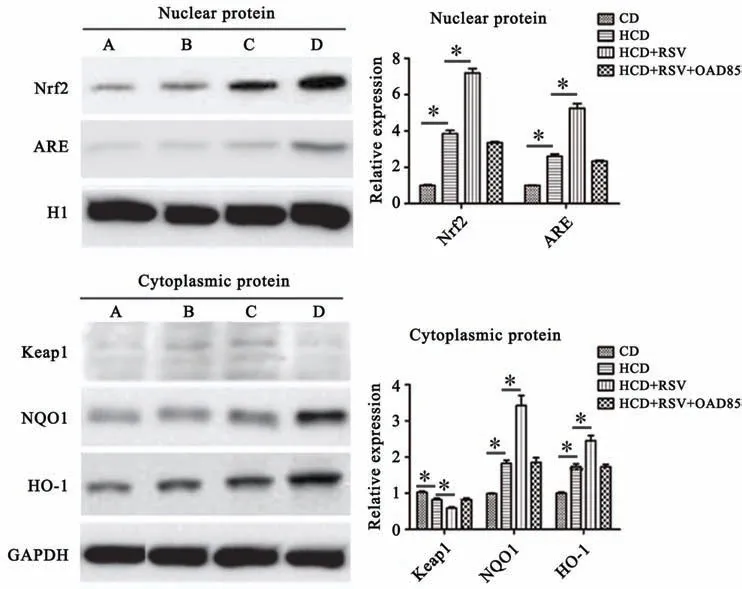
圖5 Western blot檢測各組Nrf2/ARE蛋白表達水平A:CD組B:(HCD+RSV+OAD85)組C:HCD組D:(HCD+RSV)組*P<0.05 n=6Fig.5 Protein expression levelsof Nrf2/AREin different groupsdetected by Western blot A:CD group;B:HCD+RSV+OAD85 group;C:HCD group;D:HCD+RSV group*P<0.05;n=6
3 討論
NASH是西方發達國家常見的肝病,與肥胖、糖尿病及其他代謝病密切相關。NASH的發病機制目前并不清楚,大量的脂質物質和過氧化引起的氧化應激是引起細胞損傷和肝組織炎癥加重的主要原因,氧化應激通過特異性調節Nrf2/ARE通路來影響NASH。Nrf2/ARE途徑是一種內源性抗氧化信號通路,提供細胞抵御氧化損傷的能力。Nrf2尤為重要的作用是,它能激活多種抗氧化酶(如谷胱甘肽過氧化物酶和硫氧還蛋白還原酶),來清除體內過多的氧化自由基。因此研究Nrf2/ARE通路的特異性激活對于治療NASH很有必要。NASH模型研究表明,給予大鼠以含酒精或高脂飲食,可導致其出現比相同飲食更為嚴重的肝損傷;該通路具有潛在的保護作用,可能是加強抗氧化物和解毒酶的表達,從而減少細胞脂質過氧化,減少FFA從脂肪組織中釋放及對FFA的攝取[15]。本研究表明白藜蘆醇通過Nrf2/ARE表達導致肝損傷細胞數量減少,脂肪變性顯著減少,同時有些炎癥反應被抑制。對比CD組,HCD組Nrf2明顯增加,同時在白藜蘆醇的作用下會對Nrf2顯著激活。在HCD作用下,Nrf2及相關通路指標增加的可能原因是高脂造成的細胞損傷環境誘導了氧化應激通路,從而使抗氧化物質水平升高。白藜蘆醇也顯著增加了ARE、NQO1、HO-1,說明激活了Nrf2/ARE通路,并且對下游的基因蛋白產生了誘導作用。白藜蘆醇對細胞質內Keap1的影響有少量下降的趨勢,由此可看出白藜蘆醇的作用主要體現在正向調節Nrf2/ARE通路,負向調節Keap1。OAD85會抑制Nrf2,同時油紅染色等結果發現OAD85抑制RSV的脂肪代謝,這從一個側面說明RSV的脂肪代謝與Nrf2通路有關。白藜蘆醇有很好的抗氧化作用,它通過激活Nrf2/ARE通路抑制非酒精性脂肪性肝炎。有其他研究表明,白藜蘆醇可以減弱心肌缺血再灌注損傷引起的氧化應激,可能也是因激活Nrf2/ARE保護心肌組織[16]。白藜蘆醇經Nrf2/ARE通路減輕MPTP毒性,可通過抗氧化應激來實現[17]。由此可見,白藜蘆醇通過Nrf2/ARE通路減弱氧化應激,可治療多種疾病,減少組織損傷。
本研究使用高脂飲食喂養SD鼠來模擬非酒精性脂肪性肝炎疾病的形成。臨床NASH患者往往是受肥胖、胰島素抵抗和代謝綜合征等多種因素影響,選擇高脂飲食雖不能模擬真正發病的情況,但高脂飲食后形成的肝病灶包括脂肪變性、腫脹變性、炎癥和纖維化等接近于臨床NASH的病理表現。許多研究人員使用高脂飲食造模,系統地研究了Nrf2缺乏對NASH發生發展的影響。抑制Nrf2表達會導致脂肪變性和氧化應激增加[18]。Nrf2過度激活模型的研究顯示,Nrf2對肝脂肪變性有改善作用。在這些研究中,系統性Nrf2過度激活是通過敲除基因Keap1(k1kd)模型或通過CDDO-IM 的藥物誘導。Wible等[19]灌胃CDDO-IM藥物誘導,Zhang等[20]用k1kd小鼠配合蛋氨酸-膽堿缺乏飲食(MCD)飲食5 d,兩者都顯示了NASH病情減弱。本研究結果較為一致。然而,有研究者使用瘦素缺乏癥(lepob/ob)k1kd小鼠喂養到16周以及使用k1kd小鼠喂養HCD 24周后,均表現為肝脂肪變性增加,Nrf2過度活化[21]。與本結果相矛盾。值得注意的是,不同研究喂養時間的長短差別很大,顯示Nrf2的保護作用的飲食時間較短,最多4周。另有研究者注意到8周齡時lepob/ob和lepob/ob k1kd之間的肝脂肪變性沒有區別,且在8周齡時k1kd抑制lepob的脂質積累,而在16周齡時可促進脂質積累[22]。說明Nrf2對肝脂肪變性的保護可能是一種時間限制效應。
Nrf2/ARE通路可以調節解毒酶的轉錄水平,從而調節氧化還原水平和各種抗氧化平衡,是細胞抵御氧化應激的主要作用機制。Nrf2/ARE通路主要由3個部分構成,抗氧化反應元件ARE、調節氧化應激反應的重要轉錄因子Nrf2以及兩者結合調控基因表達。Nrf2在細胞質通過與Keap1結合形成Keap1-Nrf2復合體,細胞質轉移到細胞核,復合體解離,導致游離的Nrf2增加并且誘導Nrf2 mRNA轉錄,促進Nrf2蛋白生成,然后與ARE結合激活靶基因,如NQO1、HO-1。有研究表明灌胃鵝去氧膽酸后小鼠肝中Nrf2、HO-1與NQO1蛋白表達水平明顯升高[23]。。這些數據表明在實驗性NASH中,Nrf2的激活途徑仍具有功能性。此外,這些數據可能表明,患有NASH的患者可能保留功能性Nrf2信號。NASH仍然受益于抗氧化劑/Nrf2活化療法。研究表明有藥物激活Akt和Nrf2/ARE信號通路,并增加Nrf2/ARE途徑的兩個下游因子HO-1和NQO-1的蛋白質水平,提高ROS清除能力和抑制氧化反應[24]。HO-1在抗氧化的同時也可以降低多種炎癥反應,減輕組織的損傷,對組織具有保護作用。
總而言之,白藜蘆醇治療非酒精性脂肪性肝炎大鼠可能是基于Nrf2/ARE信號通路激活機制,從而改善氧化應激水平,可減輕肝病理損傷,然而,白藜蘆醇是如何特異性激活Nrf2的表達,是否通過影響哪些上游分子信號通路來影響Nrf2的表達,且不同作用時間段會產生不同的影響,這些問題都有待進一步探討和研究。