基于血清Fe和CA199預測模型對慢性乙型肝炎患者肝纖維化分期的臨床研究*
魏 鑫 徐 懂 龍細雨 伍喜良 郭麗穎 賈建偉△
1.天津中醫藥大學研究生院 (天津, 301617) 2.天津市第二人民醫院中醫、中西醫結合Ⅰ科
肝纖維化是各種慢性肝病發展過程中不斷修復損傷,導致的肝細胞外基質彌漫性地沉積和異常分布的病理狀態。其進一步可發生肝小葉結構破壞,假小葉形成,最終發展為肝硬化。肝硬化臨床可見肝功能減退和門靜脈高壓形成,一般不可逆轉。但若能準確評估肝纖維化程度,及時進行干預,可有效地減緩肝纖維化進展,減少并發癥的出現,甚至逆轉肝纖維化[1]。肝活組織病理檢查是診斷肝纖維化的“金標準”,因其有創且有一定風險,或可出現一系列并發癥,臨床接受度差,因此尋找無創的肝纖維化評價方法是目前肝纖維化研究的熱點。本研究通過對慢性乙型肝炎(CHB)所致的肝纖維化患者的臨床數據研究,采用t檢驗和二元Logistic回歸分析,旨在建立一種新模型能夠區別無或輕度肝纖維化與顯著肝纖維化,現報道如下。
1 資料與方法
1.1 研究對象 回顧性收集2018年5月至2020年3月在天津市第二人民醫院住院的CHB患者54例,其中男28例,女26例,所有患者均行肝穿術,完成肝臟病理檢查。診斷標準:CHB診斷參考《慢性乙型肝炎防治指南》(2019版)[2],肝臟病理參考《肝纖維化診斷及治療共識》(2019年)[3]。根據肝活組織檢查的肝纖維化分期,將S0/1(34例)分為無顯著肝纖維化組(62.96%),S≥2(20例)為顯著肝纖維化組(37.03%)。納入標準:①符合慢性乙型肝炎病毒(HBV)感染診斷標準;②年齡18~72歲;③ALT≤2×ULN,BMI≤25,抗病毒治療中。排除標準:①其他病因引起的肝纖維化(包括其他病毒感染、酒精性肝病、自身免疫性肝病、脂肪性肝病、藥物性肝炎等)者;②合并其他(如冠心病、糖尿病等)慢性病者;③合并肝癌者。
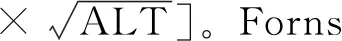
1.3 倫理學審查 納入患者均簽署知情同意書,本研究經由天津市第二人民醫院倫理委員會批準并備案(No.LL-BG-032)。
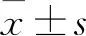
2 結果
2.1 兩組患者的基線數據特征比較 根據肝活組織檢查的肝纖維化分期,S0/1為無顯著肝纖維化組,34例,其中男16例,女18例,平均年齡(39.41±8.45);S≥2為顯著肝纖維化組,20例,其中男12例,女8例,平均年齡(37.95±8.58)。單因素分析結果顯示,無顯著肝纖維化組患者的GGT、Gamma蛋白、LN、AFP、CA199、Fe值均顯著低于顯著肝纖維化組,PLT、Beta1蛋白、Beta2蛋白、TFR、UIBC值均顯著高于顯著肝纖維化組(P<0.05)。見表1。
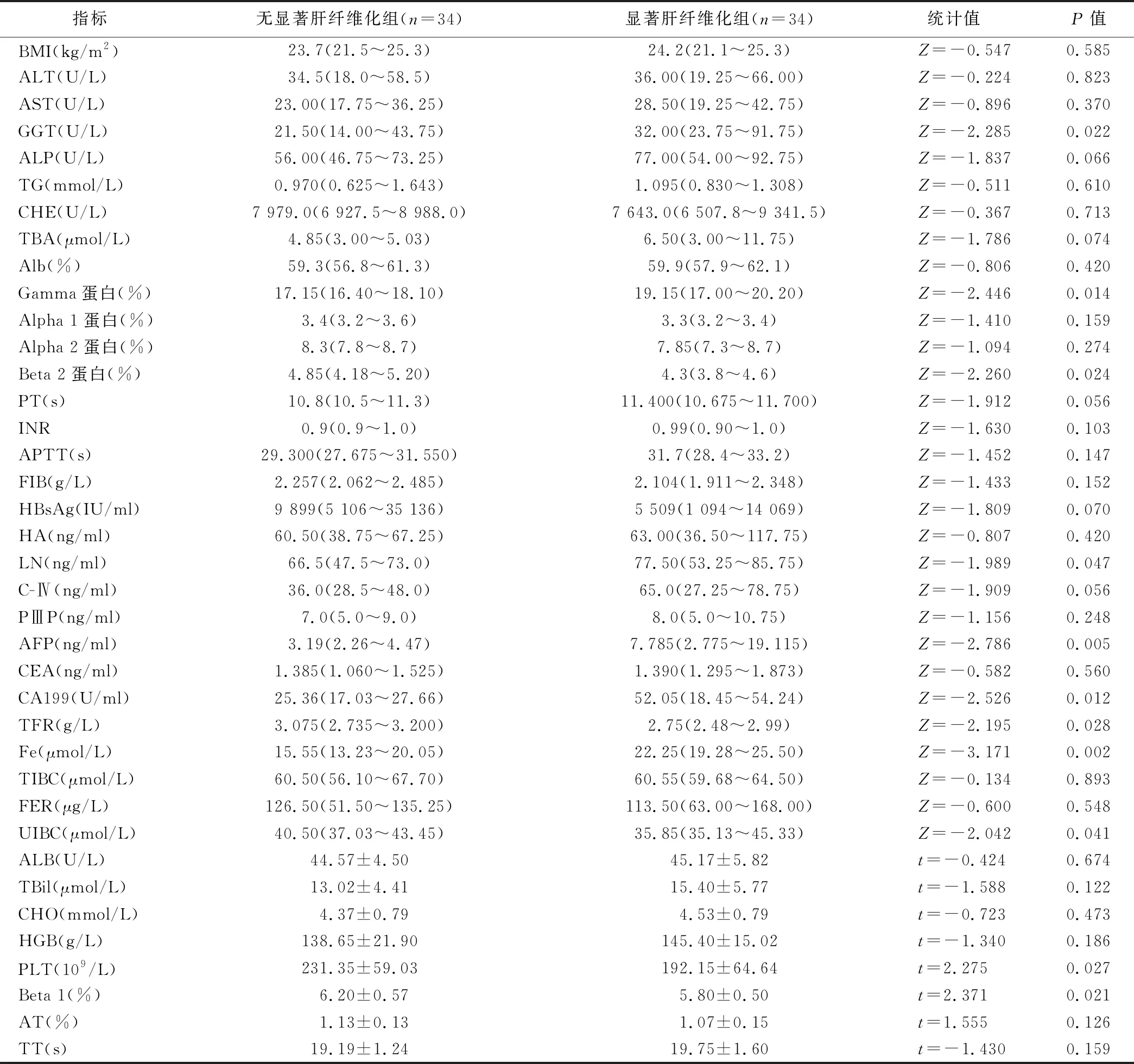
表1 各基線數據在兩組患者之間的差異比較
2.2 二元Logistic回歸分析與模型的建立 將上表中具有統計學意義的指標納入二元Logistic回歸分析,Box-Tidwell方法證實這些指標與二分類的分組結果間存在線性關系,容忍度和方差膨脹因子證實這些指標間沒有多重共線性。結果顯示,Fe和CA199是區分顯著肝纖維化的重要且具有統計學意義的因素。使用基于最大似然估計的向前逐步法(LR)將Fe和CA199再次納入回歸分析,得出新模型的常數與系數,建立[logit(CF)=-4.918+0.051×CA199+0.133×Fe]模型(表2)。回歸模型系數的綜合檢驗結果,P<0.001。Hosmer-Lemeshow測試結果顯示模型擬合優度較高,P=0.952,故該模型具有統計學意義。結果顯示,該模型能夠正確分類79.6%的研究對象,其敏感性和特異性均較高,分別為65.0%和88.2%。
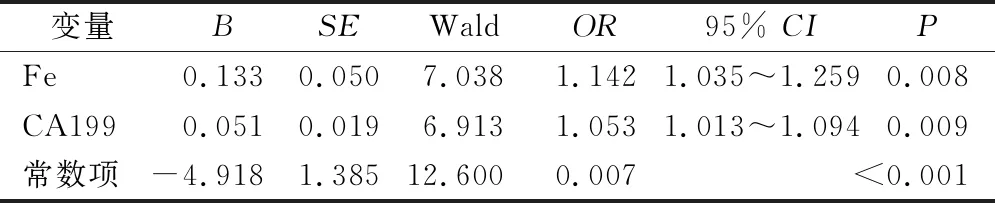
表2 二元Logistic回歸分析結果
2.3 新模型的診斷價值及與其他模型的比較 通過建立的新模型,運用SPSS自動運算出每個病例的預測概率,繪制ROC曲線,可得新模型的AUC為0.843。根據公式分別計算每個病例的Forns指數,APRI和FIB-4,采用MedCalc18.2軟件繪制4個模型的ROC曲線(圖1),分別得到Forns的AUC為0.650,APRI為0.635,FIB-4為0.608,結果顯示CF預測顯著肝纖維化的能力明顯高于其他模型,且具有統計學意義(P<0.05)。見表3、表4。
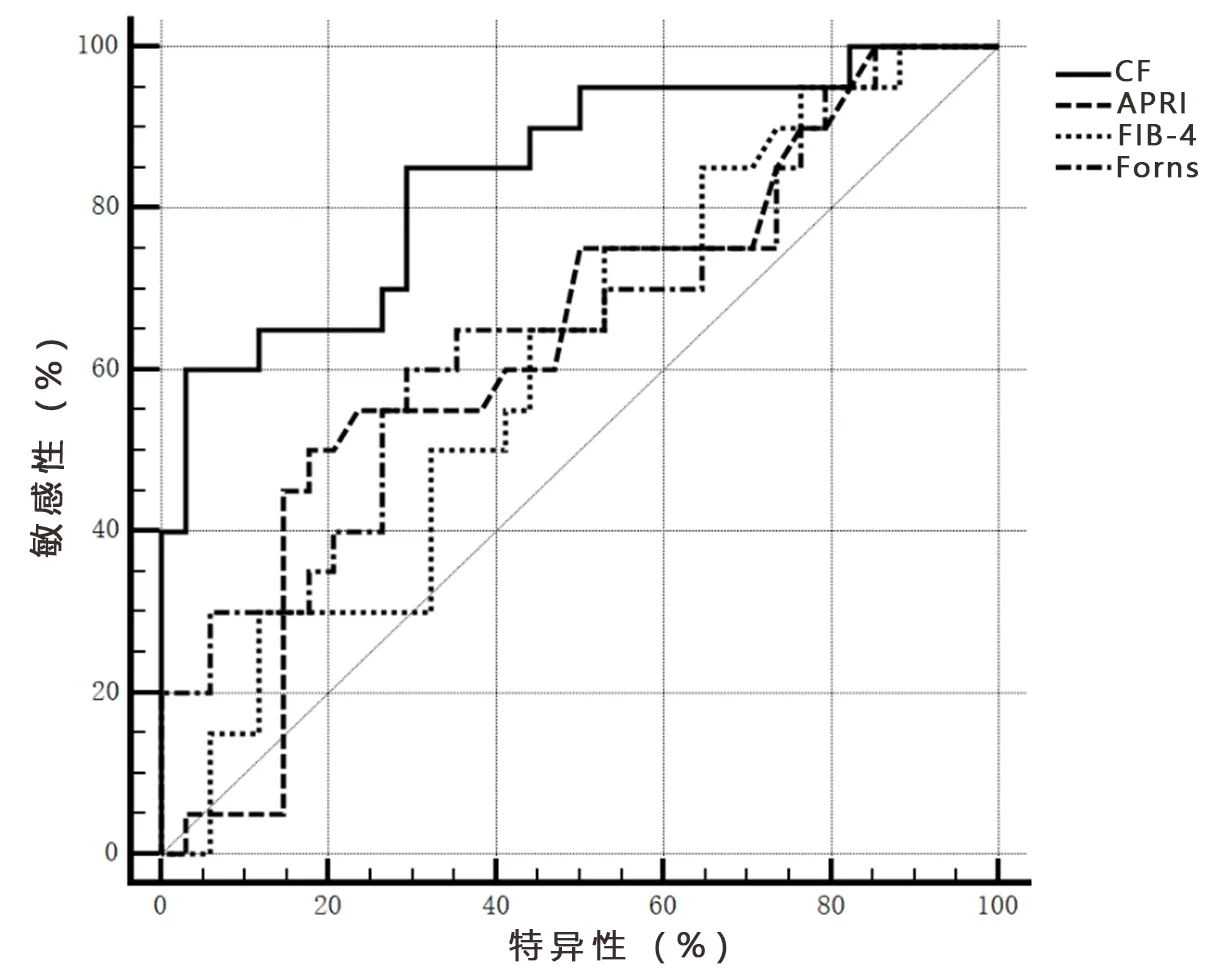
圖1 CF、Forns、APRI和FIB-4模型對顯著肝纖維化患者評估的ROC曲線
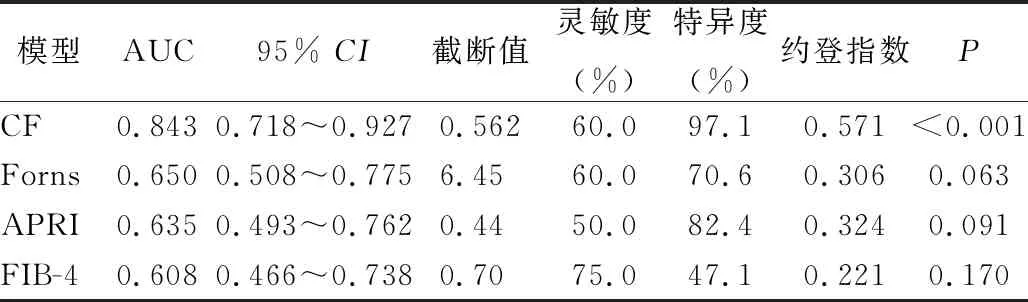
表3 CF、Forns、APRI和FIB-4模型對顯著肝纖維化患者的預測效果
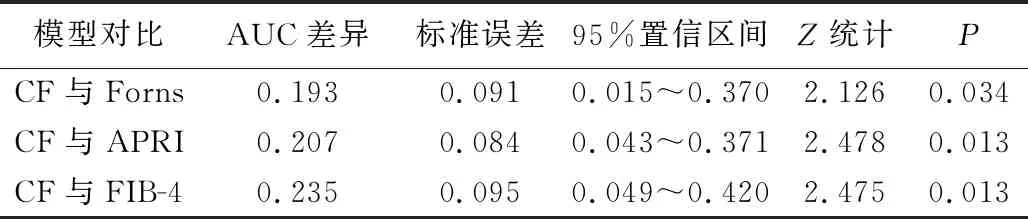
表4 新模型CF與Forns、APRI、FIB-4模型的統計學差異
2.4 CF與ARFI、FibroScan的評估價值對比 ARFI和FibroScan是臨床常用的評價肝纖維化較好的影像學方法,其VTQ值和LSM值的曲線下面積AUC分別為0.840、0.782。CF模型AUC雖然大于ARFI和FibroScan,但無統計學意義(P>0.05)。
3 討論
肝纖維化這一病理過程早期或輕度是可以通過治療逆轉的,因此,臨床上如何快速地診斷這一時期以降低肝硬化的發生率非常重要。各種無創肝纖維化模型診斷方法如APRI、FIB-4、Frons等,影像學檢查方法如瞬時彈性成像、二維剪切波彈性成像、聲輻射脈沖成像等都能較好預測肝纖維化的分期[4-7]。由于現階段臨床上熟知的無創肝纖維化診斷模型如APRI、FIB-4評分均是基于慢性丙型肝炎感染所致的肝纖維化探究得出的,故APRI對CHB所致的肝纖維化的預測價值相對較低[8-10],FIB-4也僅在診斷Metavir評分≥F3時的特異度達到97%[11]。肝纖維化的進一步發展就是肝硬化,而我國77%肝硬化都是由CHB所致[2],可見對于CHB所致的肝纖維化的無創性診斷模型仍在探索之中。本研究根據肝活組織檢查,將CHB所致的無或輕度的肝纖維化與顯著肝纖維化甚至是彌漫性肝纖維化區分開,發現一種新的無創肝纖維化模型,且能夠很好地判斷這一過渡階段患者的肝纖維化程度,為防止病情進展至肝硬化提供了有效依據。
本研究將新血清學模型CF與APRI、FIB-4及Frons評分模型進行對比,其效用均高于這3種模型,且差異具有統計學意義。除此之外,FibroScan能很好地評估顯著的肝纖維化和肝硬化,是一項非常成熟的影像學技術[12],且與二維剪切波彈性成像技術的評估效用相似[13],本研究中CF的AUC甚至高于FibroScan,一定程度上說明此模型的診斷效用與這兩項影像檢查相似,且可以作為替代,以彌補瞬時彈性成像因肥胖、腹水、人為操作不當等影響因素的缺陷[14-16]。ARFI是與FibroScan診斷價值幾乎一致的影像檢查[17,18],其AUC也顯示ARFI對于判定顯著肝纖維化與CF具有相似性。因此本研究結果證實,新模型CF和ARFI、FibroScan兩種影像檢查的診斷價值相同,且因其避免了人工操作和個體的差異性,故實用價值可能更高。
新模型CF中納入的血清鐵作為臨床常見指標,有研究說明其增加可加重HBV感染者的肝臟損傷[19];而CA199是胰腺癌、膽管癌等的生物標志物,雖無特異性,卻可因膽汁淤積,肝硬化等而升高[20],有研究顯示血清CA199水平隨著肝臟損傷程度增加而升高,且與肝硬化的嚴重程度成正比,可能與肝細胞變性、壞死有關[21]。Zeng等[22]研究提示CA199水平可作為肝炎、肝硬化等肝臟疾病的潛在診斷生物標志物。因此,兩者應用入模型中能夠對顯著肝纖維化的分期提供新的途徑。
綜上所述,新模型CF比APRI、FIB-4、Forns模型評估CHB顯著肝纖維化(S≥2)的效能更高,與ARFI和FibroScan的預測價值一致,甚至可能更好。但本研究仍存在些許不足,如樣本量相對較少,具體作用機制尚不完全清楚,故尚待大樣本研究來進一步完善。

