鐵調素在缺血性腦卒中后鐵穩態失衡中的調控作用
吳海輝,葛金文,2
(1.湖南中醫藥大學中西醫結合學院,長沙 410208; 2.邵陽學院,湖南 邵陽 422000)
據腦卒中流行病學調查顯示,我國年齡>40歲人群首次腦卒中的標化發病率平均每年增長8.3%,每年因腦卒中死亡的患者約190萬例[1]。數據表明,我國已成為全球腦卒中發病率最高的國家[2]。腦卒中是成人致殘和死亡的首要病因,嚴重影響我國居民的生活質量[3]。在腦卒中的分型中,缺血性腦卒中的發病率約為77.8%,是最常見的腦卒中類型[4]。人腦中的鐵具有嚴格的調節規律,可以防止因鐵過量或不足而導致的相關疾病。目前,大腦中鐵超載已成為帕金森病、阿爾茨海默病等部分神經退行性疾病的共同特征[5]。鐵穩態失衡作為腦血管神經損傷的新機制已受到廣泛關注。臨床觀察發現,腦卒中患者存在血清鐵水平升高[6]。在腦缺血動物模型的缺血側觀察到鐵調素表達水平升高[7]。在臨床病例和腦缺血動物模型中均觀察到鐵和鐵調素的病理性改變,因此鐵損傷作為腦缺血氧化應激損傷的誘因應引起高度重視[8]。關于鐵穩態調節,“兩個中心、三個體系、網絡調節”工作模式的提出具有一定創新性[9]。現就鐵調素在缺血性腦卒中鐵穩態失衡中的調控作用予以綜述。
1 腦鐵穩態及鐵穩態失衡
1.1腦鐵穩態 作為多種生物功能的關鍵元素,鐵參與機體氧轉運、電子轉運、氧化還原反應、細胞分裂、核苷酸合成和髓鞘形成等一系列復雜的生理過程[10]。鐵在腦組織中也具有重要作用,其通過血液循環進入中樞神經系統后被吸收至大腦的多種神經元中,作為酶輔基參與神經遞質及少突膠質細胞髓鞘蛋白的合成等多種腦生理活動[11]。另一方面,細胞內鐵過量可增加氧化負荷,導致細胞功能損傷,當大腦中鐵穩態失衡時,鐵超載和鐵缺乏均會對腦組織產生影響。有研究證實,腦缺血時鐵離子釋放增加,大量游離鐵造成神經元細胞內脂質氧化物代謝失調,催化產生大量自由基,而氧化應激反應可導致腦組織損傷及鐵代謝相關疾病[12]。因此,為了維持機體正常功能,大腦中必須有一個精確且嚴格的調控機制來調節鐵平衡。
生理狀態下,腦內鐵離子水平處于攝取、儲存和釋放的動態平衡。鐵在細胞膜上的運動需要特定的運輸系統,許多蛋白分子參與腦鐵代謝的平衡。在正常情況下,機體鐵的攝取主要通過轉鐵蛋白/轉鐵蛋白受體(transferrin/transferrin receptor,Tf/TfR)系統,但也有較少部分鐵以非轉鐵蛋白結合鐵的形式被利用[13]。從腸上皮細胞釋放入血的鐵離子,在血液中主要以三價鐵離子(Fe3+)與Tf結合(Fe3+-Tf)的形式存在,部分二價鐵離子(Fe2+)在氧化酶的作用下被氧化為Fe3+后與Tf結合形成含鐵轉鐵蛋白;血液中的Fe3+-Tf與細胞膜表面的TfR特異性識別后,形成Fe3+-Tf/TfR復合體,并在細胞膜內吞作用下進入細胞[14]。由于血腦屏障的作用,鐵離子不能直接進入腦內,需要特殊的轉運系統轉入。腦毛細血管內皮細胞是組成血腦屏障的細胞,由于細胞膜上也存在TfR表達,因此機體可通過Tf/TfR系統將鐵離子轉運至腦內[15]。二價金屬轉運蛋白1是一種廣泛表達的蛋白質,可將在酸性環境中內吞體釋放的Fe2+轉移至細胞質的不穩定鐵池中。而腦內神經元主要通過受體介導的內吞機制攝取鐵。因此,為了維持細胞內鐵的動態平衡,機體必須存在一種鐵排泄通道。目前已知的哺乳動物體內唯一的鐵輸出蛋白是膜鐵轉運蛋白,膜鐵轉運蛋白作為鐵離子輸出的唯一通道蛋白,可監測細胞內鐵離子的水平[16]。機體正是通過這種上下游鐵轉運蛋白的相互配合,調控包括腦在內的鐵的攝取、儲存和釋放的動態平衡。
1.2鐵穩態失衡 在許多神經性疾病中均出現腦內鐵含量異常,如創傷性腦損傷和腦缺血患者均出現鐵穩態失衡,其鐵離子沉積顯著增加[3]。腦鐵超載后氧化應激的過度激活和脂質過氧化的大量積累均可導致腦神經元損傷[17-18]。腦缺血發生后,TfR表達增加、膜鐵轉運蛋白表達減少,細胞內鐵離子沉積顯著增加,提示鐵代謝異常可能是導致腦缺血后損傷的潛在機制[19]。腦缺血損傷發生后鐵穩態失衡導致大量鐵離子沉積,而鐵超載可致線粒體結構和功能不可逆性損傷,進而導致大量活性氧類的產生和脂質過氧化物積累,從而引起細胞鐵死亡[20]。鐵死亡的機制包括由芬頓反應產生的超負荷的氧化自由基以及脂質過氧化損傷[21-22]。在芬頓反應中,Fe2+與過氧化氫反應生成過量的羥自由基,引起神經細胞過氧化損傷和繼發的細胞毒性,導致腦組織損傷加重,雖然細胞內存在自身抗氧化劑(如谷胱甘肽和超氧化物歧化酶)可以減少腦組織損傷,但抗氧化劑在腦缺血或出血期間對抗氧化應激的作用仍十分有限[23]。蘇永永等[24]用去鐵胺預處理局灶性腦缺血小鼠發現,小鼠的神經行為學評分降低,腦梗死和腦水腫面積縮小,表明降低鐵離子水平可改善腦梗死癥狀、減輕缺血后的神經損傷。廖君等[25]用去鐵酮處理腦缺血再灌注損傷大鼠發現,大鼠TfR和二價金屬轉運蛋白1的表達下調,腦鐵離子沉積減少,腦缺血再灌注后神經損傷減輕。目前關于鐵穩態的研究僅局限于鐵相關轉運蛋白的變化方面,且缺乏實驗和臨床研究證據,因此鐵穩態失衡對缺血性腦卒中的作用還需進一步深入研究。
2 鐵調素
鐵調素是一種由肝細胞產生的小分子多肽類激素,在機體鐵穩態調控過程中發揮樞紐作用。2001年,Pigeon等[26]發現,鐵調素對體內鐵穩態具有調節作用。鐵調素由多個小分子多肽構成,其中含有25個氨基酸的多肽是其發揮作用的主要形式,鐵調素分子中含有8個高度保守的半胱氨酸殘基,并通過4個分子內二硫鍵連接成發夾結構[27]。除了在肝臟中表達外,鐵調素在腦組織中也有表達,且在腦不同區域鐵調素的表達量也不同,在皮質、紋狀體、小腦中鐵調素的表達水平較高,在海馬、丘腦及脊髓中也有一定表達[28]。由于腦不同區域的生理結構和功能存在差異,因此鐵調素在腦區差異化的表達可能與某些神經系統疾病損傷相關,如腦卒中、腦出血、阿爾茨海默病和帕金森病等。近來研究發現,鐵調素還在神經元和大腦脈絡叢上皮細胞中表達[29]。鐵調素在腦組織細胞中的表達,對于維持腦細胞鐵穩態平衡至關重要。已有研究證實,鐵調素可通過調節腸的鐵吸收、巨噬細胞鐵回收和肝細胞鐵儲存調控鐵水平[30]。而鐵調素的產生又受鐵水平的調節,當鐵充足時,細胞可產生更多的鐵調素,限制鐵吸收;當鐵缺乏時,細胞產生鐵調素的量反而減少,使更多的鐵進入血漿。鐵調素對鐵代謝的調控作用主要通過降解已知的細胞內唯一鐵輸出蛋白——膜鐵轉運蛋白實現,以此控制細胞與血液循環鐵的流通狀態[31]。病理狀態下,循環鐵增加通過反饋調節機制導致鐵調素的表達上調,鐵調素與膜鐵轉運蛋白形成復合物,誘導膜鐵轉運蛋白發生泛素化并負性調節使細胞內鐵離子的輸出量減少[32]。因此,鐵調素的表達異常是鐵穩態失衡的關鍵。目前以鐵調素為靶點的藥物研發已成為鐵代謝研究領域的熱點,針對鐵調素的靶向治療可有效改善腦卒中發生后的鐵穩態失衡,深入研究鐵調素的調控機制對于病理性鐵過載的治療具有潛在的臨床應用價值。
3 鐵調素參與缺血性腦卒中后鐵穩態失衡的調控機制
鐵調素是鐵穩態網絡調節過程的中心調控分子,參與鐵穩態的動態調控過程,其自身的表達調控也受到嚴密的調節。研究發現,機體存在多種途徑可調控鐵調素,生長代謝需求、炎癥環境、系統鐵負荷等因素均可影響鐵調素的表達[6]。不同的調控途徑間又存在交叉作用,但影響鐵調素表達的分子調控機制目前尚未明確,需進一步研究闡明。
3.1骨形態發生蛋白(bone morphogenetic protein,BMP)-血幼素(hemojuvelin,HJV)/Smads信號通路 BMP6及其下游的Smads蛋白被認為是調控鐵調素的經典途徑[33]。BMP6基因含有7個外顯子,編碼513個氨基酸大前體,包括N端信號肽序列、適當折疊的前體蛋白和C端分泌成熟肽序列[34]。細胞膜表面的BMP受體包括Ⅰ型受體和Ⅱ型受體兩個亞型,BMPⅠ型受體和Ⅱ型受體共同作用將信號傳遞給細胞內的Smads蛋白,Smads蛋白作為細胞內信號轉導蛋白,參與靶基因的轉錄激活過程[35]。如轉化生長因子-β(transforming growth factor-β,TGF-β)與Smads蛋白形成受體復合物進入細胞核內,具有激活或抑制靶基因表達的作用[36]。研究發現,BMP6在成人中樞神經系統神經元及其軸突中均顯著表達,在少突膠質細胞、星形膠質細胞和室管膜細胞中也有表達[37]。由此可見,BMP6在腦中發揮重要作用。
BMP6與HJV可形成二聚體復合物,BMP6-HJV復合物首先通過與細胞膜表面的BMPⅡ型受體結合,將信號傳遞給BMPⅠ型受體并使之磷酸化,形成膜表面四聚體復合物,然后再向細胞內傳遞信號,使Smads蛋白家族中的Smad1、Smad5、Smad8磷酸化,磷酸化后的Smad1、Smad5、Smad8與Smad4形成復合物并轉運至細胞核,結合鐵調素啟動子啟動轉錄,從而達到調節鐵調素的目的[38]。目前已證實,給予富含鐵的飲食和注射右旋糖酐鐵均可增加小鼠肝臟中磷酸化Smad1、Smad5、Smad8的表達,且Smads蛋白的表達增加與鐵調素表達水平升高相關[39]。另有研究發現,存在BMP6基因致病性變異的患者鐵調素水平顯著降低[40]。有文獻報道,人類雜合子BMP6缺陷可導致輕度至中度遲發性鐵超載,表現為血清鐵蛋白水平升高和肝臟鐵儲備增加[32]。可見,作為調控鐵調素表達的上游信號分子,BMP6水平可反映細胞內的鐵水平。但也有研究發現,在BMP6缺陷小鼠中仍存在慢性鐵負荷后鐵調素水平升高[41]。由于腦卒中損傷后鐵代謝紊亂具有多途徑參與的特點,因此細胞內可能還存在其他調控鐵調素的途徑。
根據HJV蛋白的作用特點其可分為兩種類型:①膜性HJV,可作為BMP的共受體參與BMP6調控鐵調素的經典途徑;②可溶性HJV,可減少BMP-HJV復合物,對鐵調素的表達起抑制作用[42]。此外,在跨膜絲氨酸蛋白酶6(transmembrane serine proteases 6,TMPRSS6)基因突變的小鼠體內,血清鐵調素水平顯著升高,向小鼠體內注射TMPRSS6則鐵調素的表達受到抑制,可見TMPRSS6對鐵調素的表達具有抑制作用[43]。研究表明,TMPRSS6可切割HJV蛋白導致BMP6-HJV復合物形成減少,在鐵調素調節中發揮負性調控作用[44-45]。因此,深入研究TMPRSS6與HJV蛋白的作用機制有利于探索抑制鐵調素表達的負性調節通路。研究還發現,HJV與再生蛋白Neogenin有一定相互作用,Neogenin可抑制HJV的分泌并調節BMP誘導的鐵調素表達和鐵穩態[46]。然而,Zhao等[47]發現,Neogenin可與間變性淋巴瘤激酶3(一種促進鐵調素表達的BMPⅠ型受體)發生共免疫沉淀,表明Neogenin可作為促進BMP-HJV/Smads受體復合物形成的支架參與調控鐵調素表達的過程。
3.2白細胞介素(interleukin,IL)-6/Janus激酶(Janus kinase,JAK)2信號通路 炎癥和氧化應激在腦缺血引起的神經元損傷中起重要作用。隨著對鐵穩態研究的不斷深入,發現炎癥細胞因子也可調控鐵調素的表達[48]。小膠質細胞作為大腦中的巨噬細胞,在腦缺血損傷發生后立即被激活并釋放IL-6等炎癥細胞因子,同時促進星形膠質細胞的活化[49]。在生理病理條件下,星形膠質細胞參與維持大腦細胞功能,其可清除活性氧類和過量的神經遞質、控制離子和水的流出,同時釋放神經營養因子、調節血腦屏障的通透性以影響鐵離子的轉運攝取[50]。活化后的星形膠質細胞可增加IL-6與膜表面受體的結合,激活與受體偶聯的JAK,磷酸化的JAK催化信號轉導及轉錄激活因子3,最終以JAK2/信號轉導及轉錄激活因子3二聚體的形式進入細胞核中與鐵調素基因的啟動子特異性結合,誘導鐵調素高表達[51]。鐵調素高表達可加速膜鐵轉運蛋白的內化降解,使細胞鐵的輸出減少,導致神經元細胞中鐵離子沉積并通過芬頓反應產生大量活性氧類,加重細胞損傷[21]。這與在缺血性腦損傷中發現的游離鐵及鐵蛋白水平升高具有一致性,產生了一種由鐵代謝紊亂、炎癥和氧化應激形成的惡性循環[8]。因此,有效控制缺血性腦卒中后的炎癥反應,有利于緩解腦鐵超載,減少鐵調素的表達和減輕組織損傷。
3.3Tf/Smads信號通路 含鐵轉鐵蛋白是影響鐵調素表達的另一個關鍵調節因子。Bartnikas等[52]給予低轉鐵蛋白水平的小鼠補充轉鐵蛋白,可導致小鼠體內鐵調素表達水平升高。Muckenthaler等[53]發現,細胞內轉鐵蛋白飽和度與鐵調素表達變化一致,揭示了轉鐵蛋白水平對鐵調素的重要作用。含鐵轉鐵蛋白與遺傳性血色素沉著癥候選基因(hemochromatosis gene,HFE)蛋白競爭性地結合細胞膜表面的TfR1,由于HFE與TfR1的結合力較弱,導致HFE從TfR1上分離并轉移至TfR2上,形成HFE/TfR2復合物,HFE/TfR2復合物誘導Smad1、Smad5、Smad8磷酸化,磷酸化的Smad1、Smad5、Smad8與Smad4結合共同進入細胞核激活鐵調素基因的表達[54]。Latour等[55]通過比較HJV基因單敲除小鼠與HFE和TfR2雙基因敲除小鼠發現,雙基因敲除小鼠的鐵水平與HJV基因單敲除小鼠相似。表明HJV可能參與了HFE或TfR2途徑,但轉鐵蛋白介導的轉運是否與BMP6受體的作用途徑存在交叉還有待進一步探究。
3.4其他途徑 鐵誘導的線粒體氧化損傷通過引起線粒體脂質過氧化和脂質的釋放而激活核轉錄因子紅系2相關因子2,并導致BMP6表達水平升高,在鐵超載的情況下,核轉錄因子紅系2相關因子2激活可提高鐵誘導活性氧類的能力,并通過BMP6作用于鐵調素[56]。除BMP6外,BMP2、BMP4、BMP5、BMP7、BMP9等也可在體外誘導鐵調素的表達[57]。研究發現,BMP2與HJV結合的親和力與BMP6和HJV結合的親和力相同,在通過血清鐵、炎癥和紅細胞生成調節鐵調素表達中具有一定作用[58]。表明BMP2與BMP6的功能具有一定的重疊,為了解鐵調素調節通路提供了新途徑。而新發現的轉錄輔助抑制因子SHP(small heterodimer partner)是一個鐵穩態負調節因子,其可通過抑制與鐵調素啟動子結合的Smad1和Smad4 復合物的形成,抑制轉錄的發生[59]。
在復雜的疾病病理生理進程中,鐵被感知并轉化為信號調節鐵調素表達的機制目前尚不明確。因此,以BMP-HJV/Smads、IL-6/JAK2、Tf/Smads等為代表的信號通路的調控(圖1)仍是未來研究的熱點。
4 小 結
目前,靜脈溶栓和血管內治療已成為治療缺血性腦卒中的常用手段[60]。中藥在臨床治療中可顯著改善患者癥狀。現代藥理研究發現,具有益氣活血功效的中藥有效成分具有抗炎、抗氧化和神經保護作用,在減輕鐵超載方面具有一定積極意義[61]。廖君等[62]用益氣活血的腦泰方和去鐵酮干預腦缺血模型大鼠后發現,細胞內鐵離子沉積減少,鐵調素水平顯著降低。鐵穩態失衡可能是缺血性腦卒中的重要病理機制。鐵調素作為鐵穩態網絡調控的關鍵分子,受到多種機制的調控。通過研究鐵調素參與缺血性腦卒中后鐵穩態失衡的作用機制,可以為缺血性腦卒中患者的治療提供新思路。但目前關于中藥改善鐵超載方面的研究較少,且多集中于病理狀態和用藥前后鐵轉運相關蛋白的變化方面。因此,未來仍需多中心、大樣本的臨床試驗探究鐵調素在缺血性腦卒中后鐵穩態失衡中的調控作用,為臨床提供更多治療策略,改善缺血性腦卒中患者的預后。
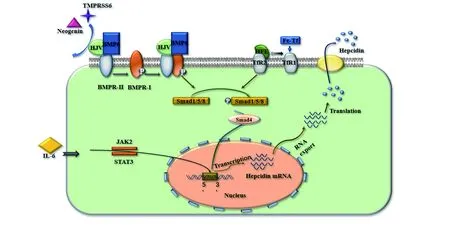
Neogenin:再生蛋白;TMPRSS6:跨膜絲氨酸蛋白6;HJV:血幼素;BMP6:骨形態發生蛋白6;BMPR:骨形態發生蛋白受體;HFE:遺傳性血色素沉著癥候選基因;TfR:轉鐵蛋白受體;Tf:轉鐵蛋白;Hepcidin:鐵調素;Translation:翻譯;IL-6:白細胞介素-6;JAK2:Janus激酶2;STAT3:信號轉導及轉錄激活因子3;Transcription:轉錄;Hepcidin mRNA:鐵調素信使RNA;export:輸出;Nucleus:細胞核

