搭建封閉系統以實現CGT 產品規模化生產
文/ 殷良
毫無疑問,再生醫學將成為生物制藥領域發展的新趨勢——從ARM 公司2020 年的統計數據來看,截止2020 年,全球有超過1085 家從事再生醫學的公司,其中美國以543 家位居世界首位。而中國也以近300 家的規模位列第二,超過了歐洲[1]。
放眼全球的細胞與基因治療(CGT)領域,每年大約進行1 000 個臨床實驗,美國食品藥品監督管理局(FDA)每年也收到超過200 個新藥研究申請(IND 申請)。根據Accenture 對CGT 市場的預測,到2030 年,獲批上市的CGT 產品數量將會達到60 個,將會是2025年的3 倍[2]。
如此便引發了一個問題:如何能夠主動有效的在最短時間內將療法安全快速的帶給患者。
對于中小型CGT 公司來說,高速增長的挑戰在于目前的規模無法滿足生產。未來,大概會有超過65%的公司或考慮將生產力轉向第三方技術服務公司,以外包的形式進行[2]。如此一來,需求的疊加會將壓力轉移到那些原本規模較小的CDMO/CRO 公司。
上述因素可能會直接導致產品無法如期投入市場。產品研發計劃的推遲會導致病患無法得到醫治。那么要如何解決規模問題——方法在于工藝的優化和放大。
提升工藝放大的效率
下面將通過一個常見的例子來幫助大家理解工藝放大:在一開始,研究人員使用單通道移液槍,然后增加為8 通道移液槍,最后再擴大到12 通道的電子移液槍。
這個過程是開放的,而且以人員操作為主,需要通過環境控制來確保無菌條件。當進入小試階段,我們開始用可以放大的封閉系統來代替96 孔板,如小型的細胞工廠或反應器。在細胞培養的過程中,還需要額外控制pH 和溶氧等關鍵因素。
這就是工藝放大的過程——從實驗室級別到反應器,然后再逐步增加反應器的體積。
例子中開放系統的劣勢在于,每一個步驟都依賴操作人員的經驗,這就導致整個過程的不可控性較高,并且對操作人員的要求也更高,因為每次的結果都有可能受到人為因素的影響。

實驗室中的無菌環境操作要求
這些挑戰大大阻礙了工藝放大的效率。特別是在中試和生產階段,開放系統的劣勢就更加明顯。
無菌操作相對繁瑣,如處理不當,將面臨藥品污染的風險。小規模的系統可以通過層流罩或超凈臺來實現局部的無菌環境。隨著一次性技術的發展,一些制藥公司開始逐步將關鍵步驟用封閉系統代替,從開放系統轉變為半封閉系統。有關開放系統和半封閉系統在儲液、集成及管路連接的區別,見表1。
半封閉系統雖然在一定程度上優化了工藝流程,但那些需要無菌操作的部分仍然依賴層流罩等設備,用以控制環境的無菌。并且,半封閉系統也無法通過自動化控制系統對整個工藝參數進行記錄和控制。
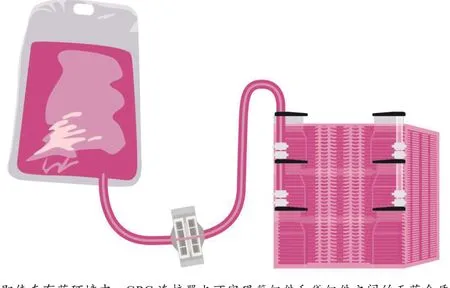
即使在有菌環境中,CPC 連接器也可實現管組件和袋組件之間的無菌介質輸送
由此可知,CGT 企業在工藝放大的過程中可能會遇到以下挑戰:
●缺少相對一致的工藝流程,放大線性系數差,更多的是依賴人工操作。生產過程中自控系統的安裝受阻礙。
●企業對于時間節點的把握缺乏經驗,但是又承受著成本以及產品上市的壓力。由于CGT 是一個新興的領域,很多企業仍處于探索階段,對于工藝的推進也會比較保守,前期不會花費太多的資金用于工藝的優化和升級。
●缺少熟練的操作人員。不僅是CGT,整個生物制藥行業因為市場增長太快,都缺少專業人員。在職人員必須超負荷工作,長期以往會影響工作效率。人才缺口還將隨著下一個熱點的來臨持續加大。
●當自身產能不足時,企業或許會想到與CDMO/CRO 合作,但是這本身也是一個挑戰。CDMO/CRO 目前自身的產能也在接近飽和,如果擴大產能則需要新建廠房,這將花費更多的時間和投資成本。
封閉系統:工藝放大的最佳方案
面對上述的種種挑戰,正是封閉系統展示其身手的大好時機。
基于一次性技術的封閉系統可形成獨立且類似潔凈室的屏障
眾所周知,改造一個潔凈室的成本非常高昂,尤其是A 級潔凈室。這也是為什么很多企業會考慮通過層流罩來實現局部的無菌環境。但是如果使用封閉系統,就可以避免多余的花費。
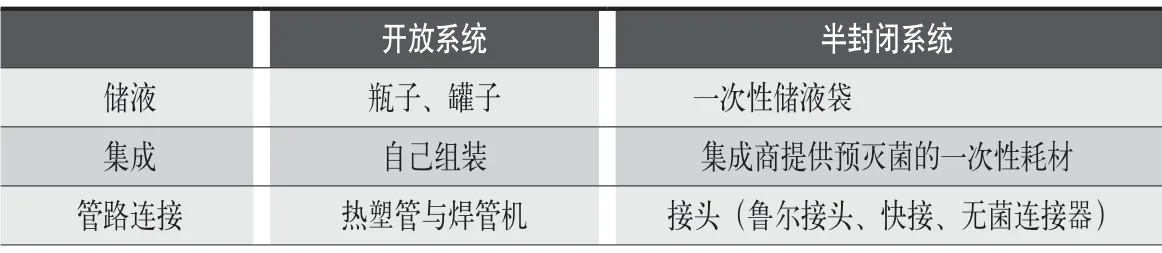
表1:開放系統和半封閉系統在儲液、集成及管路連接的區別
基于一次性技術(SUT)的封閉系統對操作環境沒有任何要求,哪怕在GMP 要求下的C 級環境中也可以實現無菌操作。由于是一次性使用,系統無需進行清洗驗證,不會存在交叉污染的風險。能更好地保護生產工藝中操作人員的安全,使工作場地更符合EHS 要求。
封閉系統能大幅提升靈活性
CPC 可以根據工藝對系統進行個性化定制,在同一個工作區域,根據研發產品每個階段的不同,可以通過更改SUT 的設計以實現工藝的切換。這是不銹鋼系統所不具備的優勢。
封閉系統可以與自控系統集成,使整個生產過程更穩定、快速且可重復
正如2020 年Accenture 報告中所說,隨著自動化控制系統和封閉系統在CGT 行業的普及,在持續降低生產成本的同時,工藝放大也將變得更容易。所以,越早開始使用基于SUT 的封閉系統,也就越容易實現從實驗室到生產的工藝放大。
當然,封閉系統可以從小體積、小規模開始。我們需要明白的是,從實驗室到GMP 生產,都需要快速增長和一致性,利用同類且具備放大性的耗材才可實現從小批量到大批量的轉化。當工藝參數被線性放大,所有參數就可以通過自動化控制系統進行記錄和控制。
上游細胞培養
實現真正的封閉系統
當所有的耗材均為預組裝,才能實現真正的封閉系統。下面將對兩種常見的工序連接方式進行比較,見表2。
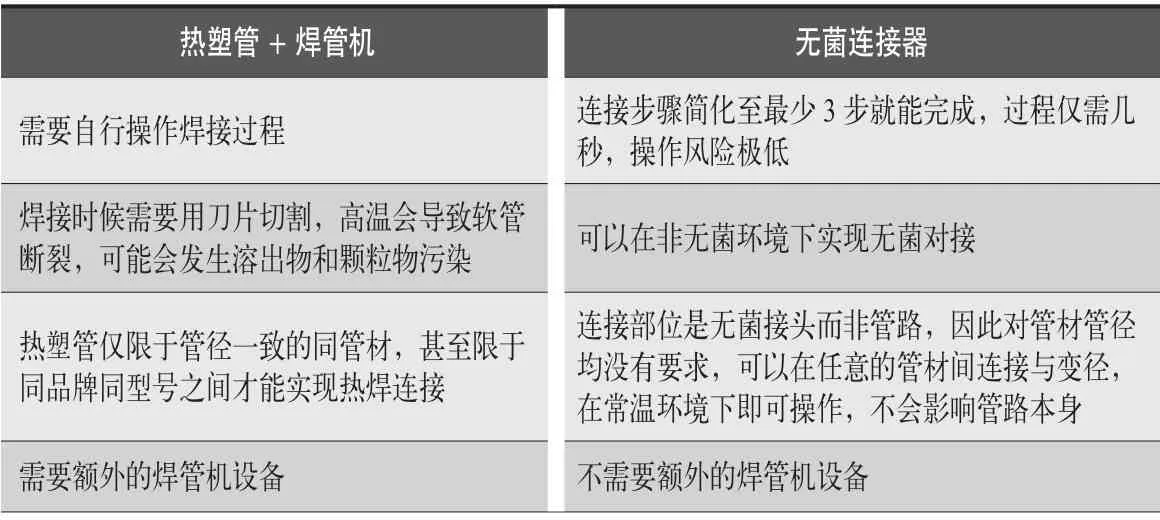
表2 兩種常見的工序連接方式
由此可見,無菌連接器作為一種SUT,可以在系統關鍵的連接處大幅減少操作風險、簡化操作流程,避免系統暴露和受到污染侵害,真正做到“全封閉”。
無菌連接器的其他主要優勢還包括:
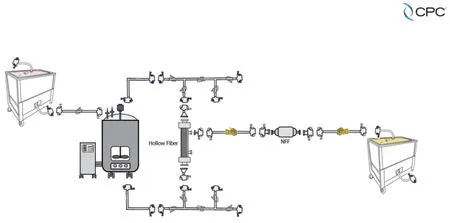
下游純化過濾
●連接器經過完整驗證,內容包括可提取物驗證、無菌驗證、低溫凍存驗證、壓力測試、爆破測試、蠕變測試、負載測試等,有助于降低生物企業的驗證成本。
●從有性別到無性別的不分公母無菌連接器,可以說是一個里程碑式的變革。對采購來說,物料管理成本降低一半;對操作人員來說,無性別在使用時出錯率也更低。
CGT 工藝中需要使用SUT 的情景有很多。以自體工序和病毒載體的生產而言,每一步連接都需要合適的技術以保障其安全和高效。又比如在病毒載體生產過程中,從載體放大與種子培育到生物反應器中的載體擴增,再到澄清與純化,直至進行過濾和灌裝,將其倒入成品容器中,每一步操作都需要連接技術的支持。

簡單的“開蓋—連接—拉膜”操作,便可保證每次使用的可靠性和可重復性
即使在一種類型部件(如儲液袋、接頭或細胞培養系統)中,SUT 的數量都足以用龐大來形容。因此,新用戶會經歷一個陡峭的學習曲線。關于這一點,CGT 企業可向專業的流體處理專家請教,以便更好地應用SUT 知識。

