擴散加權成像在評估直腸癌術前淋巴結轉移和淋巴血管侵犯中的應用價值
陳曉麗,李杭,袁藝,李真林
(1.四川省腫瘤醫院放射科,四川 成都 610041;2.四川省醫學科學院 四川省人民醫院放射科,四川 成都 610072;3.四川大學華西醫院放射科,四川 成都 610041)
結直腸癌是世界上發病率和死亡率最高的惡性腫瘤之一[1]。患者預后和治療策略選擇取決于多種術前臨床病理因素,其中淋巴結轉移和淋巴血管受侵是影響直腸癌患者預后的重要因素[2]。對于術前有淋巴結轉移和淋巴血管受侵患者,術前需要進行新輔助治療后,然后再根據情況選擇手術治療,從而降低患者術后復發風險和延遲患者生存時間[3]。目前磁共振對直腸癌淋巴結轉移的評估主要采用定性分析淋巴結的邊界、信號強度改變等,其準確性為45%~85%[4-6]。此外,術前MRI評估壁外血管受侵敏感性為54%,特異性為90%,盡管較高的特異性,但是對于小于3 mm以下血管受侵無法評估,從而導致漏診,其敏感性偏低[7-9]。已被證實,表觀擴散系數(apparent diffusion coefficient,ADC)與腫瘤分化程度、淋巴結轉移情況及腫瘤細胞增殖具有一定相關性[10-12]。根據腫塊內部腫瘤細胞分布不均質,推測在ADC圖上測得的ADC不同參數值在一定程度上反映了腫瘤的異質性。本研究皆在探討ADC不同定量參數在直腸癌患者術前淋巴結轉移和淋巴血管受侵評估中的診斷價值。
1 資料與方法
1.1 一般資料
選取2020年5月至2021年1月于四川省腫瘤醫院69例行直腸癌手術治療的患者為研究對象。其中男性43例,女性26例;年齡26~88歲,平均(60.0±14.1)歲。根據術后病理淋巴結和淋巴血管受累情況,將其分為有淋巴結轉移組(n=34)和無淋巴結轉移組(n=35)、有淋巴血管受侵組(n=17)和無淋巴血管受侵組(n=52)。納入標準:(1)術前均行MRI和DWI序列檢查,MRI檢查后1~2周內接受手術治療;(2)術前未接受新輔助治療。排除標準:(1)手術后病理證實為直腸黏液腺癌患者;(2)MRI圖像質量差,無法滿足后處理及診斷要求;(3)術前接受新輔助治療患者。
1.2 方法
1.2.1 檢查方法 患者MRI檢查前清潔腸道,檢查前20 min肌注鹽酸山莨菪堿注射液10 mg抑制腸道蠕動。采用Siemens Magnetom Aera 1.5T磁共振掃描儀,32通道體部相控陣線圈。掃描序列包括常規MRI序列(T1WI、T2WI)、DWI序列。T1WI序列:翻轉角70°,TR=262 ms,TE=2.62 ms,層厚6.0 mm,視野(field of view,FOV)400 mm2,矩陣 256×176。T2WI序列:TR=4 590 ms,TE=73 ms,層厚3.5 mm,FOV=220 mm2,矩陣256×512。軸位(垂直于直腸長軸方向)DWI序(b=0,800 s/mm2),TR=5 498 ms,TE=76.2 ms,層厚5.0 mm,FOV=360 mm×270 mm,矩陣192×128。
1.2.2 圖像分析 所有圖像傳送至影像工作站,由兩名具有5年以上影像診斷經驗的放射科醫師在不知病理結果的情況下,采用雙盲法獨立閱片。在后處理軟件上,選取直腸癌病灶所有橫斷層面,避開肉眼可見的囊變、出血和壞死區域,在每個層面腫瘤實性部分勾畫病灶區域為感興趣區(region of interest,ROI),測得腫瘤所有層面的ADC最大值、ADC最小值和ADC平均值(圖1)。為了反映腫瘤異質性,ADC差值定義為ADC最大值與ADC最小值的差值。最后將所有層面ADC參數值取平均分別得到容積ROI法測得的各個參數值。

1.2.3 病理分析 所有患者接受直腸癌根治性手術,所有患者淋巴結清掃至少在12枚以上,由一位具有高年資的病理科醫師對術后病理標本進行評估,并在病理報告中報告淋巴結和淋巴血管情況。
1.3 統計學分析
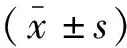
2 結果
2.1 組間一致性
本組測得的ADC最大值、最小值、平均值及ADC差值的ICC分別為0.865、0.835、0.844、0.901,表明測得的數據可靠(ICC>0.75)。
2.2 ADC參數值與淋巴結轉移、淋巴血管受侵的相關性
最大值、平均ADC值和ADC差值與淋巴結轉移相關性較好(r=-0.627、-0.678、0.600,P<0.001),而最小ADC值與淋巴結轉移相關性一般(r=-0.271,P=0.024)。平均ADC值與淋巴血管受侵存在統計學相關性(r=-0.387,P=0.001),而最大ADC值、最小ADC值和ADC差值與淋巴血管受侵無相關性(r=-0.317、-0.207、-0.235,P=0.067、0.088、0.052)。
2.3 ADC不同參數值在淋巴結轉移和淋巴血管評估方面的應用價值
最大值、最小值、平均ADC值和ADC差值在有和無淋巴結轉移組間差異有統計學意義(P<0.001、=0.026、<0.001、<0.001)。最大ADC值和平均ADC值在有和無淋巴血管受侵組間差異有統計學意義(P=0.029、0.001),而最小ADC值和ADC差值在有和無淋巴血管受侵組間差異無統計學意義(P=0.067、0.095)。見表1及表2。
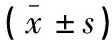
表1 ADC不同參數值在有和無淋巴結轉移組之間的比較
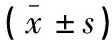
表2 ADC不同參數值在有和無淋巴血管受侵組之間的比較
2.4 ADC不同參數判斷有無淋巴結轉移和淋巴血管受侵的診斷效能
ROC曲線分析顯示,最大值、最小值、平均ADC值和ADC差值術前區分有和無淋巴結的AUC值分別為0.862、0.656、0.892和0.847;最大ADC值和平均ADC術前區分有和無淋巴血管受侵的AUC值分別為0.713和0.759。見圖2及表3。


表3 ADC不同參數值區分有無淋巴結轉移和淋巴血管受侵的診斷效能
3 討論
目前直腸癌治療主要采用全直腸系膜切除術(total mesorectal excision,TME)或新輔助放化療后行TME手術。該治療方案的決定取決于術前臨床因素的評估,其中直腸癌患者術前淋巴結轉移情況和淋巴血管受累情況的判斷是決定直腸癌治療方案的關鍵。而直腸癌術前評估主要依靠影像學檢查,DWI序列已被美國國立綜合癌癥網絡指南[13]、歐洲腫瘤內科學會指南[14]推薦為直腸癌MRI常規掃描序列,能夠通過ADC值測量來間接反映細胞間的密集程度。但利用容積ROI法測得的ADC最大值、最小值、平均值及差值對直腸癌術前淋巴結轉移情況和淋巴血管受累狀態的評估研究未見確切報道。
在淋巴結轉移狀態評估方面,利用MRI常規淋巴結形態學方法評估直腸癌患者淋巴結轉移準確性為45%~85%,原因主要是一些腫大淋巴結可能系炎性增大而不是轉移性淋巴結;此外,因空間分辨率較低,MRI對于小于5 mm以下淋巴結無法精準評估[4-6]。本研究利用容積ROI法測得ADC不同參數值來定量評估術前淋巴結轉移情況,研究發現隨著淋巴結轉移灶的出現,原發腫瘤ADC各參數值逐漸降低,與之前研究一致[15-17]。這在一定程度上反映了淋巴結轉移情況與原發腫瘤具有一定的相關性。其機制主要是因為隨著腫瘤惡性程度逐漸增高,水分子擴散受限越明顯,相應ADC值呈現降低態勢,表明腫瘤生物學行為越惡劣,越容易出現淋巴結轉移。
進一步研究最大值、最小值、平均ADC值及ADC差值在術前評估淋巴結轉移的診斷效能中發現,雖然四種ADC不同參數值都能用于預測術前淋巴結轉移狀態,但最大值、平均ADC值和ADC差值診斷效能較好,AUC值均在0.84以上,其中以平均ADC值診斷效能最高,原因是最大ADC值在一定程度上反映了腫瘤的微循環灌注情況。而本研究發現最大ADC值隨著淋巴結出現逐漸降低,表明腫瘤內部水分子擴散受限的程度高于微循環灌產生的影響,從而消弱了最大ADC值評估淋巴結的診斷效能。ADC差值代表腫瘤細胞分布不均質性,間接反映腫瘤的異質性,理論上異質性越大,生物學行為越惡,越容易出現淋巴結轉移,而本研究發現其診斷效能略微低于其余兩個參數。最小ADC值除了反映細胞密度外,還受到間質炎癥浸潤和組織纖維化的影響,因此其在淋巴結評估方面穩定性差,診斷效能最低[18-20]。而平均ADC值綜合考慮了最大和最小ADC值中微循環灌注和間質浸潤、纖維化等因素對水分子擴散受限的影響,相對于兩種參數來說,診斷效能更加穩定。本研究與Li等[15]報道不一致,主要是后者研究采用在腫瘤層面繪制多個小的ROI法獲得ADC參數,而本研究采用的是勾畫整個腫瘤體積法,更能真實反映腫瘤的生物學行為。
在淋巴血管受累評估方面,隨著淋巴血管受累的出現,所有ADC參數值均隨之減低。原因可能與腫瘤侵犯淋巴管和血管,會增加癌細胞排列密度,細胞間隙減小,水分子擴散受限,故ADC值呈下降趨勢[21]。本研究發現,只有ADC最大值和平均值能夠用于評估淋巴血管受累情況,主要是因為最小ADC值受微循環灌注等因素影響較多,而淋巴結血管受累與淋巴結具有一定的相關性,因此,最小ADC值在評估淋巴血管受累方面作用較小。雖然ADC差值能用于評估淋巴結轉移,但不能用于評估淋巴血管受累,原因可能是本研究中淋巴血管受侵的患者樣本量相對小;其次是反映了ADC差值并不能減少最小ADC值帶來的影響,顯示出ADC差值的不穩定性。下一步將提高樣本量,尤其是增加淋巴血管受侵患者樣本量,進一步驗證我們的研究結果。本研究存在一定的局限性:(1)本研究為回顧性分析,且樣本量相對小,其中淋巴血管受侵僅為17例,因此存在選擇性偏倚。(2)本研究僅評估了有無淋巴結轉移情況,沒有對具體N分期做進一步評估。
綜上所述,ADC不同參數值與淋巴結轉移和淋巴血管受侵存在一定相關性,尤其是平均ADC值在術前預測直腸癌淋巴結轉移和淋巴血管受侵方面具有較高的診斷效能,為臨床制訂最優治療方案和預后評估提供重要的參考依據。

