抗癲癇藥物對嬰幼兒骨代謝的影響
陳麗婷,曾甲斌,柯鐘靈,林 希,陳素清,吳 斌
據世界衛生組織報道,全球大約有6 500萬癲癇患者,我國癲癇患病率約為0.715%[1]。各個年齡段的人群均可罹患癲癇,但以嬰幼兒及兒童的患病率最高。雖然目前癲癇有許多可供選擇的治療方法,包括迷走神經刺激(vagal nerve stimulation,VNS)、外科手術和生酮飲食等,但采用抗癲癇藥物治療始終是首選。研究發現,50%以上服用抗癲癇藥物治療的患者存在骨代謝異常[2],提示抗癲癇藥物與骨質疏松、骨折等密切相關[3]。兒童期及青春期是骨骼發育、骨骼骨礦化的高峰期,其骨骼的生長發育對其將來成年后的身高、運動及生活等極為重要,因此,抗癲癇藥物對此時期骨代謝的影響備受關注,近年的研究也多集中于此時期的患兒[4-5],只有極少數研究關注了嬰幼兒[6]。然而,骨骼發育是一個連續的過程,嬰幼兒期的骨代謝異常也可能造成嚴重后果,如出現佝僂病、骨骼發育畸形等。本研究擬通過對癲癇嬰幼兒骨代謝生化指標的評估,探討抗癲癇藥物對嬰幼兒骨代謝的影響,為臨床診療提供參考。
1 對象與方法
1.1 對象 收集2015年9月-2019年9月就診于筆者醫院的癲癇患兒32例作為研究組,男童14例,女童18例,年齡(20.44 ±11.26)個月(3~36個月),病程1周~33個月。癲癇診斷參照國際抗癲癇聯盟2010癲癇和癲癇綜合征的分類診斷標準[7]。癲癇發作類型:部分性發作21例,全面性發作11例。視頻腦電圖檢查:正常腦電圖2例,1例 Rolandic區大量放電,其余為少量尖波、尖慢波;影像學檢查:頭顱MRI示結構性改變2例,其中結節性硬化1例,大腦皮層發育不良1例。患兒均服用奧卡西平、丙戊酸鈉等抗癲癇藥物治療。
另收集同期初診尚未開始治療的癲癇患兒22例作為對照組,男童11例,女童11例,年齡(18.09±10.12)個月(3~36個月),病程1~7 d。兩組患兒還需符合下列標準:(1)從出生后10 d~2歲均規則服用維生素D 400 IU/d;(2)研究組使用抗癲癇藥物治療>1周,對照組病程<1周;(3)排除其他影響骨代謝的內分泌系統疾病(如佝僂病、骨發育不全、甲狀腺疾病以及嚴重的肝腎疾患等);(4)正常飲食和活動。本研究經筆者醫院倫理委員會批準,患兒監護人均知情同意。
1.2 方法
1.2.1 藥物治療 抗癲癇藥物如下:奧卡西平口服混懸液(曲萊,瑞士諾華制藥有限公司);丙戊酸鈉口服溶液[德巴金,賽諾菲(杭州)制藥有限公司];左乙拉西坦口服溶液[開浦蘭,優時比(珠海)制藥有限公司];托吡酯片(妥泰,西安楊森制藥有限公司)。研究組進一步分層:根據用藥時間的長短分為≤1 a組及>1 a組;根據用藥的種類分為單藥治療組(只使用上述藥物中的1種)及多藥治療組(使用≥2種上述藥物,聯用≥1個月)。藥物劑量根據說明書使用,用藥時間1周~33個月,中位數為4個月。單藥治療組進一步進行亞組分析,根據所服用藥物分為丙戊酸鈉組和奧卡西平組,而左乙拉西坦及托吡酯單藥治療患兒例數少,未再進行亞組分析。
1.2.2 采集血清樣本 患兒于清晨采集空腹靜脈血3 mL,室溫靜置后于3 000 r/min下離心10 min,留取血清樣本,置于-20 ℃冰箱中保存備用。
1.2.3 骨代謝生化指標 總1型膠原氨基端延長肽(total N-terminal propeptide of type 1 procollagen,TP1NP)、β膠原降解產物(β-collagen specific sequences,β-CTX)、25羥基維生素D(25-hydroxy-vitamin D,25-OHD)、N端骨鈣素(N-terminal midfragment of osteocalcin,NMID)的檢測采用電化學發光法進行。
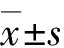
2 結 果
2.1 骨代謝指標比較 兩組患兒血清中的TP1NP、β-CTX和25-OHD水平比較,差別均無統計學意義(P>0.05),但研究組的NMID水平較對照組高,差別有統計學意義(P=0.01,表1)。
2.2 抗癲癇藥物不同療程對骨代謝的影響 ≤1 a組(25例)與>1 a組(7例)的β-CTX、25-OHD和NMID水平差別均無統計學意義(P>0.05),兩組間的TP1NP水平差別有統計學意義(P=0.03,表1)。
2.3 單藥治療組與多藥治療組骨代謝指標比較 單藥治療組23例,男童8例,女童15例,年齡(20.04±11.49)個月,用藥時間中位數4個月;多藥治療組9例,男童6例,女童3例,年齡(21.44±11.25)個月,用藥時間中位數6個月。兩組在性別、年齡、用藥時間上差別無統計學意義(P>0.05);兩組的TP1NP、β-CTX、25-OHD、NMID水平差別均無統計學意義(P>0.05,表1)。
2.4 丙戊酸鈉組與奧卡西平組骨代謝指標比較 丙戊酸鈉組13例,男童4例,女童9例,年齡(22±10.99)個月,用藥時間中位數4個月;奧卡西平組7例,男童2例,女童5例,年齡(15.86 ±11.94)個月,用藥時間中位數8個月。兩組在性別、年齡、用藥時間上無明顯差異;兩組的TP1NP、25-OHD、NMID水平比較,差別無統計學意義(P>0.05),但丙戊酸鈉組的β-CTX較奧卡西平組高(P<0.05,表1)。
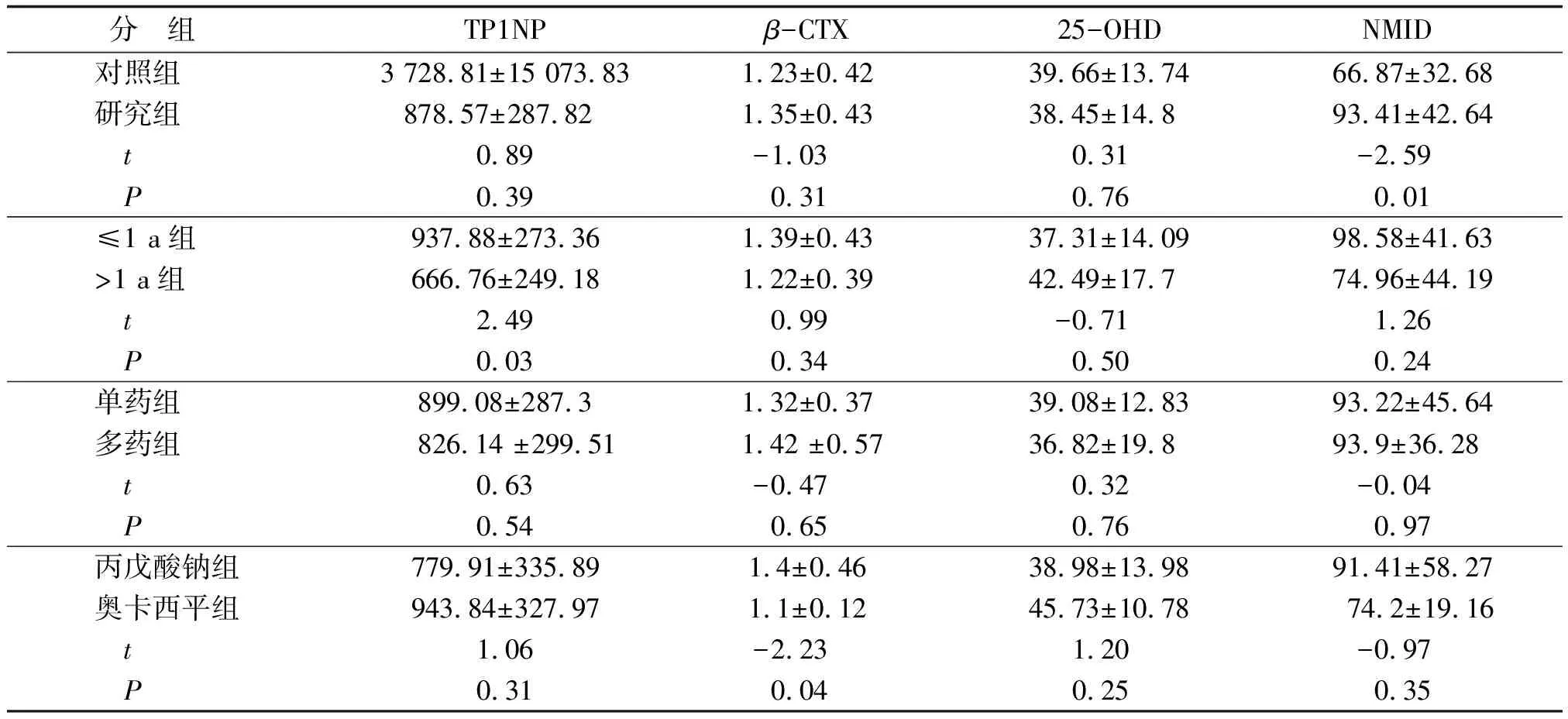
表1 不同分組組間骨代謝指標比較
3 討 論
癲癇是小兒神經系統的常見疾病之一,首選抗癲癇藥物治療。但抗癲癇藥物已被證實與兒童和青少年的骨密度降低有關[8],而兒童生長發育相關的身高、體質量、營養和認知狀況與骨代謝密切相關[9]。抗癲癇藥物的使用是癲癇兒童維生素D缺乏和骨骼健康受損的重要危險因素之一,建議對服用抗癲癇藥物治療的兒童進行骨代謝監測并補充維生素D[10]。維生素D缺乏也會影響嬰幼兒的骨發育或導致一些非骨代謝相關的疾病,如肌無力等[11-12]。
骨骼的形成是一個動態吸收和分解的過程,骨代謝相關指標中,TP1NP水平作為一個可靠的成骨標志物,反映了膠原合成的速度;NMID是骨鈣素中的穩定成分,主要負責維持正常的骨礦化速度;TP1NP及NMID是骨形成標志物;β-CTX是Ⅰ型膠原降解的特異性標志物,是骨吸收標志物[13];25-OHD是反應血中維生素D水平的敏感指標。這些骨轉化標志物均可用來監測骨形成和吸收的速度,是反應骨代謝的敏感指標[14]。
本研究發現,研究組的骨代謝指標TP1NP、β-CTX和25-OHD與對照組比較無明顯差異,但NMID水平較對照組明顯升高,提示其骨合成活躍,與文獻報道一致[15-17]。Papassava等[16]的研究發現,使用丙戊酸鈉、奧卡西平、拉莫三嗪等抗癲癇藥物治療的患者,NMID水平升高。鞠俊[15]的研究亦發現,拉莫三嗪單藥治療組與未治療組比較,NMID水平明顯升高,認為癲癇疾病本身可引起骨膠原類骨質骨架的代謝障礙,進而影響骨的礦化作用,故癲癇控制后,NMID水平升高。上述研究提示,抗癲癇藥物及癲癇疾病本身均可能影響患兒的NMID水平,進而影響骨代謝。
藥物的療程不同對骨代謝的影響可能不同。本研究顯示,使用抗癲癇藥物>1 a的嬰幼兒,其TP1NP水平降低,骨合成能力下降,提示抗癲癇藥物使用時間越長,對嬰幼兒骨代謝的影響越明顯。這與上述的抗癲癇藥物對兒童骨代謝影響的結果一致[18]。癲癇是慢性疾病,需長期使用癲癇藥物治療,故對長期用藥的嬰幼兒需注意監測和評估骨代謝指標。
除藥物療程外,藥物種類的多寡對骨代謝的影響亦可能存在差異。既往研究發現,多藥治療的患兒骨密度降低的風險較單藥治療的患兒明顯升高[19-20]。Saket等[21]的研究發現,多藥治療的患者25-OHD水平明顯下降。本研究顯示,單藥或多藥治療對嬰幼兒骨代謝的影響并沒有差異,可能與多藥治療組的病例數較少有關。
另外,不同藥物對骨代謝的影響也不同。丙戊酸鈉是傳統的抗癲癇藥物,可能通過直接激活孕烷X受體途徑增加了CYP24A和CYP3A4的基礎和維生素D誘導的表達,導致維生素D分解代謝,從而降低其活性,對骨代謝產生影響[16]。多數研究認為,丙戊酸鈉會影響骨代謝,導致骨密度降低,甚至骨折等[6,22]。奧卡西平是新型的抗癲癇藥物,對骨代謝是否有影響仍存在爭議。部分研究認為,奧卡西平能夠降低血液中的25-OHD及鈣離子,影響骨吸收[2,23];另一些研究認為,奧卡西平對骨代謝沒有影響[5,15]。本研究發現,與奧卡西平組比較,丙戊酸鈉組的β-CTX水平較高,提示丙戊酸鈉組較奧卡西平組骨吸收更為活躍,說明丙戊酸鈉對骨代謝影響更為明顯。
本研究納入的對象主要為嬰幼兒,受到年齡限制,且多數患兒的病程及服用藥物時間均較短,無法深入評估病程及藥物療程對骨代謝的影響,但以抗癲癇治療1 a為界,已發現其骨合成能力受影響。為了嚴格控制補充維生素D對骨代謝的影響,僅納入完全按嬰幼兒保健要求補充維生素D的患兒,病例來源受限,病例數較少,有待將來大樣本的病例對照研究進一步明確。

