鈷納米顆粒誘導(dǎo)PC12細(xì)胞凋亡及氧化應(yīng)激
李 勁,王俊翔,羅周嵩,鄭馥荔,吳思英,李煌元
環(huán)境因素如重金屬等的暴露能夠引起氧化應(yīng)激,導(dǎo)致神經(jīng)系統(tǒng)損害,加劇神經(jīng)退行性疾病的發(fā)生發(fā)展[1-2]。研究發(fā)現(xiàn),鈷納米顆粒(cobalt nanoparticles, Co-NPs)可能通過多種途徑暴露,誘導(dǎo)細(xì)胞發(fā)生氧化應(yīng)激,促進(jìn)細(xì)胞凋亡,對人體產(chǎn)生神經(jīng)損害[3-8]。本研究擬采用大鼠嗜鉻細(xì)胞瘤細(xì)胞PC12作為體外模型,通過檢測Co-NPs染毒后的神經(jīng)損害作用、氧化應(yīng)激指標(biāo)變化、核因子類紅細(xì)胞2相關(guān)因子2(nuclear factor erythroid 2 related factor 2, NRF2)/血紅素加氧酶(heme oxygenase-1, HO-1)抗氧化信號通路的激活及NRF2特異性激活劑(tert-butylhydroquinone,tBHQ)預(yù)處理,探討Co-NPs對神經(jīng)細(xì)胞的毒效應(yīng)及氧化應(yīng)激作用,為評估Co-NPs的神經(jīng)毒性提供依據(jù)。
1 材料與方法
1.1 材料
1.1.1 試劑 Co-NPs(中國阿拉丁生化科技股份有限公司),處理與表征方法及結(jié)果見文獻(xiàn)[9]。Co-NPs平均粒徑為96 nm。zeta電位14.9 mV,多分散指數(shù)為0.471。Co-NPs在水溶液中鈷離子12 h 的釋放率為1.52‰,24 h為1.75‰。DMEM高糖細(xì)胞培養(yǎng)基、胎牛血清及抗生素(美國Gibco公司);Hoechst33258染料(中國碧云天生物技術(shù)有限公司);CCK8試劑盒(中國白鯊生物科技有限公司);丙二醛(malondialdehyde, MDA)、谷胱甘肽(glutathione, GSH)、谷胱甘肽過氧化物酶(glutathione peroxidase, GSH-Px)試劑盒(中國南京建成生物工程研究所);Annexin V/7-AAD(美國BD公司);甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)、NRF2、HO-1抗體(美國Abcam公司);tBHQ(美國MCE公司)。
1.1.2 儀器 倒置顯微鏡(CK40-F200 BH-2型,日本OLYMPUS公司);生物成像系統(tǒng)(Tanon 4100型,上海天能公司);垂直電泳槽、電泳儀、轉(zhuǎn)印槽(美國Bio-Rad公司);酶標(biāo)儀(Spectra Max 190型,美國Molecular Devices公司);流式細(xì)胞儀[FACSCanto(TM)Ⅱ型,美國BD公司]。
1.2 方法
1.2.1 細(xì)胞培養(yǎng) PC12細(xì)胞來自大鼠的嗜鉻細(xì)胞瘤(中國科學(xué)院上海細(xì)胞庫),置于含10%胎牛血清、雙抗(青霉素100 U/mL,鏈霉素100 mg/L)的DMEM高糖細(xì)胞培養(yǎng)基中培養(yǎng)(37 ℃,體積分?jǐn)?shù)為0.05的 CO2培養(yǎng)箱),生長至對數(shù)生長期時(shí)種板。
1.2.2 Hoechst 33258染色 細(xì)胞鋪于6孔板中。100、200 μmol/L Co-NPs處理24 h后,加入Hoechst3325染色液染色,使用熒光倒置顯微鏡觀察細(xì)胞凋亡。每孔選擇5個(gè)視野統(tǒng)計(jì)凋亡數(shù)目。
1.2.3 Annexin V/7-AAD染色 細(xì)胞鋪于6孔板中。100、200 μmol/L Co-NPs處理 24 h 后,加入Annexin V/7-AAD染色液染色,使用流式細(xì)胞儀檢測細(xì)胞凋亡情況。
1.2.4 MDA、GSH及GSH-Px含量檢測 細(xì)胞鋪于60 mm培養(yǎng)皿。100、200 μmol/L Co-NPs處理24 h后收集細(xì)胞,按照操作說明檢測MDA、GSH及GSH-Px含量。
1.2.5 蛋白印跡法(Western-blot) 細(xì)胞接種于6孔板中。100、200 μmol/L Co-NPs 處理24 h后,將細(xì)胞刮下并移至1.5 mL離心管中,12 000×g離心10 min,收集上清液。取一部分蛋白進(jìn)行BCA蛋白定量,其余加入蛋白上樣緩沖液,100 ℃加熱10 min 后置于-20 ℃?zhèn)溆谩H?0~30 μg蛋白,100 V 電壓下10%聚丙烯酰胺凝膠進(jìn)行蛋白分離。將分離后的蛋白轉(zhuǎn)移至PVDF膜上,5%脫脂奶粉封閉1.5 h,以奶粉稀釋后的GAPDH、NRF2、HO-1(1∶1 000)一抗4 ℃孵育過夜。使用1×TBST清洗孵育過的條帶后,二抗孵育1.5 h,使用1×TBST清洗,并用ECL顯影液顯影并曝光。曝光后的條帶采用Image J軟件進(jìn)行分析。
1.2.6 CCK8實(shí)驗(yàn) 細(xì)胞鋪于96孔板中。40 μmol/LtBHQ不處理或預(yù)處理24 h后加入100、200和400 μmol/L Co-NPs處理24、48 h。將培養(yǎng)基換成含10%CCK8反應(yīng)液的DMEM培養(yǎng)基,37 ℃反應(yīng)30 min,置于酶標(biāo)儀上檢測。
1.3 統(tǒng)計(jì)學(xué)處理 數(shù)據(jù)采用 SPSS 19.0軟件進(jìn)行分析。多組間比較采用one-way ANOVA進(jìn)行顯著性檢驗(yàn),多組間兩兩比較采用LSD法進(jìn)行顯著性檢驗(yàn)。P<0.05為差別具有統(tǒng)計(jì)學(xué)意義。
2 結(jié) 果
2.1 Co-NPs誘導(dǎo)PC12細(xì)胞凋亡 Co-NPs處理PC12細(xì)胞24 h后,Hoechst33258染色顯示,100、200 μmol/L 劑量組細(xì)胞凋亡水平分別升高14和24倍(P<0.05,圖1A)。Annexin V/7-AAD染色顯示,100、200 μmol/L劑量組細(xì)胞凋亡水平分別升高15和19倍(P<0.05,圖1B)。
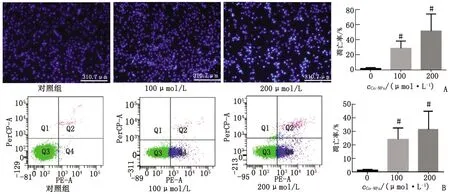
n=3。Co-NPs:鈷納米顆粒。A:使用Hoechst33258染料進(jìn)行染色觀察細(xì)胞凋亡水平(×100);B:使用Annexin V/7-AAD染料進(jìn)行染色觀察細(xì)胞凋亡水平。與對照組比較,#:P<0.05。
2.2 Co-NPs誘導(dǎo)PC12細(xì)胞發(fā)生氧化應(yīng)激 Co-NPs 處理PC12細(xì)胞24 h后,200 μmol/L劑量組的細(xì)胞內(nèi)MDA水平升高4倍(P<0.05)。100、200 μmol/L劑量組GSH蛋白含量分別降低14和9 μmol/g(P<0.05)。100、200 μmol/L劑量組GSH-Px分別升高1.5和2.5倍(P<0.05,圖2)。
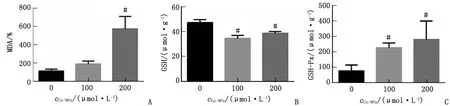
n=3。Co-NPs:鈷納米顆粒;MDA:丙二醛;GSH:谷胱甘肽;GSH-Px:谷胱甘肽過氧化物酶。A:Co-NPs處理后MDA含量變化;B:Co-NPs處理后GSH含量變化;C:Co-NPs處理后GSH-Px含量變化。與對照組比較,#:P<0.05。
2.3 PC12細(xì)胞NRF2和HO-1蛋白表達(dá)水平升高 Co-NPs處理PC12細(xì)胞24 h后,100、200 μmol/L劑量組NRF2蛋白表達(dá)水平分別升高2.7和2.9倍(P<0.05);200 μmol/L劑量組的HO-1蛋白表達(dá)水平升高1倍(P<0.05,圖3)。
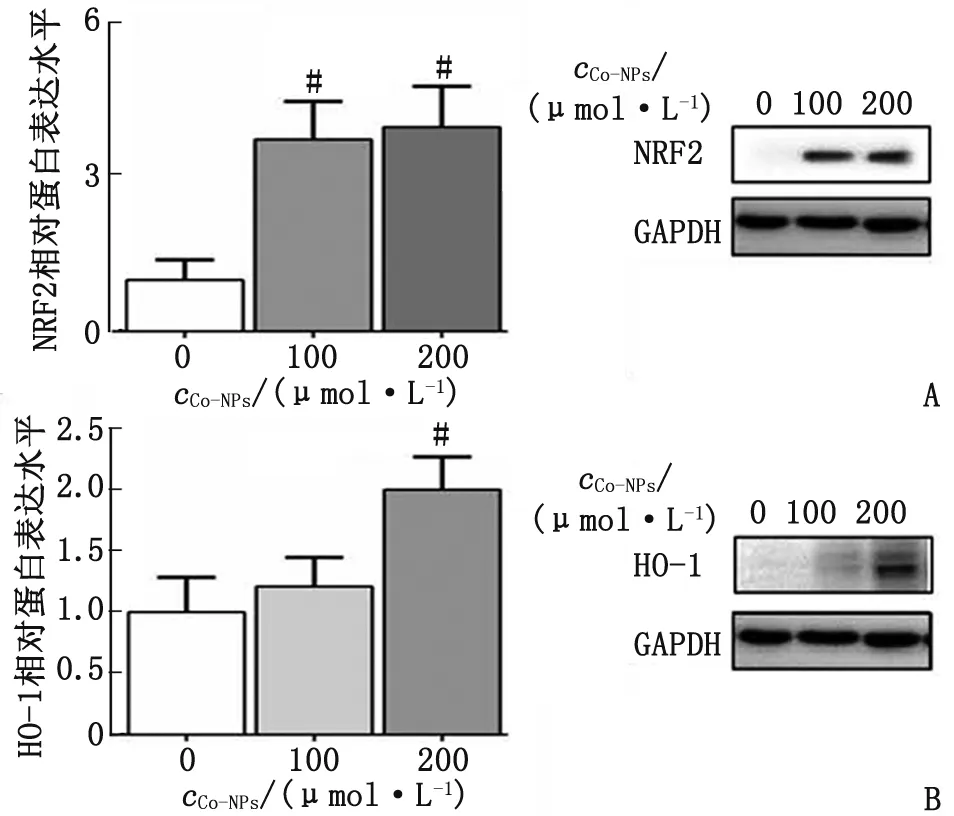
n=3。Co-NPs:鈷納米顆粒。NRF2:核因子類紅細(xì)胞2相關(guān)因子2;HO-1:血紅素加氧酶。A:NRF2蛋白表達(dá)水平;B:HO-1蛋白表達(dá)水平。與對照組比較,#:P<0.05。
2.4tBHQ恢復(fù)Co-NPs引起的PC12細(xì)胞活力下降 100、200和400 μmol/L Co-NPs處理PC12細(xì)胞24 h后,細(xì)胞活力分別下降了18%、37%和64%(P<0.05);100、200和400 μmol/L Co-NPs處理PC12細(xì)胞48 h后,細(xì)胞活力下降了66%、75%和85%(P<0.05)。預(yù)處理tBHQ后,細(xì)胞活力得到恢復(fù)(P<0.05)(圖4)。
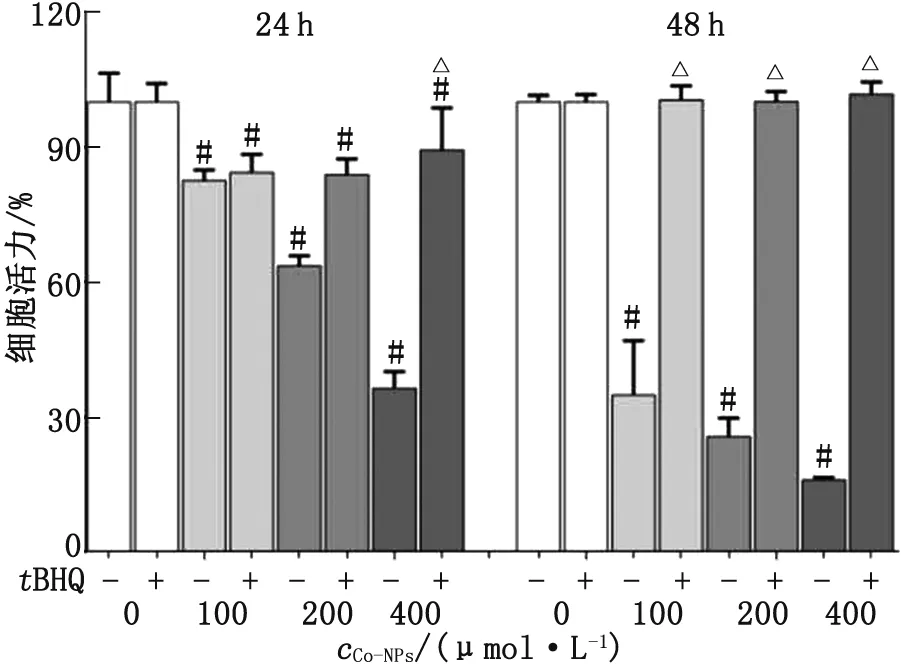
Co-NPs:鈷納米顆粒;tBHQ:特丁基對苯二酚。與對照組比較,#:P<0.05;與Co-NPs處理組比較,△:P<0.05。
3 討 論
鈷及其納米顆粒性質(zhì)穩(wěn)定,耐高溫和腐蝕,同時(shí)還具有高磁性,因而廣泛應(yīng)用于人工合金假體、新能源電池、航空航天以及油漆顏料等多個(gè)方面。研究發(fā)現(xiàn),人腦中可以檢測出環(huán)境中暴露的鈷相關(guān)納米顆粒[5],提示鈷及其納米顆粒可能通過職業(yè)暴露[10]、環(huán)境暴露[11]、醫(yī)源性暴露[4]等途徑作用于人體,從而發(fā)揮其毒性效應(yīng)。課題組前期的研究發(fā)現(xiàn),Co-NPs可致大鼠神經(jīng)系統(tǒng)損害效應(yīng)[9]。為進(jìn)一步闡明Co-NPs的神經(jīng)毒性及可能的機(jī)制,本研究利用PC12細(xì)胞建立Co-NPs暴露的體外模型。PC12細(xì)胞源自大鼠的嗜鉻細(xì)胞瘤,具有神經(jīng)內(nèi)分泌細(xì)胞的一般特征,同時(shí)具有可傳代的特點(diǎn),高度分化的PC12細(xì)胞具有神經(jīng)元的特性,因此,廣泛應(yīng)用于神經(jīng)生理和神經(jīng)藥理學(xué)研究[12]。本研究發(fā)現(xiàn),Co-NPs處理后,PC12細(xì)胞發(fā)生細(xì)胞凋亡,且氧化應(yīng)激指標(biāo)改變[13],表現(xiàn)為GSH-Px生成增多,催化GSH變?yōu)镚SSH,使前者含量減少;另一方面,Co-NPs也激活了NRF2/HO-1通路,NRF2的表達(dá)升高,促進(jìn)其靶基因HO-1蛋白表達(dá)。
鈷可引起氧化應(yīng)激,并激活NRF2相關(guān)通路[2]。NRF2發(fā)揮著細(xì)胞抗氧化的功能,與細(xì)胞氧化應(yīng)激和凋亡密切相關(guān)[14],能夠調(diào)控一系列抗氧化劑響應(yīng)元件依賴性基因的基礎(chǔ)表達(dá)和誘導(dǎo)表達(dá),包括抗氧化劑蛋白和Ⅱ期解毒酶,如HO-1[15]。NRF2調(diào)控靶基因參與保護(hù)細(xì)胞免受氧化劑和炎癥性物質(zhì)的破壞,維持線粒體功能、細(xì)胞氧化還原和蛋白質(zhì)穩(wěn)態(tài)[16],而NRF2/HO-1作為經(jīng)典的氧化應(yīng)激通路[2],參與多種疾病的發(fā)生發(fā)展[17]。本研究結(jié)果表明,Co-NPs處理后,PC12細(xì)胞中MDA、GSH-Px含量升高,而GSH含量降低,說明氧化應(yīng)激在Co-NPs致PC12細(xì)胞損害中發(fā)揮作用。此外,Co-NPs處理能夠引起PC12細(xì)胞NRF2及HO-1蛋白表達(dá)增多。NRF2的激活會導(dǎo)致抗氧化劑HO-1的表達(dá)增加,其與神經(jīng)元細(xì)胞損傷修復(fù)密切相關(guān)[18]。采用抗氧化劑暨NRF2激活劑tBHQ處理,發(fā)現(xiàn)tBHQ能夠緩解Co-NPs引起的細(xì)胞毒性,使細(xì)胞活性部分回升。上述結(jié)果說明,Co-NPs處理PC12細(xì)胞后,由于應(yīng)激,細(xì)胞內(nèi)源性的NRF2/HO-1抗氧化通路被激活,但仍然不足以逆轉(zhuǎn)Co-NPs導(dǎo)致的PC12細(xì)胞損傷,導(dǎo)致PC12細(xì)胞凋亡。在此基礎(chǔ)上,加入tBHQ進(jìn)一步激活NRF2,可緩解由Co-NPs 引起的PC12細(xì)胞活力下降,在Co-NPs處理48 h組中,細(xì)胞活力回升更加明顯,說明NRF2/HO-1通路的激活可幫助PC12細(xì)胞抵御Co-NPs所致的神經(jīng)損害。
綜上所述,Co-NPs能誘導(dǎo)PC12細(xì)胞發(fā)生凋亡和氧化應(yīng)激,同時(shí)應(yīng)激性激活NRF2/HO-1信號通路,而NRF2的激活可幫助細(xì)胞抵御Co-NPs所致的神經(jīng)毒性,為Co-NPs暴露引起神經(jīng)損害的機(jī)制研究提供依據(jù)。

