炎性因子及超聲應變技術對左心室重構預測研究
邵楊歌 尹德錄 趙新華 劉 琨 陳心怡 李群星
左心室重構(left ventricular remodeling,LVR)是非ST段抬高型急性冠脈綜合征(non-ST-segment elevation acute coronary syndrome,NSTE-ACS)患者的主要病理轉歸之一。LVR被認為是心力衰竭發生的獨立預測因素,同時是影響患者預后的主要因素之一[1]。早期識別LVR對疾病的有效診治具有重要意義。新型冠脈炎性標志物及超聲應變技術的發展為預測LVR提供新的途徑。中性粒細胞明膠酶相關脂質運載蛋白(neutrophilic gelatase-associated lipid carrier proteins,NGAL)、白介素-37(interleukin-37,IL-37)是近年來新發現的冠脈炎性因子,其在預測心血管不良事件方面具有重要價值[2, 3]。二維斑點追蹤超聲技術(two-dimensional speckle tracking echocardiography,2D-STE)測定的左心室分層整體縱向應變(global longitudinal strain,GLS)能夠定量評估不同層面的心肌力學功能,對NSTE-ACS的病情評估及預后判斷均有優異表現[4]。既往對LVR的研究多局限于ST段抬高型急性冠脈綜合征,對于NSTE-ACS的研究較少。本研究旨在探討NGAL、IL-37及2D-STE測定的心肌分層整體縱向應變之間關系及其在預測NSTE-ACS患者發生LVR方面的價值,為臨床對NSTE-ACS病情評估及預后判斷提供合適參考指標。
對象與方法
1.研究對象:選取2019年4月~2020年7月入住筆者醫院心內科因初發NSTE-ACS 并行經皮冠狀動脈介入治療(percutaneous coronary intervention,PCI)的135例患者, NSTE-ACS診斷標準依據中華醫學會2016年發布的《非ST段抬高型急性冠脈綜合征診斷與治療指南》[5]。排除患者:①左主干病變、既往陳舊性心肌梗死、冠心病介入治療史、心律失常、心源性休克、合并先天性心臟病、嚴重心臟瓣膜病、心肌病等;②腦血管病、下肢動脈狹窄或閉塞癥患者;③近1個月內服用過他汀類及阿司匹林、ADP受體抑制劑等藥物;④合并嚴重貧血、感染、肝、腎功能不全、惡性腫瘤、自身免疫性疾病等患者。所有患者行PCI治療后均規范接受指南推薦的藥物治療,隨訪6個月,定義PCI術后6個月左心室舒張末期容積(left ventricular end-diastolic volume,LVEDV)較入院時增加大于15%為LVR[6]。隨訪的135例患者中有8例失訪,2例死亡,最終入選患者共125例,患者平均年齡63.24±10.99歲,其中男性99例(70.4%)。本研究得到徐州醫科大學附屬連云港醫院醫學倫理學委員會的批準。
2.一般資料及常規指標獲取:患者入院當天收集病史資料,完善心電圖、超聲心動圖、腎功能、心肌酶譜、肌鈣蛋白、NT-proBNP等檢測。計算體重指數,GRACE評分,GRACE具體評分標準參照Everett等[7]計算方案。入院第2天空腹抽血測定患者超敏C反應蛋白(hs-CRP)、糖化血紅蛋白(HbA1c)、總膽固醇、甘油三酯、高密度脂蛋白膽固醇、低密度脂蛋白膽固醇等。以上檢測項目均由筆者醫院檢驗科按照相關規范進行測定。
3.炎性標志物檢測:所有患者入院第2天采用含有分離膠及促凝劑的黃色真空采血管采集空腹靜脈血4ml。以3500r/min離心5min,收集上清液放入-80℃冰箱保存。標本收集完成后統一測定NGAL、IL-37。NGAL、IL-37通過外購深圳欣博盛生物有限公司的ELISA試劑盒測定,所有炎性因子測定均嚴格按照說明書執行。
4.冠狀動脈造影檢查:患者入院第2天采集血液標本后,采用Judkins法穿刺右側橈動脈,美國GE公司心血管造影機行選擇性多體位左右冠脈造影檢查。依據病變部位及狹窄程度計算Gensini評分,具體標準參照Rampidis等[8]制定的Gensini積分指南。主支血管狹窄≥50%定義為病變血管,PCI策略和支架選擇由術者根據病情決定,當罪犯血管明確時僅對罪犯血管行PCI治療,當無法判定罪犯血管時,選擇對多支供血的重要血管進行PCI治療。
5.超聲心動圖檢查:患者入院當天,采用彩色多普勒超聲診斷儀(Philips,IE33,荷蘭),S5.1探頭,完善常規心臟超聲檢查,以雙平面辛普森法測量左心室射血分數(left ventricular ejection fraction,LVEF)和LVEDV,并額外收集受試者心尖四腔、三腔、二腔左心室長軸切面的3個心動周期圖像用來分析左心室心肌縱向應變。圖像分析:使用QLAB 9.0軟件計算左心室縱向分層應變,選擇分析心尖四腔、三腔、二腔左心室長軸切面的心肌范圍,勾畫出心肌內膜邊界,對顯影不佳的節段進行手動微調,然后通過軟件自動測量出整個左心室心肌心內膜心肌整體縱向應變[GLS(內)],中層心肌整體縱向應變[GLS(中)],心外膜心肌整體縱向應變[GLS(外)]。計算跨壁階差:△GLS=GLS(內)-GLS(外)。6個月后,對隨訪患者復查常規心臟彩超。冠脈造影及心臟超聲測量結果均有兩位年資相近的副高級職稱以上醫生進行計算,取其均值。
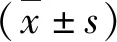
結 果
1.兩組病例臨床資料比較:本研究最終納入125例患者,LVR組共28例,患者年齡62.78±10.87歲,其中男性20例,女性8例,非ST段抬高型心肌梗死(non-ST-segment myocardial infarction,NSTEMI)18例,不穩定型心絞痛(unstable angina,UA)10例。Non-LVR組患者97例,患者年齡64.82±11.42歲,其中男性68例,女性27例,NSTEMI 41例,UA 56例。兩組患者的冠心病危險因素除了高血壓發生率有區別外,其余在年齡、性別、體重指數、心率、糖尿病及吸煙方面比較,差異均無統計學意義,并且兩組在用藥上也無顯著差別。LVR組NSTEMI罹患率、糖化血紅蛋白、炎性因子hs-CRP、NGAL、IL-37、心肌壞死標志物以及NT-proBNP均明顯高于Non-LVR組(P均<0.05);Non-LVR組LVEF、左心室各層GLS及△GLS絕對值與LVR組比較明顯增加(P均<0.01,表1)。

表1 Non-LVR與LVR組患者的臨床資料比較
2.NGAL、IL-37與分層GLS之間關系:Spearman相關分析發現,NSTE-ACS患者血清中NGAL和IL-37兩者之間無相關性(r=0.072,P=0.286)。NGAL與GLS(內)、GLS(中)、GLS(外)呈正相關(r分別為0.295、0.319、0.319,P均<0.01),與△GLS無相關性(r=0.111,P=0.023);IL-37與GLS(內)、GLS(中)、GLS(外)、△GLS均呈正相關(r分別為0.512、0.469、0.454、0.234,P均<0.01)。
3.預測LVR的多因素Logistic回歸分析:將表1中差異有統計學意義(P<0.05)的變量納入二分類多因素Logistic回歸分析,采取“后退法”篩選變量。最終納入指標有NT-proBNP、Hs-CRP、NGAL、IL-37、GLS(外)、△GLS以及病變血管支數。NGAL、IL-37、GLS(外)、△GLS是預測NSTE-ACS患者PCI術后發生LVR的獨立危險因子(OR值分別為1.477、1.004、2.145、4.255,P均<0.05,表2)。
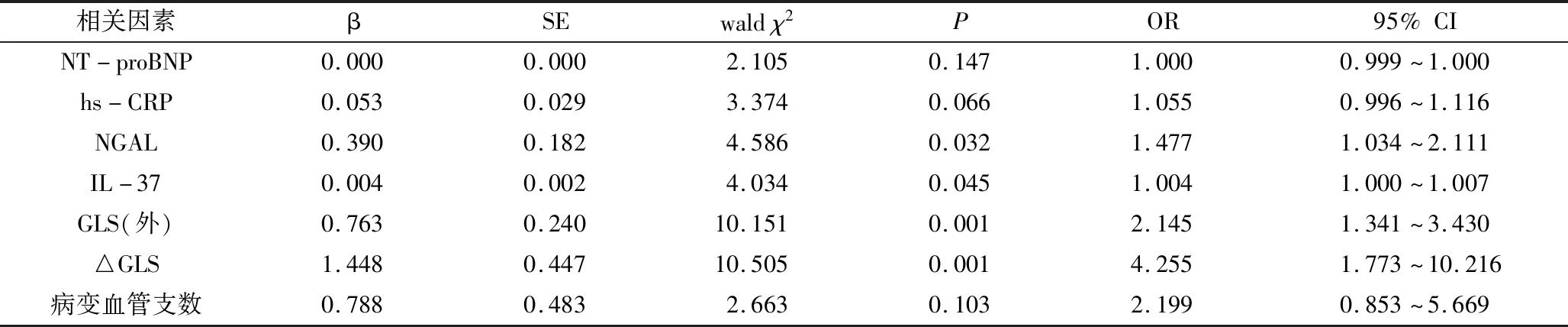
表2 預測LVR多因素Logistic回歸分析
4.NGAL、IL-37、GLS(外)、△GLS對LVR的預測價值:ROC曲線分析結果顯示,NGAL、IL-37、GLS(外)、△GLS對LVR均有較好的預測價值(AUC值分別為0.828、0.795、0.869、0.800,P均<0.01,表3)。其中GLS(外)預測LVR的效果最佳,當GLS(外)≥-13.95%預測LVR的敏感度和特異性分別為75.0%和84.5%(AUC=0.869,P=0.000)。NGAL、IL-37、GLS(外)、△GLS四者聯合檢測通過多因素Logistic回歸分析求得聯合預測因子,ROC曲線分析結果顯示,聯合檢測的AUC為0.943,與單一檢測的AUC比較(0.828、0.795、0.869、0.800),差異有統計學意義(P均<0.05),即聯合檢測效能優于單一檢測。
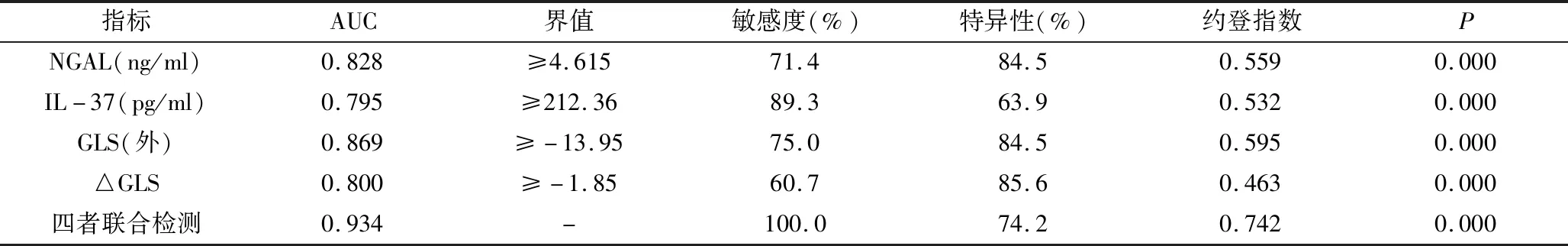
表3 NGAL、IL-37、分層GLS對LVR預測價值
討 論
左心室重構是NSTE-ACS患者的主要轉歸之一,心室重構越嚴重,患者死亡或心力衰竭住院風險越高。故早期預測和識別左心室重構對疾病的診治具有重要意義。本研究發現,NGAL、IL-37等新型冠脈炎性標志物及2D-STE測定的分層整體縱向應變是預測LVR的良好指標,并且兩者之間有相關性,表明在NSTE-ACS的急性發病期,炎性反應的增強可影響其心肌的收縮功能。
NGAL是一種由中性粒細胞分泌的小糖蛋白,能夠早期識別急性腎損傷和預測慢性腎臟病,其在心血管疾病中也具有重要應用價值[9]。在預測LVR方面,谷陽等[10]研究認為NGAL是ST段抬高型心肌梗死發生心室重構的影響因素。ROC曲線提示NGAL預測STEMI患者發生梗死后LVR的AUC值為0.855(P<0.05)。本研究發現,NGAL也是預測NSTE-ACS患者發生LVR危險因子,ROC曲線顯示NGAL預測LVR的AUC為0.828(P=0.000)。NGAL與心室重構發生的相關機制可能與金屬基質蛋白酶活性有關,NGAL能夠激活金屬基質蛋白酶,導致心肌基質重構,參與心力衰竭的發生[3, 11]。IL-37是白介素-1家族中的一種抗炎細胞因子,能夠抑制促動脈粥樣硬化的炎性因子的分泌,抑制樹突狀細胞和巨噬細胞的活化,具有抗動脈粥樣硬化作用[12]。既往研究顯示,IL-37與NSTE-ACS的疾病活動性有關,是預測其不良預后的優異指標[13, 14]。本研究發現,IL-37是NSTE-ACS患者行PCI治療后發生LVR的獨立危險因素,ROC曲線分析顯示,IL-37預測LVR的AUC為0.795(P=0.000)。IL-37參與LVR發生機制可能與IL-37的抗炎作用有關,IL-37可抑制過度炎性反應,降低促炎細胞因子、趨化因子和中性粒細胞浸潤,有助于減少心肌細胞凋亡和活性氧的產生,從而抑制左心室重構和心力衰竭的發生[13, 14]。
2D-STE測得的心肌應變能定量反應心肌形變程度,與心肌核素顯像、磁共振成像測量結果相仿,是評估心肌力學功能的理想指標[15]。縱向心肌纖維對心臟收縮起主要作用,分層GLS能夠獲取心室壁內、中、外3層心肌的縱向應變值,較全層GLS對心肌功能的評估更為精確[16]。Zhang等[17]研究發現,分層GLS能識別NSTE-ACS患者冠脈復雜病變以及預測心血管不良事件,其中GLS(內)表現效果最好。這是因為心內膜心肌數量最多,對心室收縮起主要作用,并且心內膜心肌距離心外膜冠脈供血最遠,更容易受到缺血、缺氧的影響,故對心肌缺血病理改變更加敏感。本研究發現在預測NSTE-ACS患者PCI術后LVR方面,GLS(外)、△GLS要優于GLS(內),Logistic回歸分析顯示GLS(外)、△GLS是LVR獨立危險因素,ROC曲線顯示,GLS(外)、△GLS對LVR均有較好預測價值,當GLS(外)≥-13.95%預測LVR的敏感度為75.0%,特異性為84.5%,△GLS≥-1.85%預測LVR的敏感度和特異性分別為60.7%和85.6%。GLS(外)預測LVR效果更好,這是因為GLS(外)受心肌缺血損傷的影響較小,并且心肌外膜的二維斑點追蹤比心肌內膜的可追溯性、可重現性更好[18]。而△GLS是預測LVR的獨立危險因素,是因為心肌缺血和壞死對功能影響是由心內膜向心外膜擴散, 且心內膜層損傷大于心外膜層,△GLS可以反映心肌損傷、壞死及纖維化的嚴重程度[19]。△GLS越小,心肌缺血、壞死及纖維化程度越重,故發生LVR可能性更大。
炎性標志物容易受到感染、藥物等影響,超聲心動圖對獲取圖像質量要求較高,將生物學標志物及影像學檢查聯合檢測,可以彌補各自不足,獲得更滿意效果。本研究將NGAL、IL-37、GLS(外)、△GLS四者聯合檢測,發現聯合檢測效能更優,AUC為0.934,與單一檢測AUC比較(0.828、0.795、0.869、0.800),差異有統計學意義(P均<0.05),即聯合檢測效果更優。
綜上所述,NGAL、IL-37與心肌分層GLS均是預測LVR較為理想指標,臨床上可合理選擇應用。當然,本研究也存在一些不足。首先各層心肌之間存在相互關聯,彼此相互影響,每層心肌不是完全孤立存在的。其次這是一項單中心研究,樣本量有限,隨訪時間相對較短,需要開展更大規模的研究和長期的隨訪予以證實。

