SD大鼠顱骨垂直引導骨再生模型的建立
張澤鵬 盧旭光
人工種植牙技術現已成為缺牙修復的首選治療方案。種植手術的成功依賴于足夠的牙槽骨能為種植體提供良好的初期穩定性,以確保種植體與牙槽骨能形成穩定的骨結合[1]。然而,拔牙后的骨改建、外傷、牙周炎、頜面部腫瘤等因素常會引起患者牙槽骨的吸收和缺損,導致牙槽骨寬度與高度的不足[2]。其中常用的骨增量技術如引導骨再生(guide bone regeneration,GBR)、骨劈開、游離塊狀骨移植術可有效恢復牙槽嵴寬度。但恢復牙槽骨高度是目前未能有效解決的問題[3~5]。一個合適的用于研究垂直骨增量植骨材料的動物模型對研究者評估新材料的生物相容性、成骨性非常必要。本研究成功構建了大鼠顱骨垂直引導骨再生模型,現介紹如下。
材料與方法
1.實驗動物:選用清潔級雄性SD大鼠24只,2月齡,體質量320g。動物來源于山西醫科大學實驗動物中心,動物生產許可證編號:SCXK(晉)2019-0005。該實驗由山西醫科大學實驗動物倫理學委員會批準(SYDL2020007)。
2.實驗材料:主要器械及藥物包括定制鈦殼(直徑10mm,高6mm的類圓柱體,頂部有圓孔,太原鋼鐵集團有限公司,圖1A),膨體型聚四氟乙烯(expanded-polytetrafluoroethylene,e-PTFE)膜[直徑12mm圓形,內面與鈦殼頂部肩臺對應部位設計有醫用雙面膠(型號3M1522)](深圳四維拓達科技有限公司),脫蛋白牛骨基質(deproteinized bovine bone matrix,DBBM,正海生物公司)。主要器械包括牙科打磨機,慢速彎機頭(深圳市益岳牙科器材有限公司),9mm、10mm 環形取骨鉆(英國百諾公司)。主要藥品包括戊巴比妥納(西安科昊生物有限公司),阿替卡因腎上腺素注射液(produits dentaires pierre rolland),青霉素(北京索萊寶有限公司)等。
3.模型建立的手術過程:將大鼠隨機分為兩組,即支架組和空白組(每組12只)。適應性喂養1周后進行實驗。實驗前對手術器械,鈦殼等清洗后進行高溫高壓蒸汽滅菌處理。大鼠禁食6h后,稱重,腹腔注射戊巴比妥鈉(40mg/kg)麻醉大鼠。大鼠頭部剃毛,消毒,使用無菌記號筆在術區設計U型瓣。阿替卡因進行皮下注射,局部鎮痛。使用顯微眼科剪沿著標記做U型瓣,翻開的皮瓣用無菌0.9%氯化鈉溶液潤濕的紗布包裹置于大鼠頸部。骨膜剝離器去除大鼠顱骨中央偏頸部的部分骨膜。在無菌0.9%氯化鈉溶液的沖洗下,使用10mm環形取骨鉆在大鼠顱骨做一環形骨裂隙,深度0.5mm。在無菌0.9%氯化鈉溶液的沖洗下,使用裂鉆在骨裂隙內部做數個皮質骨穿孔,深度控制在剛好可以誘導出血,但不傷及大鼠硬腦膜。將鈦殼放置在環形骨裂隙中,通過中央小孔填充DBBM(支架組)。e-PTFE膜封閉中央小孔,縫合。縫合后大鼠局部涂抹紅霉素軟膏進行局部抗菌處理。術后連續3天大鼠腹腔注射青霉素(80000U/d)預防感染。手術過程詳見圖1。

圖1 大鼠顱骨垂直引導骨再生模型的構建過程A.鈦殼外形;B.剃毛,消毒,紅線代表耳緣和眼眶緣內側,與皮瓣位置距離1cm左右;C.翻瓣,去除骨膜,制備環形骨裂隙;D.環形骨裂隙位置,黑線為兩耳前緣連線;E.皮質骨穿孔;F.放置鈦殼,填充植骨材料;G.e-PTFE膜封閉小孔;H.縫合
4.術后觀察:手術后嚴密觀察大鼠傷口愈合情況。術后3、7、14天對大鼠顱骨鈦殼部位輕輕觸診,并記錄鈦殼松動情況。持續對大鼠軟組織進行觀察,并記錄情況。術后12周,腹腔注射過量戊巴比妥納安樂死大鼠,取材。無菌0.9%氯化鈉溶液沖洗后,標本放入4%多聚甲醛溶液中固定24~48h。取出樣本,PBS沖洗3次,樣本放入75%乙醇溶液中4℃ 保存送檢。
5.Micro-CT掃描:將樣本置于SkyScan 1176(德國布魯克公司)的掃描球管中,固定,掃描。掃描參數如下,電壓65kV,電流385μA,曝光時間340ms,掃描分辨率12.59μm,步長0.800°。掃描數據進行三維重建,選取樣本中央直徑5mm、高度6mm的圓柱體為要分析的感興趣區域(region of interest,ROI)。對空白組和支架組ROI內的骨體積分數(bone volume fraction,BVF)進行分析。這里的骨體積分數定義為新骨體積/感興趣區總體積×100 (%)。
6.組織學和組織形態學分析:完成micro-CT掃描的樣本,梯度乙醇脫水,二甲苯透明,塑化液塑化,包埋,硬組織切片,厚度10μm。組織切片進行HE染色,染色后進行白光掃描,將圖形數據導入個人電腦,使用CaseViewer軟件觀察骨組織情況及拍照,Image-ProPlus 6.0軟件對樣本垂直骨高度(vertical bone height,VBH)進行測量。
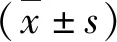
結 果
1.大體觀察結果:術后大鼠1h內相繼蘇醒,并飲食正常(圖2A)。術后對大鼠軟組織情況進行觀察并記錄,空白組(1只)和支架組(2只)共3只大鼠在術后3~8天內局部軟組織出現壞死,表現為結痂組織過多,皮膚緊縮嚴重,鈦殼暴露脫落。鈦殼脫落大鼠隨即排除。其余大鼠軟組織愈合情況良好,僅少量愈合性結痂組織(圖2B),術后兩周左右軟組織完全恢復并進行了明顯的適應性改建(圖2C)。術后3、7、14天對大鼠顱骨鈦殼部位輕輕觸診,評估鈦殼固位情況。除去軟組織壞死導致的鈦殼脫落,其余大鼠鈦殼均固定在設計位置。12周后取材,可見e-PTFE膜未脫落(圖3A),周圍皮膚未出現紅腫等炎性反應,鈦殼位于手術設計區域(圖3A)。空白組骨組織與鈦殼輕輕使用外力即可以分離,而支架組骨組織與鈦殼難以分離(圖3B),需借助9mm環形取骨鉆將樣本與鈦殼分離(圖3C)。

圖2 SD大鼠手術后軟組織愈合情況A.術后1h;B.術后7天拆線;C.術后14天

圖3 骨組織樣本情況A.鈦殼穩定在實驗設計區域;B.骨組織包裹鈦殼;C.骨組織樣本與鈦殼分離整體觀
2.Micro-CT分析:支架組micro-CT矢狀剖面圖4可見,鈦殼固定在手術設計部位,未發生移位,且鈦殼內面與新骨組織結合緊密。支架組的BVF為41.05%±5.04%,顯著大于空白組22.75%±5.77%(P=0.000)。

圖4 Micro-CT掃面樣本示意圖A.空白組三維重建圖;B.支架組矢狀剖面圖;C.ROI示意圖,中央灰色部分為ROI
3.組織學觀察:組織切片觀察,空白組在此模型下有一定的成骨潛力。顱骨表面形成含有骨髓腔的松質骨(圖5A)。空白組垂直骨增量最高處位于樣本中央。新骨頂部覆蓋有結締組織,內有大量毛細血管(圖5B)。支架組樣本可見由骨組織,DBBM顆粒以及結締組織構成(圖5D)。新骨主要沉積在靠近基底骨附近,并與顱骨融合,難以與顱骨區分(圖5 C)。中部可觀察到結締組織包圍著DBBM顆粒,與DBBM顆粒接觸的界面有大量單核細胞,新骨組織無炎性反應。

圖5 HE染色圖A.空白組代表性切片(×15);B.A圖片中黑色方框區域(×1500);C. 支架組代表性切片(×10);D.C圖黑色方框區域(×1000);NB.新骨;CT.結締組織;DBBM.脫蛋白牛骨基質;黑色圓圈所示為毛細血管
4.組織形態學分析:支架組的VBH(2.27±0.31mm)略優于空白組(1.86±0.20mm,P=0.002,圖6)。

圖6 Micro-CT分析結果和組織形態學測量結果A.Micro-CT分析結果;B.組織形態學測量結果;空白組n=11;支架組n=10;*P<0.05
討 論
GBR即在骨缺損區使用屏障膜隔離上皮組織和結締組織,使成骨細胞在沒有其他細胞干預的情況下遷徙到骨缺損區并產生新骨[6]。本實驗基于GBR的原理構建大鼠顱骨垂直引導骨再生模型,通過使用具有隔絕周圍軟組織以及支撐顆粒材料的屏障外殼來模擬臨床上使用的屏障膜,可以為骨移植材料提供良好的成骨環境。從胚胎起源的角度來講,顱骨與頜骨具有相同的胚胎起源[7]。從愈合模式來講,顱骨與頜骨都是膜內成骨[8];從臨床轉化的角度來講,扁平的顱骨與重度萎縮的頜骨相似,因此可以選擇顱骨作為研究用于垂直骨增量植骨材料的實驗位點[9]。本實驗選用320g雄性SD大鼠作為實驗對象出于以下考慮:①對新材料或者新技術的初步探索,大鼠具有其他動物不可比擬的經濟優勢;②320g SD大鼠的顱骨較為平坦,可以選取較大范圍的植骨區域進行屏障殼的安放;③SD大鼠相比于其他品系,性格較為溫順,方便手術操作以及術后護理。
本實驗設計的屏障殼裝置為直徑10mm、高6mm、頂部開孔的類圓柱形鈦殼。通過將鈦殼放置在制備的環形骨裂隙上來防止其平行移動,通過頭部皮膚的張力進一步固定鈦殼。對術后大鼠觀察表明,在軟組織良好愈合的情況下,鈦殼不會發生移位。鈦殼頂部小孔用帶有醫用雙面膠的e-PTFE膜封閉。e-PTFE膜具有生物惰性,其表面小孔具有限制上皮細胞遷移的功能,臨床上常使用金屬加強型e-PTFE膜處理復雜的垂直骨增量手術[10,11]。對內部皮膚和骨組織切片的觀察證實醫用雙面膠與鈦殼肩臺相接觸,不會引起大鼠局部炎性反應。
本實驗鈦殼設計與Zigdon等[12]的外殼設計比較,簡化了屏障裝置的加工與制作,同時手術操作更為便捷,不需要額外的螺釘固位屏障裝置,同時頂部開孔設計方便了植骨材料的填充。類圓柱體設計與半球形屏障裝置比較,植骨材料能填充到均勻的高度,在后期容易比較成骨效果[13]。鈦殼與機體組織具有良好的生物相容性,支架組Micro-CT矢狀剖面圖可觀察到新骨沿著鈦殼壁生長,保證了實驗過程中鈦殼的穩定性。Lai等[14]設計了一種帶螺紋的自攻型鈦筒,并成功構建兔顱骨垂直骨增量模型。但大鼠顱骨較薄,此鈦筒設計不適用于大鼠顱骨模型的構建。本實驗在大鼠顱骨僅放置一個鈦殼,這是由于大鼠顱骨面積所限。對空白組樣本的觀察表明大鼠顱骨在此模型中有一定的自發垂直向成骨潛能,Zigdon等[12]開展的實驗也證實了這一點(空白組新骨高度可達1.52±0.18mm)。有實驗小組通過降低屏障裝置高度與直徑,每只大鼠接受兩個屏障裝置[15]。雖然能減少大鼠的使用數量,但過小尺寸的屏障裝置可能會被大鼠自身的成骨潛能所影響,不能客觀地比較不同生物材料的垂直成骨潛力。
綜上所述,本實驗成功構建了大鼠顱骨垂直引導骨再生模型,可操作性強,能客觀比較不同植骨材料的垂直骨成骨潛力,為研究垂直骨增量植骨材料的實驗奠定了基礎。

