低FODMAP飲食聯合美沙拉嗪對潰瘍性結腸炎大鼠腸道黏膜的作用
斯彩娟 章小艷 王衛光 周 鋒 張 倫
潰瘍性結腸炎(ulcerative colitis,UC)是一種慢性、非特異性腸道炎癥,西方發達國家發生率較高[1]。近年來,我國UC發生率呈逐年上升趨勢[2]。據統計我國UC發生率約為11.6/10萬[3]。UC病程遷延易復發,極易發生癌變,已成為引起結腸癌的主要原因之一,給社會及患者家庭帶來沉重的經濟負擔[4,5]。UC病因和發病機制尚不明確,但飲食因素在其發生、發展及治療過程中具有重要作用。近年來低FODMAP飲食在UC轉歸中的作用逐漸受到關注。但尚缺乏相關研究證據,本研究旨在探討低FODMAP飲食聯合美沙拉嗪對UC大鼠腸道黏膜炎性因子及通透性的作用。
材料與方法
1.實驗動物:雄性Wistar大鼠40只購自浙江大學醫學院動物實驗中心,SPF級,體質量210±10g,溫度22±2℃,自由攝取食物及飲水。
2.主要試劑:白介素-8(interleukin-8,IL-8)抗體、白介素-33 (interleukin-33, IL-33)抗體、腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)抗體、E-鈣黏蛋白(E-cadherin)抗體、閉合蛋白(occludin)抗體,均購自英國Abcam公司;閉合小帶蛋白-1(zonula occludens-1, ZO-1)抗體購自美國Proteintech公司;蘇木精、伊紅購自德國BASO公司。
3.造模:從40只雄性大鼠中隨機選取10只作為A組,其余30只利用TNBS灌腸法(5%TNBS與35%乙醇1∶1配成灌腸液)制作UC模型。造模前禁食36h,用灌胃針輕輕從肛門插入,推入灌腸液(100mg/kg TNBS),提尾倒立1min后放回籠中自然蘇醒,并常規飼養,建模第3天判斷造模是否成功,并開始給予相應干預措施。
4.干預及標本采集:造模成功后將UC大鼠隨機分為3組,即B、C、D組,并給予相應干預措施。A組、B組、C組飼料同前,均為SPF級鼠糧,包括小麥、玉米、麩皮、豆柏和酵母粉等;D組給予制備的低FODMAP鼠糧,包括大米、南瓜、小米、燕麥、土豆、白菜和葡萄糖等[6]。C組、D組均予以美沙拉嗪灌胃,劑量為0.5g/(kg·d)。干預治療周期12天,末次給藥后24h處死,取出每只大鼠結腸黏膜組織,挑取潰瘍最明顯處腸段,若無潰瘍則選取紅腫糜爛較明顯處腸段,沿縱軸切開,分為5份,進行相應處理,并保存待測。
5.DAI評價:記錄并統計造模后第3、4、7、10、15天各組大鼠的DAI,參照Murano等所列標準進行評分,DAI=(體質量下降分數+便性狀分數+便血分數)/3[7],詳見表1。

表1 DAI評分標準
6.病理組織學評分:制作大鼠結腸組織切片,光鏡下觀察病理改變并評分,在視野下隨機選8處評分并取均值,參照以下標準:正常腸黏膜計0分;少1/3隱窩計1分;少2/3隱窩計2分;固有層被單層上皮細胞覆蓋和較少的炎性細胞浸潤計3分;炎性細胞數量增多并有炎性細胞明顯浸潤計4分[8]。
7.大體標本評分:參照以下標準:無損傷為0分;黏膜充血為1分;潰瘍面積<受損面積的25%為2分;潰瘍面積=受損面積的25%~50%為3分;潰瘍面積>受損面積的50%為4分。
8.腸道黏膜炎性因子水平及通透性測定:提取大鼠結腸組織蛋白,-80℃保存待測。利用ELISA測定腸黏膜組織中IL-8、IL-33、TNF-α水平,采用Western blot法檢測E-cadherin、ZO-1、occludin的表達水平。
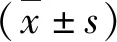
結 果
1.動物模型評價:建模前大鼠反應靈活,毛色光潤,活動、飲食及大小便均正常,建模后相繼出現稀爛便、黏液便、血便,伴倦怠懶動、反應遲鈍、毛發凌亂、拱背、飲食飲水減少、體重下降等現象。隨機選取2只大鼠,處死后取出結腸組織(肛門上段2~10cm)可見結腸明顯水腫、充血、潰瘍,病理切片提示結腸炎。
2.DAI結果比較:建模成功后(建模第3天),除A組外,其余各組大鼠DAI均顯著升高,差異有統計學意義(P<0.01),B、C、D組之間比較差異無統計學意義(P>0.05)。經治療后,A組和B組大鼠DAI均未發生明顯變化,治療組大鼠DAI均呈現下降趨勢,且D組下降趨勢更明顯。其中,造模第4天,治療組大鼠DAI略低于模型組大鼠,3組之間比較差異無統計學意義(P>0.05);造模第7、10、13、15天,治療組大鼠DAI均顯著低于B組,且D組均顯著低于C組,差異有統計學意義(P<0.05,圖1)。

圖1 大鼠DAI評分
3.HS和GS結果比較:B組大鼠結腸黏膜HS和GS較A組顯著升高,差異有統計學意義(P<0.01);治療后,治療組大鼠結腸黏膜HS和GS較模型組均顯著下降,且D組顯著低于C組,差異有統計學意義(P<0.05,表2)。
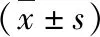
表2 大鼠病理組織學評分和大體標本評分
4.大鼠腸黏膜的組織病理學特征:A組大鼠的結腸切片完整,腺體分泌大量黏蛋白。B組大鼠結腸顯示出黏膜嚴重壞死,巨噬細胞和中性粒細胞浸潤及黏膜下層水腫;經治療后,C組大鼠腸黏膜糜爛顯著減少,黏膜下層輕微水腫,幾乎無炎性細胞浸潤;D組大鼠腸黏膜未顯示出明顯的病理學改變(圖2)。

圖2 大鼠結腸黏膜病理切片(HE,×200)A.健康對照組;B.模型組;C.普通飲食+美沙拉嗪組;D.低FODMAP飲食+美沙拉嗪組
5.炎性因子表達水平比較:B組大鼠IL-8、IL-33和TNF-α表達水平較A組顯著升高,差異有統計學意義(P<0.01);治療后,治療組大鼠IL-8、IL-33和TNF-α表達水平較B組顯著降低,且D組顯著低于C組,差異有統計學意義(P<0.05,表3)。
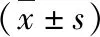
表3 大鼠結腸黏膜炎性因子水平
6.大鼠腸道黏膜通透性比較:B組大鼠腸黏膜E-cadherin、ZO-1和occludin的表達水平較A組顯著下調,差異有統計學意義(P<0.05);治療后,治療組大鼠腸黏膜中E-cadherin、ZO-1和occludin的表達水平較B組顯著上調,且D組與C組比較,差異有統計學意義(P<0.05,圖3)。

圖3 大鼠腸道黏膜通透性相關蛋白表達情況與A組比較,*P<0.01;與B組比較,#P<0.05;與C組比較,ΔP<0.05
討 論
近年來,飲食干預治療UC逐漸受到重視,尤其是低FODMAP飲食,已有研究證實低FODMAP飲食可以顯著改善腸易激綜合征患者臨床癥狀和體征,但低FODMAP飲食對UC的作用尚不清楚[9]。本研究結果表明低FODMAP飲食聯合美沙拉嗪治療UC可以有效促進腸道黏膜恢復,緩解其癥狀。這與相關人群研究結果一致,有研究顯示,利用低FODMAP飲食對胃腸道功能紊亂患者進行干預,可有效降低UC活動度,緩解其臨床癥狀[10~12]。
目前,普遍認為UC與免疫介導的炎性反應和腸道黏膜通透性增加相關。TNF-α是一類普遍存在的炎性細胞因子,作為UC發病過程中重要的啟動因子,在UC的發生、發展過程中具有重要作用,不僅可以引起局部組織的炎性反應,而且可以刺激機體相關細胞釋放多種促炎因子,其中,IL-8可通過趨化作用,并與TNF-α產生協同作用,導致結腸黏膜組織細胞浸潤增加,加重腸黏膜炎性損傷,大量研究顯示,TNF-α的表達水平與UC的嚴重程度具有明顯的線性關系[13,14]。IL-33可以通過作用于IL-33/ST2信號通路刺激機體產生多種炎性因子,促進腸道黏膜產生炎性反應,加重其損傷[15]。有研究表明,機體IL-33的表達水平與UC活動度呈正相關,可作為UC發病的預測因子[16]。而腸道黏膜通透性增加,可導致腸道菌群移位,破壞腸道穩態,引起炎性反應。同時,炎性反應又導致腸道黏膜通透性增加,形成惡性循環[17]。FODMAP飲食是一類可發酵的短鏈碳水化合物,包括可發酵的低聚糖、雙糖、單糖和多元醇,該類食物攝入過多不僅可以增加腸道黏膜通透性,導致腸腔內液體量增加和小腸體積擴張,引起腸道菌群移位,進而誘發或加重相關炎性反應;而且過多的低聚糖及乳糖,經腸道微生物發酵可產生大量氣體及正丁酸,引起腸腔擴張和內臟高敏感,導致炎性反應[18]。本研究建模后,B組大鼠腸道黏膜IL-8、IL-33和TNF-α表達水平較A組顯著上升,腸道黏膜通透性增加;經治療后,D組大鼠腸道黏膜中IL-8、IL-33和TNF-α表達水平顯著降低,腸道黏膜通透性得到改善,且效果優于C組。表明低FODMAP飲食聯合美沙拉嗪可以顯著降低UC大鼠結腸黏膜相關炎性因子的表達,改善腸道黏膜通透性。
綜上所述,低FODMAP飲食聯合美沙拉嗪治療UC大鼠可以提高其臨床療效,不僅可以改善其癥狀,促進結腸黏膜修復,而且可以顯著降低炎性因子表達水平,改善腸黏膜通透性,緩解其炎癥。其機制可能是:①低FODMAP飲食可通過促進腸黏膜上皮細胞VD受體及細胞間緊密連接蛋白表達,降低腸道黏膜通透性,減少菌群移位,減輕炎性反應[19];②低FODMAP飲食可通過減少組胺及結腸內氣體、液體的產生,降低內臟高敏感度,緩解相關癥狀[20~22];③低FODMAP飲食可以通過抑制NF-κB炎性信號轉導通路、增加T細胞生成而發揮其抗炎作用[23]。但目前關于其機制尚不明確,仍需要開展進一步研究予以證實。

