缺氧微環境調控肝細胞癌血管新生的研究進展
朱婷婷 程紫薇 邢東煒 張閩光
肝細胞癌(hepatocellular carcinoma,HCC)是全球第四大癌癥死亡原因[1]。在我國,超過60%的HCC患者確診時已為中晚期,治療選擇受限,預后較差[2]。血管新生是癌癥的十大特征之一,HCC作為一種高度血管化的實體腫瘤,血管新生在其發生、發展和轉歸中起著關鍵作用,如果沒有血管新生,HCC生長不會超過1~2mm。經導管動脈化學栓塞術(transcatheter arterial chemoembolization,TACE)是臨床上HCC最常用的治療方式,但其5年生存率僅為10%左右,其中重要的一個原因是HCC血管新生導致腫瘤向其他臟器的侵襲轉移。因此,腫瘤的血管新生也是HCC患者TACE臨床治療的最大障礙。
缺氧是血管新生最重要的刺激因素,血管新生本身就是腫瘤細胞對抗缺氧環境的一種反應。作為實體惡性腫瘤,HCC在短期內會迅速增大,而血管生長相對滯后,進一步導致瘤體組織和細胞的局部缺血、缺氧,這種局部缺氧微環境又進一步激活血管內皮生長因子(vascular endothelial growth factor,VEGF)等血管生成因子,啟動異常的血管新生程序。結構和功能異常的新生血管又加劇了以缺氧為特征的異常腫瘤微環境,形成惡性循環,促進HCC的發展與轉移。因此,本文就近年來缺氧微環境下,HCC血管新生的機制研究進行綜述(圖1)。
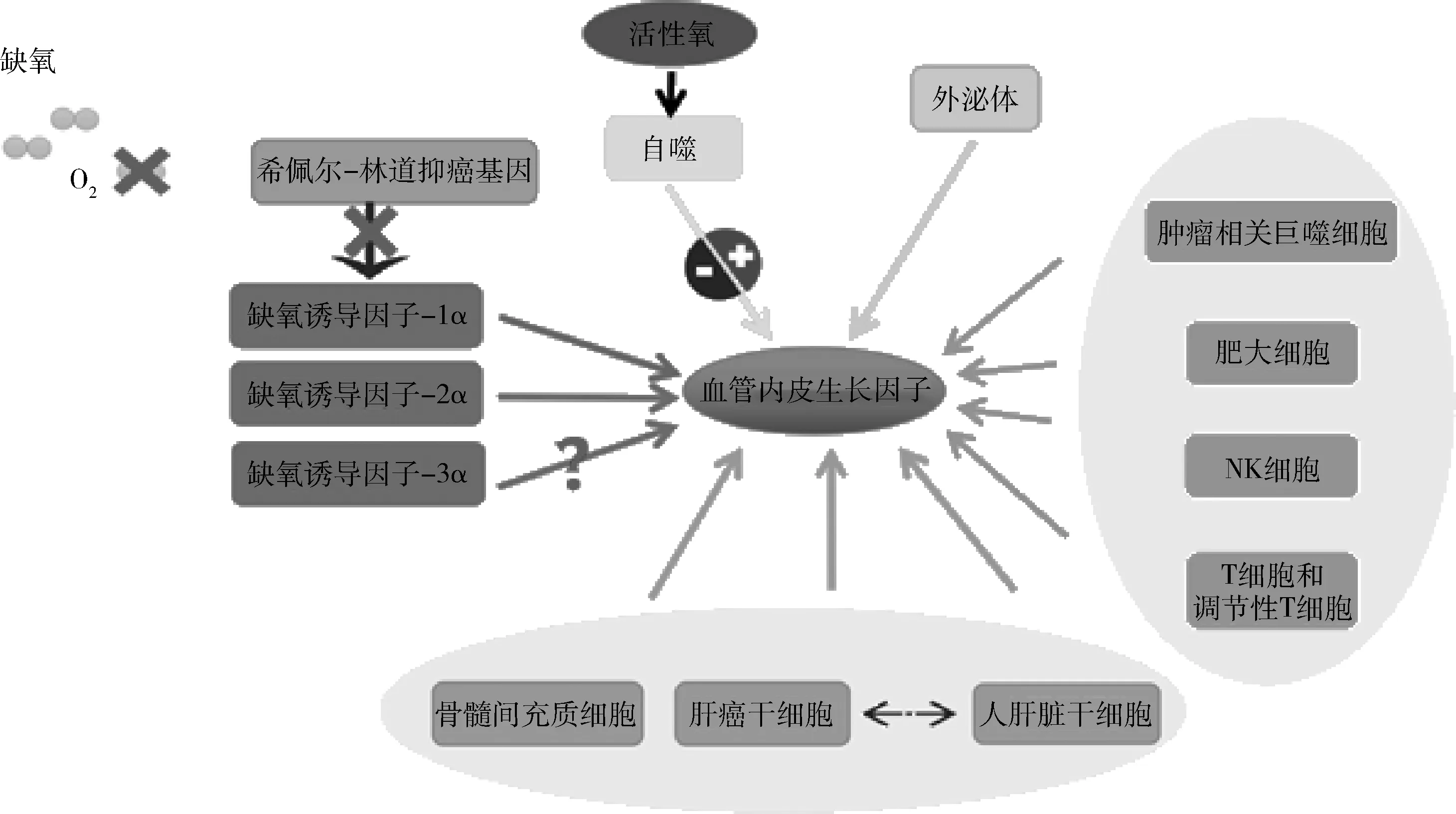
圖1 缺氧微環境下參與調控肝細胞癌血管新生的相關因素
一、缺氧誘導因子對HCC血管新生的直接調控
1. HIF-1α:缺氧誘導因子-1(hypoxia inducible factor-1,HIF-1)被認為是腫瘤缺氧適應性反應的中心啟動因子,HIF-1由α、β亞基以異源二聚體形式組成,其中HIF-1α是唯一的氧調節亞基,決定 HIF-1的活性。細胞核產生的HIF-1α對氧分壓敏感,常氧下希佩爾林道抑癌基因VHL(von Hippel-Lindau,VHL)能使HIF-1α泛素化并導致其降解,但在缺氧條件下,HIF-1α的降解途徑受阻,可以通過涉及羥基化、乙酰化、泛素化和磷酸化反應的翻譯后修飾來控制HIF-1α穩定性和轉錄活性,使其在細胞核內積聚,持續表達增高[3]。
HIF-1α在HCC及其基質的形成過程中發揮著重要的轉錄調控作用。HIF-1α刺激血管生成因子的表達,如VEGF、葡萄糖轉運蛋白1(glucose transporter protein-1,GLUT1)和碳酸酐酶9(carbonic anhydrase 9,CA9)等。這種轉錄程序促進血管新生,從而提供營養和氧氣,維持肝癌細胞存活。Wang等[4]研究發現,HCC細胞中賴氨酰氧化酶相關蛋白2(lysyl oxidase-like 2,LOXL2)的表達能夠被HIF-1α升高,并誘導上皮間質轉換(epithelium-to-mesenchymal transition,EMT)和血管新生,促進肝癌轉移。在缺氧條件下,HIF-1α調控的下游基因與肝癌血管新生關系密切。Wen等[5]研究表明,HIF-1α活化能上調VEGFA、轉化生長因子-β(transforming growth factor-β,TGF-β)、促紅細胞生成素(erythropoietin,EPO)、成纖維細胞生長因子-2(fibroblast growth factor-2,FGF-2)等下游血管新生相關基因的表達,并在體外人臍靜脈內皮細胞(human umbilical vein endothelial cells, HUVEC)模擬血管形成實驗中促進HCC細胞毛細血管新生。
2.HIF-2α和HIF-3α:與HIF-1α一樣,HIF-2α也可誘導多種血管新生基因的表達,如VEGF或血管新生素,但不同的是,二者在腫瘤缺氧環境中的作用存在差異:HIF-1α主要在缺氧急性期發揮作用, 而HIF-2α則是隨著缺氧環境進展而逐漸發揮作用。有研究發現,在缺氧微環境中,HIF-2α促進脂肪性HCC發展可能是通過上調PI3K-AKT-mTOR途徑來實現的[6]。對HIF-3α的研究相對較少,HIF-3α具有轉錄活性還是抑制活性,其對HIF-1/2α具有正反饋調節還是負反饋調節,這些問題尚存在爭議,所以,HIF-3α在缺氧微環境中的抗HCC血管新生作用在很大程度上是未知的[7]。但是近年來研究發現,在缺氧環境下,HIF-3α能夠調控長鏈非編碼RNA促進其他消化系統腫瘤的侵襲轉移,基于此,HIF-3α是否能通過促進HCC的血管新生引起侵襲和轉移也期待有最新的研究匯入[8]。
二、缺氧通過誘導自噬調控HCC血管新生
缺氧是自噬(autophagy)激活的重要誘因之一,自噬在HCC早期可以通過防止氧化應激、調控炎性免疫反應等維持細胞內穩態,是細胞在缺氧微環境下賴以生存的關鍵[9]。Park等[10]研究發現,自噬能夠為病理組織提供充足的氧進而促進血管新生。其機制可能有兩方面:一方面,自噬能夠調節氧化還原穩態,雖然輕度氧化應激可以改善內皮細胞功能,但在高水平的活性氧(reactive oxygen species,ROS)中,自噬能夠促進血管新生。另一方面,自噬對血管新生相關細胞因子具有雙向調控作用,既可以促進血管新生,也可抑制血管新生[11]。
自噬發揮促進血管新生作用主要通過調節受體如血管內皮生長因子受體2(vascular endothelial growth factor receptor 2,VEGFR2)免受胞質分裂和胞吞,當內皮細胞處于靜止狀態時,VEGFR2的周轉減少,自噬可能通過調節內吞途徑干擾VEGFR2的激活狀態進而調控血管新生[12]。ROS是自噬的上游調節器,ROS的產生可能是自噬參與血管新生的重要機制,誘導自噬促進血管新生,而抑制自噬可以抑制血管新生。Zou等[13]研究表明,ROS引發的自噬可以通過激活 VEGF等血管生長因子進而啟動血管新生途徑。
三、缺氧通過刺激外泌體分泌調控HCC血管新生
腫瘤細胞主動產生、釋放和利用外泌體(exosomes)來促進腫瘤的增殖、遷移和血管新生。肝癌細胞在缺氧條件下會分泌更多的外泌體,此時釋放的缺氧外泌體富含血管生長因子。研究表明,缺氧條件下腫瘤釋放的外泌體可以導致血管新生和血管滲漏[14]。外泌體通過攜帶血管生成蛋白而參與腫瘤血管新生:血管生成蛋白被內皮細胞捕獲或者外泌體微小核糖核酸調控內皮細胞血管生成功能[15]。但外泌體在肝癌細胞中發揮調控血管新生功能的分子機制,目前還沒有明確的認識與研究。
四、缺氧通過協助腫瘤免疫逃逸影響HCC血管新生
低灌注和缺氧有助于腫瘤細胞的免疫逃逸。病理性血管新生存在的肝癌缺氧環境,其環境壓力和代謝壓力通過影響基質和免疫細胞組分,誘導免疫逃逸并維持連續的缺氧狀態[16]。
1.腫瘤相關巨噬細胞:缺氧會導致腫瘤相關的巨噬細胞(tumor-associated macrophages, TAM)的聚集。TAM包括M1型和M2型巨噬細胞,前者主要發揮抗炎和抗腫瘤作用,后者被發現能促進免疫抑制,激活腫瘤微環境中的細胞因子、生長因子和蛋白酶,并有利于腫瘤微環境中導致腫瘤進展的異常血管的形成,從而促進腫瘤進展。韓晨陽等[17]研究發現,CD68+CD163+M2型巨噬細胞可以通過分泌VEGF等促血管生長因子,激活 VEGF-VEGFR2- Notch1/DI4信號通路促進肝癌血管的新生。
2.肥大細胞:在缺氧微環境中,肥大細胞可以刺激其他炎性細胞釋放血管生長因子和細胞外基質降解蛋白酶,以此來促進腫瘤血管新生,從而導致腫瘤的生長和發展[18]。在腫瘤發展的早期,肥大細胞募集,造成腫瘤血管新生和組織重構,隨著腫瘤進展,嗜酸性粒細胞和中性粒細胞被招募,進而激活體液免疫反應和細胞免疫反應。隨著HCC組織中分泌的肥大細胞密度增高,肝竇內皮細胞逐漸血管化表現,且基膜逐漸增厚,促進了血管新生。此外,肥大細胞還可以通過衍生的金屬蛋白酶來實現降解間質腫瘤基質的作用,來釋放VEGFR、FGF-2、TGF-β等與細胞外基質結合的血管生長因子。
3.NK細胞:NK細胞(natural killer cells,NK cells)使用受體和信號通路的組合來保護宿主免受腫瘤侵害,然而研究顯示在缺氧微環境中,NK細胞上細胞毒性效應子和激活受體的表達均降低,導致腫瘤從NK細胞介導免疫逃逸[19]。肝臟是人體NK細胞最大的儲存場所,但在HCC中,NK細胞由于缺氧微環境,往往處于功能性衰竭的免疫抑制狀態,最近有研究指出,外源加入具有抗腫瘤活性的NK細胞能重新激活肝癌小鼠腫瘤中衰竭NK細胞的抗腫瘤活性,重塑肝臟的免疫系統,進而激活抗血管新生反應[20]。
4.T細胞及調節性T細胞:T細胞的毒性作用可抑制HCC血管新生,促使肝癌細胞凋亡。但缺氧微環境能能夠抑制T細胞的毒性作用,最新研究提示其有兩方面機制:一方面,HIF可介導 CD73和CD79的表達,使腺苷在細胞外積累,通過識別T細胞A2A受體增加環腺苷酸表達,抑制T細胞的細胞毒性[21]。另一方面,HIF可介導CD8+T表達,CD8+T細胞在缺氧培養時更有效地分化為細胞毒性T細胞,抑制HCC血管新生。VEGF能夠招募調節性T細胞(regulatory T cells,Tregs),同時,Tregs也參與介導腫瘤血管生長因子釋放,缺氧可以增加Tregs的聚集,并通過抑制CD4+效應T細胞功能和促進Tregs活性來增強免疫抑制。
五、缺氧通過調節干細胞功能影響HCC血管新生
腫瘤干細胞是腫瘤組織中具有“干細胞樣”特征的小細胞亞群,其可能來源于骨髓間充質細胞的異常突變和分化。干細胞與HCC的發生、發展密切相關,并促進了HCC高侵襲、耐藥、易復發、易轉移、預后差的惡性特征。
1.骨髓間充質細胞:骨髓間充質細胞(bone marrow stromal cells,BMSCs)廣泛存在于骨髓基質系統中,作為一種多能干細胞,BMSCs可以在各種條件和因素誘導下實現多方向分化。有研究發現,動員后的BMSCs具備分化為成熟血管內皮細胞的能力,進而參與腫瘤血管新生,然而這一過程的激活因素尚未明確,目前猜測可能是VEGF參與了骨髓動員[22]。另一項實驗研究得出類似的結論,BMSCs被動員后,HCC組織中檢測出VEGF也逐漸升高。這可能是由于局部微環境的趨化,HCC組織釋放的VEGF入血動員BMSCs,進入循環后局部富集,最終分化為成熟的血管內皮而參與HCC血管新生。BMSCs還可以通過釋放外泌體,經由JNK /HIF-1α信號轉導促進血管新生。此外,有研究認為除了直接分化為血管內皮外,BMSCs也可在局部分泌促血管生長因子,以旁分泌方式參與血管新生。
2.肝癌干細胞:肝癌干細胞(hepatic cancer stem cells , HCSCs)主要通過釋放促血管生長因子和外泌體來驅動血管新生。在缺氧條件下,腫瘤干細胞比腫瘤中的非腫瘤干細胞群體產生更高水平的血管內皮生長因子。VEGF的增加促進內皮細胞遷移,并形成新的管型血管。因此,血管新生和肝癌干細胞之間可能存在正反饋回路,一方面肝癌干細胞可以通過自噬或者直接形成新生血管以獲得血液和氧氣來對抗腫瘤內缺氧。另一方面,缺氧微環境中的血管生態也通過旁分泌機制釋放生長因子,以維持肝癌干細胞的高干性。這種正反饋回路導致了肝癌的進展和不良預后。
3.人肝臟干細胞:人肝臟干細胞(human liver stem cells,HLSCs)與肝癌干細胞動態失衡可能是導致HCC發生、發展的機制,當HLSCs向HCSCs轉化時,HCC發生及轉移進展風險增加。有研究發現,HLSCs衍生的外泌體處理后的腫瘤來源內皮細胞,其miR-15a、miR-181b、miR-320c和miR-874的表達顯著增強,這些微小核糖核酸能夠通過下調EPHB4、ITGB3、FGF1和PLAU等血管新生相關基因來抑制血管新生進而發揮抗腫瘤發生的作用。
六、展 望
目前,抗血管新生治療已成為抗肝癌治療的重要手段之一,近年來對于HCC血管新生的研究頗多, 現已經發現多條腫瘤血管新生通路, 也相繼誕生了多種針對血管生成的靶向藥物,以索拉菲尼為代表的抗腫瘤血管新生的藥物大量進入臨床。近年來,隨著腫瘤微環境、免疫逃逸、外泌體、干細胞等領域的研究深入,肝癌血管新生的機制研究也取得了諸多進展,但仍然存在尚待解決的問題:①HIF-3α在缺氧微環境中是否對調控肝癌血管新生有作用,需要未來更多的研究來進一步揭示;②外泌體在血管新生和遠端肝癌轉移前微環境形成中的作用分子機制還尚待明確;③骨髓間充質干細胞是促進腫瘤生長,還是靶向生物治療的一個新希望,但毋庸置疑的是,在這個全新的領域中,其作用機制及潛在風險需要不斷探索。

