環狀RNA Circ-RANBP1在胰腺癌組織中的表達及其對細胞增殖、遷移和侵襲能力的影響
李思思 宋佳鴻 何亞迎 黃 英
民航上海醫院消化內科(200336)
背景:大量研究表明,環狀RNA(circRNA)異常表達與多種腫瘤的發生、發展、預后等密切相關,是理想的診斷指標和治療靶點。但circRNA在胰腺癌發生、發展中的作用尚需進一步探究。目的:探討circ-RANBP1在胰腺癌組織中的表達及其對胰腺癌細胞增殖、遷移和侵襲能力的影響。方法:以原位雜交法檢測circ-RANBP1在胰腺癌組織和相應癌旁正常組織中的表達。常規培養MIA PaCa-2細胞和SW 1990細胞,分別轉染circ-RANBP1敲低寡聚物和過表達質粒,并設立相應對照組。qRT-PCR法檢測circ-RANBP1在胰腺癌細胞中的表達。EdU實驗檢測circ-RANBP1對細胞增殖能力的影響。Transwell實驗檢測circ-RANBP1對細胞遷移、侵襲能力的影響。蛋白質印跡法和免疫熒光染色檢測circ-RANBP1對細胞上皮-間質轉化(EMT)進程的影響。血管形成實驗評估circ-RANBP1表達對血管形成能力的影響。結果:Circ-RANBP1在胰腺癌組織中表達增高,且與患者的不良預后密切相關。Circ-RANBP1下調能抑制MIA PaCa-2細胞增殖,而circ-RANBP1過表達可促進SW 1990細胞增殖。與對照組相比,敲低circ-RANBP1能抑制MIA PaCa-2細胞遷移和侵襲,而過表達circ-RANBP1可促進SW 1990細胞遷移和侵襲。敲低circ-RANBP1可抑制EMT,過表達circ-RANBP1可促進EMT。抑制circ-RANBP1表達可明顯降低血管形成能力,過表達則可明顯促進血管形成。結論:Circ-RANBP1在胰腺癌組織中高表達,并可促進胰腺癌細胞的增殖、遷移、侵襲、EMT和血管形成。
胰腺癌是一種常見的消化道惡性腫瘤,預后極差,五年生存率僅為9%[1]。然而,胰腺癌發病隱匿,缺乏有效的早期診斷方法,大多數胰腺癌患者發現即處于疾病晚期,失去手術治療的機會[2]。因此,尋找胰腺癌早期診斷和有效治療靶點仍是胰腺癌研究的重點。
環狀RNA(circRNA)是由RNA反向剪接形成的一種共價閉合環狀非編碼RNA,主要由外顯子和(或)內含子構成,廣泛存在于真核細胞中[3]。與傳統線性RNA不同,circRNA缺乏5’端帽結構和3’端Ploy(A)尾結構,因此能夠抵抗RNA核酸外切酶的降解,較線性RNA更穩定[4]。同時,circRNA具有高度保守性和組織特異性,具備分子標志物的潛能[5-7]。大量研究表明,circRNA異常表達與多種腫瘤的發生、發展、預后等密切相關[8-11],是理想的診斷指標和治療靶點。但circRNA在胰腺癌發生、發展中的作用尚需進一步探究。本研究通過分析胰腺癌的circRNA GSE數據集(GSE69362、GSE79634),篩選出在胰腺癌中高表達的hsa_circ_0092314(circ-RANBP1),旨在探討其在胰腺癌組織中的表達及其對胰腺癌細胞增殖、遷移、侵襲等細胞生物學過程的影響。
材料與方法
一、細胞株、組織芯片和主要試劑
人胰腺癌細胞株AsPC-1、BxPC-3、CFPAC-1、HPDE6-C7、MIA PaCa-2、SW 1990、人臍靜脈內皮細胞(HUVEC)購于中國科學院細胞庫;胰腺癌組織芯片(TMA,含有30例胰腺癌組織和對應癌旁正常組織)購于上海芯超生物科技有限公司;DMEM培養基、RPMI-1640培養基、胎牛血清、青鏈霉素均購自美國Gibco公司;circ-RANBP1過表達質粒(circ)、circ-RANBP1敲低寡聚物(si-circ)均由廣州吉賽生物科技有限公司合成;EdU試劑盒購于廣州銳博生物技術有限公司;脂質體Lipofectamine 3000購自美國Invitrogen公司;Trizol裂解液、逆轉錄和實時熒光定量PCR試劑盒購自日本TaKaRa公司;蛋白酶K、RIPA裂解液購自碧云天生物技術公司。基質膠購自美國BD公司。E-cadherin、N-cadherin一抗均購自Cell Signaling Technology, Inc.。
二、方法
1.原位雜交(ISH)染色:Circ-RANBP1探針由廣州吉賽生物科技有限公司合成。根據實驗步驟對組織芯片進行染色,ISH染色鏡檢結果由兩位經驗豐富的病理科專家進行判定,并依據染色強度和染色范圍進行評分。染色強度:0分,無染色;1分,淡黃色;2分,棕黃色;3分,棕褐色;染色范圍:0分,0%~10%;1分,11%~25%;2分,26%~50%;3分,51%~75%;4分,76%~100%。總評分為染色強度與染色范圍之積,≤4分為circ-RANBP1低表達,>4分表示circ-RANBP1高表達。
2.細胞培養:MIA PaCa-2細胞培養于含有10%胎牛血清、1%青鏈霉素的DMEM培養基中,SW 1990細胞培養于含有10%胎牛血清、1%青鏈霉素的RPMI-1640培養基中,培養條件均為37 ℃、5% CO2。細胞生長至融合度為80%~90%時進行消化傳代。
3.細胞轉染:將MIA PaCa-2和SW 1990細胞分別接種于6孔板,當細胞融合度為60%~70%時,應用Lipofectamine 3000對MIA PaCa-2細胞轉染circ-RANBP1敲低寡聚物及其對照物,對SW 1990細胞轉染circ-RANBP1過表達質粒和空載質粒,組別依次命名為si-circ組、si-NC組、circ組、vector組。轉染6 h后換液繼續培養,轉染24 h后,用qRT-PCR驗證轉染效率。實驗重復3次。
4.qRT-PCR法:加入Trizol試劑提取細胞內總RNA,反轉錄為cDNA,行實時熒光定量PCR。circ-RANBP1引物上游:5’-GCT GAT CTC TTC CCT GCT CA-3’,下游:5’-AGG CTC CGC AAC AAC TAA TG-3’;內參GAPDH引物上游:5’-GGG AAG GTG AAG GTC GGA GT-3’, 下游:5’-GGG GTC ATT GAT GGC AAC A-3’。引物由生工生物工程(上海)股份有限公司合成。采用2-△△Ct法計算目的基因的相對表達量。實驗重復3次。
5.EdU實驗:細胞轉染48 h后,收集并將細胞接種于96孔板中,按照說明書步驟對細胞進行EdU標記、Apollo染色、DNA染色、圖像采集和分析。實驗重復3次。
6.Transwell實驗:細胞轉染48 h后,收集細胞并用無血清培養基重懸細胞,接種于Transwell上室中,下室加入500 μL含10%胎牛血清的培養基,常規培養16 h。輕輕擦去上室內的細胞,多聚甲醛固定,用0.1%結晶紫染色,隨后顯微鏡下拍照并采集圖像,隨機取5個視野統計遷移細胞數,取均值。實驗重復3次。
細胞侵襲實驗是在小室濾膜上包被基質膠,其余步驟同上述細胞遷移實驗,顯微鏡下隨機取5個視野統計細胞數,取均值。實驗重復3次。
7.蛋白質印跡法:取對數生長期的細胞,消化后接種于6孔板中,細胞轉染48 h后加入RIPA裂解液,提取各組細胞的總蛋白,BCA法測定蛋白濃度,E-cadherin、N-cadherin一抗工作濃度均為1∶1 000。以GAPDH作為內參,ECL法顯影并保存圖像。實驗重復3次。
8.免疫熒光染色:采用4%的多聚甲醛溶液將已爬好細胞的玻片進行固定,5%的BSA封閉1 h后加入一抗(E-cadherin、N-cadherin一抗工作濃度均為1∶100),4 ℃孵育過夜。PBS漂洗后加入熒光二抗,室溫孵育1 h,PBS漂洗后加入DAPI染色液,顯微鏡下拍照并采集圖像。實驗重復3次。
9.血管形成實驗:將轉染48 h的HUVEC接種6孔板中,待貼壁后,PBS洗滌,換無血清培養基培養24 h,收集上清液;提前將基質膠鋪到預冷的96孔板中,每孔60 μL,37 ℃凝固30 min。將HUVEC消化離心后用預先收集的上清液重懸為 3×104/100 μL,每孔100 μL加入備用的96孔板,細胞培養箱常規培養6 h。顯微鏡下隨機取5個視野計數血管內皮細胞成管數量。實驗重復3次。
三、統計學分析
結 果
一、Circ-RANBP1在胰腺癌組織中的表達及其與胰腺癌患者臨床病理特征之間的關系
與癌旁正常組織相比,circ-RANBP1在胰腺癌組織中的表達顯著升高(6.97±0.58對3.70±0.49),差異有統計學意義(t=4.321,P<0.05;圖1A-1B)。根據circ-RANBP1在胰腺癌組織中的表達,將胰腺癌患者分為高表達組和低表達組,結果顯示circ-RANBP1表達與胰腺癌患者的性別、年齡、腫瘤部位、腫瘤大小、N分期、神經侵犯、血管侵犯等無關(P>0.05),而與患者的T分期、M分期、AJCC分期密切相關(P<0.05;表1)。Kaplan-Meier生存分析顯示,高表達circ-RANBP1的胰腺癌患者生存期顯著低于低表達者(圖1C)。
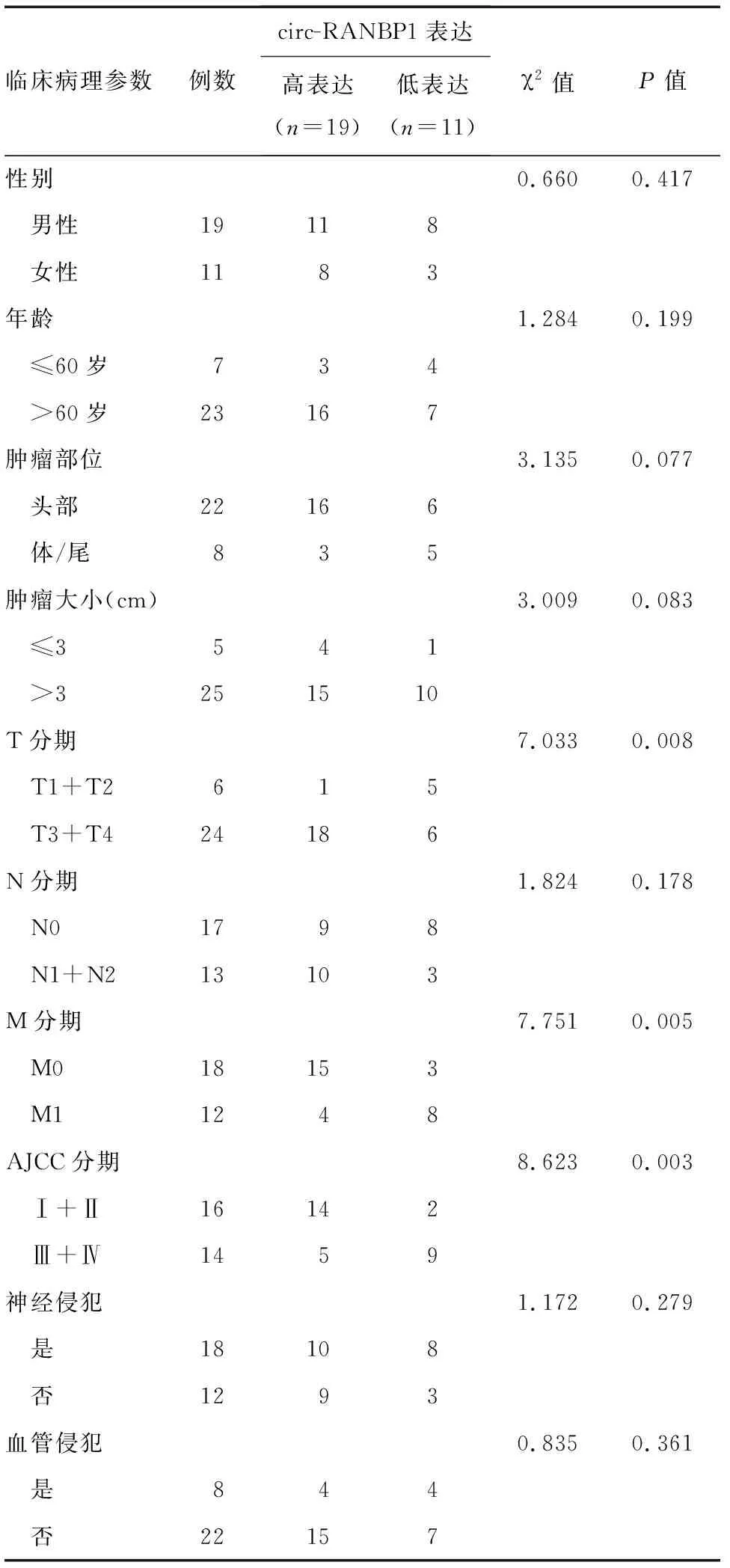
表1 Circ-RANBP1表達與胰腺癌患者臨床病理特征之間的關系(n)
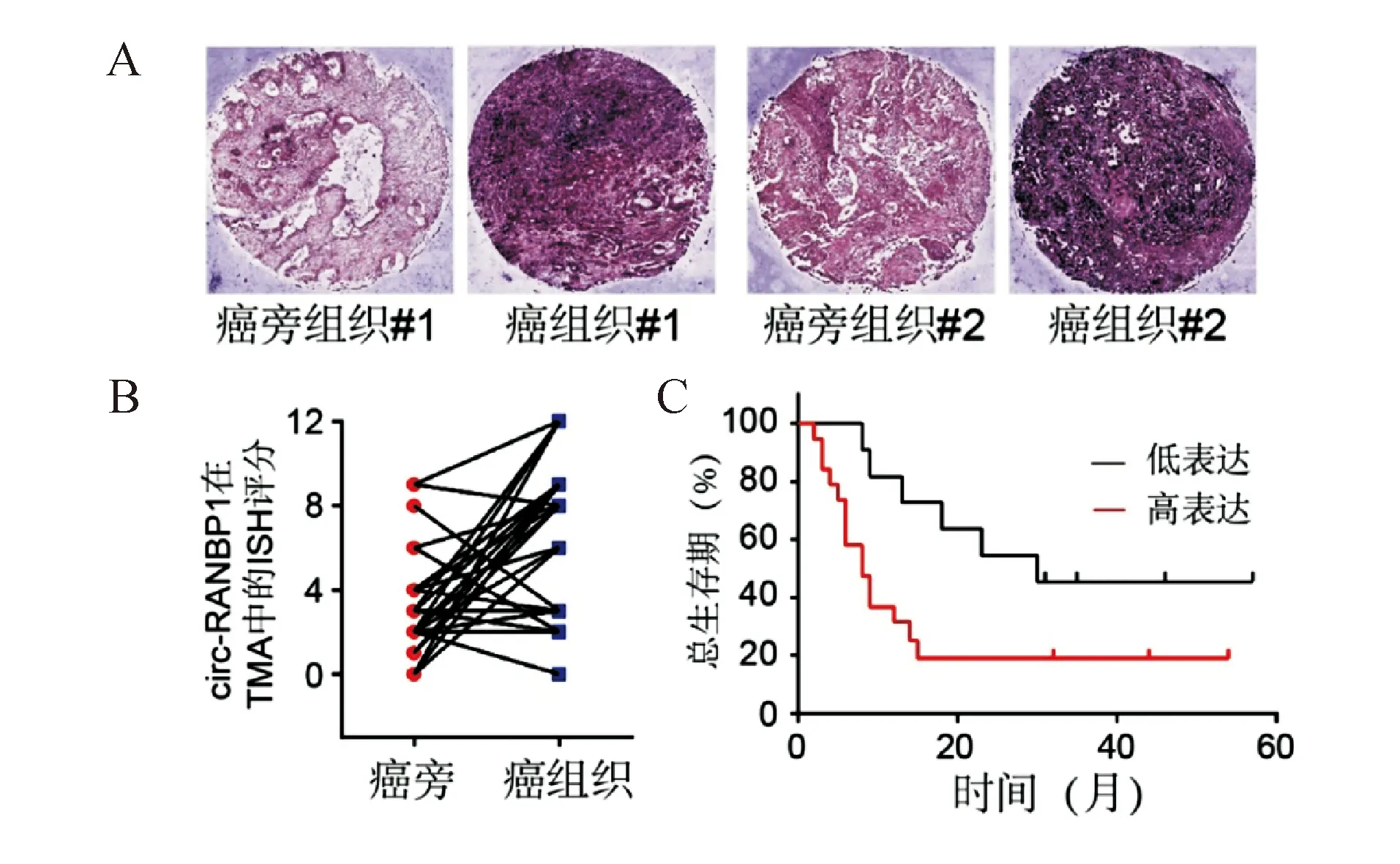
A-B:胰腺癌和相應癌旁正常組織中circ-RANBP1表達(ISH染色);C:Circ-RANBP1表達與胰腺癌患者生存期的關系(Kaplan-Meier生存分析)
二、Circ-RANBP1在胰腺癌細胞中的表達以及細胞轉染效率
與正常胰腺導管上皮細胞相比,circ-RANBP1在胰腺癌細胞中的表達明顯升高(圖2A)。篩選出circ-RANBP1表達相對較高的MIA PaCa-2細胞轉染si-circ-RANBP1,circ-RANBP1表達相對較低的SW 1990細胞轉染circ-RANBP1過表達質粒。結果顯示,與對照組相比,si-circ-RANBP1可顯著降低circ-RANBP1表達(P<0.05),而轉染過表達質粒可明顯提高circ-RANBP1表達(P<0.05;圖2B)。
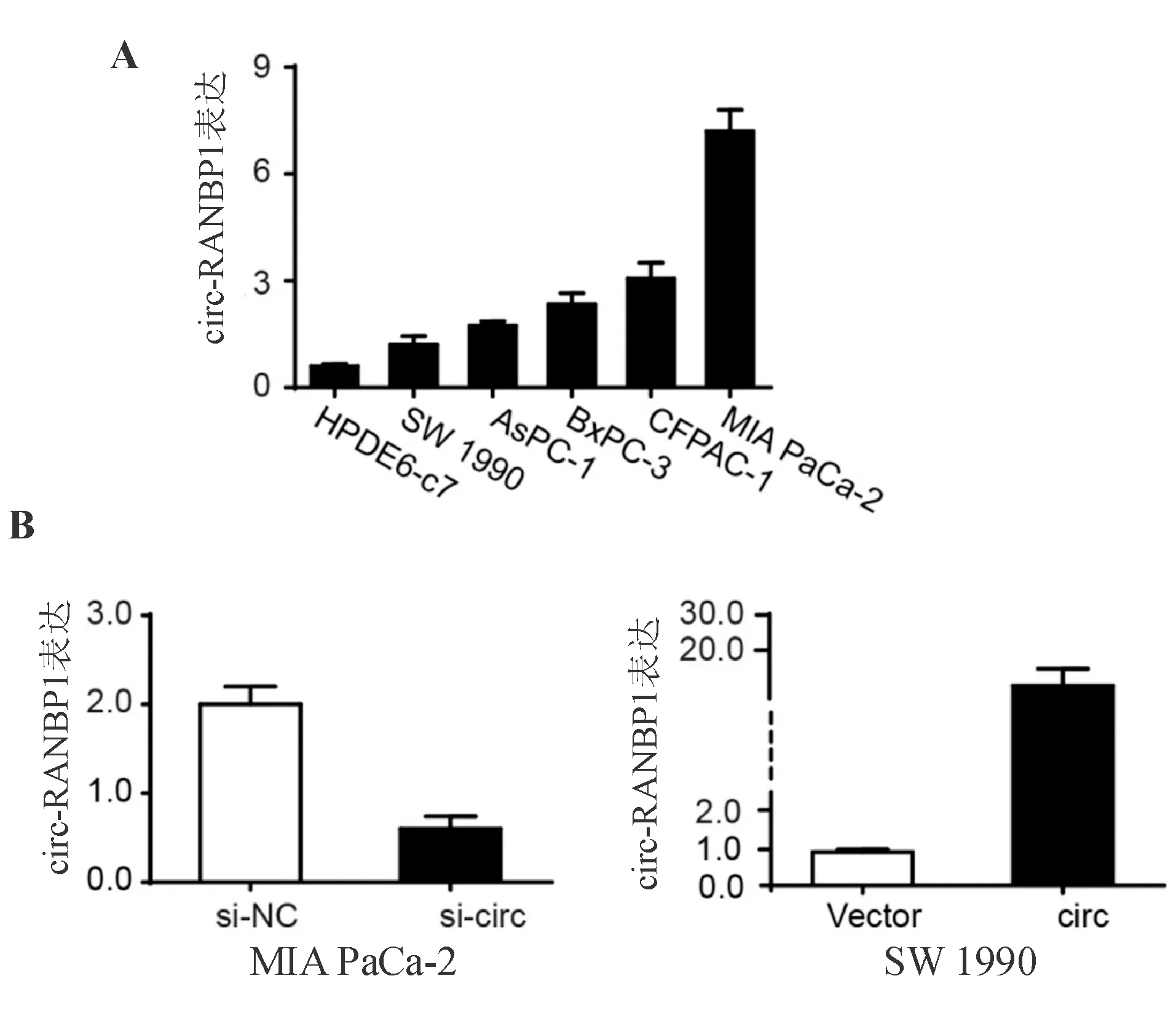
A:circ-RANBP1在不同胰腺癌細胞中的表達;B:驗證circ-RANBP1的敲低和過表達效率
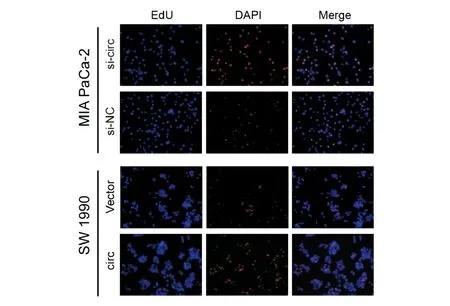
圖3 EdU實驗檢測circ-RANBP1對胰腺癌細胞增殖能力的影響
三、Circ-RANBP1對胰腺癌細胞增殖能力的影響
EdU實驗結果顯示,circ-RANBP1敲低后,MIA
四、Circ-RANBP1對胰腺癌細胞遷移、侵襲能力的影響
Transwell遷移實驗結果顯示,與對照組相比,circ-RANBP1敲低組MIA PaCa-2細胞遷移數目顯著減少,而circ-RANBP1過表達組SW 1990細胞遷移數目明顯增多(P<0.05);Transwell侵襲實驗結果顯示,circ-RANBP1敲低組MIA PaCa-2細胞侵襲數目明顯少于對照組(P<0.05),circ-RANBP1過表達組SW 1990細胞侵襲數目顯著多于對照組(P<0.05;圖4)。表明circ-RANBP1可促進細胞的遷移、侵襲能力。
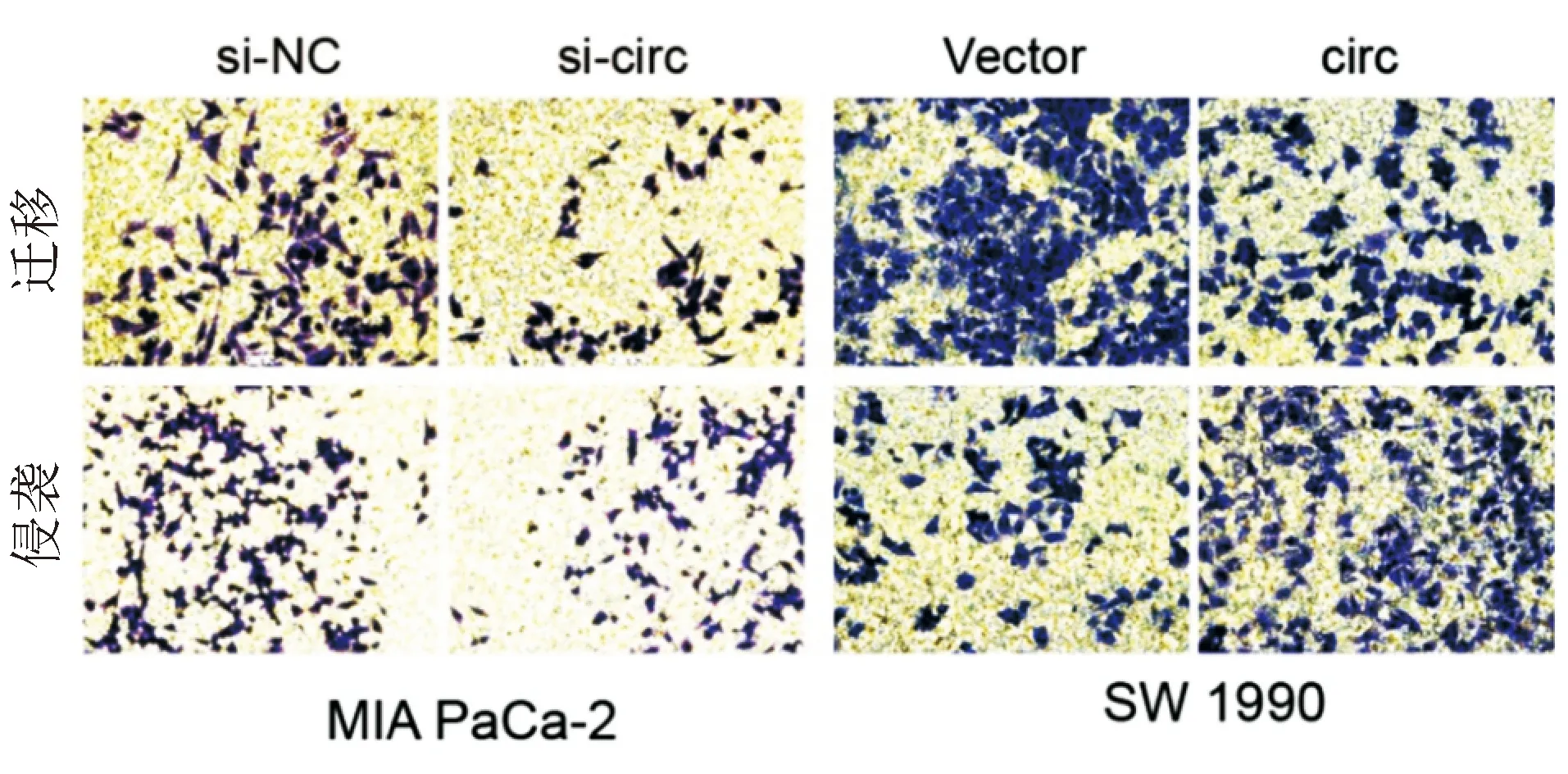
圖4 Transwell實驗驗證circ-RANBP1對胰腺癌細胞遷移、侵襲能力的影響
五、Circ-RANBP1對細胞上皮-間質轉化(EMT)的影響
蛋白質印跡法結果顯示,circ-RANBP1敲低能促進上皮標志物E-cadherin表達,抑制間皮標志物N-cadherin表達,而circ-RANBP1過表達能抑制E-cadherin表達,促進N-cadherin表達(圖5A);免疫熒光實驗進一步證實了上述實驗結果(圖5B)。由此可見,circ-RANBP1能影響細胞的EMT。
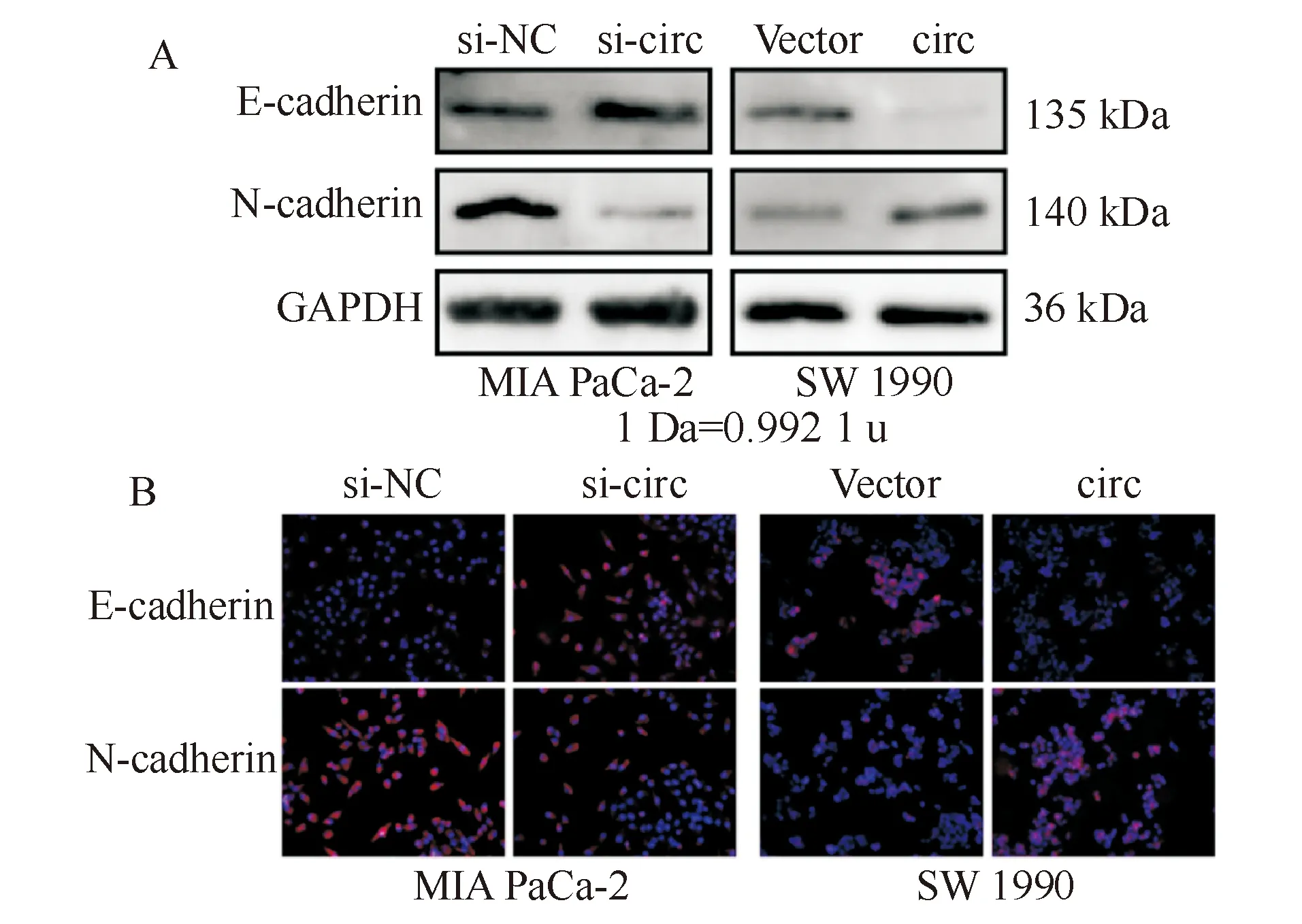
A:蛋白質印跡法;B:免疫熒光法
六、Circ-RANBP1對血管形成能力的影響
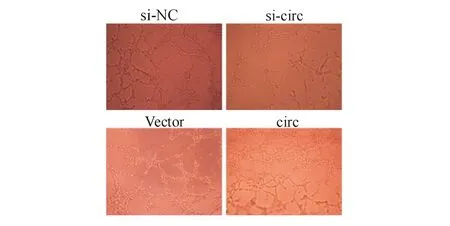
圖6 Circ-RANBP1表達對血管形成能力的影響
討 論
CircRNA是非編碼RNA家族重要成員,以往被認為是RNA異常剪切產生的基因副產物,無細胞生物學功能[12-13]。近年,隨著高通量測序技術的發展以及研究的深入,發現了越來越多的circRNA,且在細胞的生理和病理過程中發揮重要作用[14-15]。研究顯示,多種circRNA在胰腺癌中異常表達,參與調控胰腺癌細胞的增殖、侵襲、遷移等細胞生物學行為[16-17],并可作為胰腺癌的診斷和預后指標[18]。因此,深入研究胰腺癌相關circRNA不僅能夠豐富和完善胰腺癌的發病機制,而且可為尋找胰腺癌早期診斷和治療靶標提供參考。
本研究選取了與胰腺癌相關的circ-RANBP1作為研究對象,旨在探討其對胰腺癌細胞生物學功能的影響及其作為潛在診斷標志物的潛能。結果顯示circ-RANBP1在胰腺癌組織中的表達顯著高于癌旁正常組織。進一步分析顯示circ-RANBP1高表達與胰腺癌患者的TNM分期密切相關。Kaplan-Meier生存曲線分析表明,circ-RANBP1高表達與胰腺癌患者的生存期呈負相關。說明circ-RANBP1表達對評估胰腺癌患者的分期以及預后有重要參考價值。
本研究通過qRT-PCR法發現,circ-RANBP1在胰腺癌細胞中的表達明顯升高。為進一步驗證circ-RANBP1對胰腺癌細胞功能的影響,通過細胞轉染的方法上調或下調circ-RANBP1表達。結果顯示circ-RANBP1表達降低后,胰腺癌細胞的增殖、遷移、侵襲能力降低;而circ-RANBP1過表達后,細胞的增殖、遷移、侵襲能力明顯升高。進一步提示circ-RANBP1可能是胰腺癌潛在的治療靶點。
EMT為腫瘤轉移過程中的重要步驟,即上皮細胞通過改變其形態、修飾黏附分子,獲得遷移和侵襲行為[19-21]。大量研究表明,circRNA可通過調節EMT來影響腫瘤細胞的遷移和侵襲[22-24]。本研究結果顯示,下調circ-RANBP1表達可抑制EMT,而上調circ-RANBP1表達可促進EMT。此外,實體腫瘤的增殖需要大量的新生血管為其快速增長提供所需的營養物質和氧供[25]。本研究中,circ-RANBP1能促進血管形成,為其在胰腺癌細胞生物學功能中的作用提供了進一步的證據。
綜上所述,本研究證實了circ-RANBP1在胰腺癌組織中高表達,并能調節胰腺癌細胞的增殖、遷移和侵襲能力,促進EMT和血管形成,進而發揮促癌作用。本研究結果有望為胰腺癌的診治提供更廣闊的前景。

