腦膠質瘤患者MGMT啟動子甲基化和IDH1突變與臨床預后相關
張 寧,馬輝輝*,王 凡,梁 偉,汪義純,吳炳山,李慶新
(安徽醫科大學第一附屬醫院 1.腫瘤放射治療科;2.神經外科,安徽 合肥 230022)
腦膠質瘤是中樞神經系統腫瘤中最常見的腫瘤之一,約占27%,占顱內惡性腫瘤的80%,且發病率逐年增高[1]。腦膠質瘤目前的治療方式以手術及放射化學治療聯合為主,上述治療手段的聯合可使患者得到有效的生存獲益,但由于其病灶邊界不清,難以完整切除,易原位復發,因此尋找與患者長期生存相關的指標,可為指導腦膠質瘤個體化治療及改善患者預后等提供一定的參考依據。目前國內中樞神經系統膠質瘤指南推薦[2]對患者行分子標志物檢測進行評估,因為分子病理與傳統的組織學病理與相比,可以更好地對各種級別的膠質瘤進行明確的診斷分類及惡性程度評估[3]。腦膠質瘤的分子病理檢測中,O6-甲基鳥嘌呤-DNA 甲基轉移酶(O6 methylguanine DNA methyl-transferase,MGMT)啟動子甲基化和異檸檬酸脫氫酶1(isocitrate dehydrogenase 1,IDH1)基因均是較為常見的重要參考指標[4]。其中MGMT作為一種DNA修復酶,其啟動子甲基化狀態可以反映基因表達量,可能影響療效及預后。IDH1是檸檬酸循環能量代謝中的一種關鍵酶,其突變多見于低級別膠質瘤,可用于腦膠質瘤的分子診斷分型和預后評價。本研究通過回顧性分析27例行放射化學聯合治療的腦膠質瘤術后患者的病歷資料,評價上述標志物與治療療效及臨床預后之間的關系。
1 資料與方法
1.1 一般資料
收集2017年10月至2019年10月安徽醫科大學第一附屬醫院放射治療科收治的采用適形調強放射治療(intensity modulated radiationtherapy,IMRT)技術聯合替莫唑胺(temozolomide,TMZ)治療的腦膠質瘤患者35例,排除10例手術時間不詳病例,最后挑選有完整隨訪資料的患者25例,所有病例均經術后或活檢病理檢查確診并行分子病理檢測,檢測指標包括有MGMT甲基化、IDH1等。其中男17例,女8例,年齡24~76歲,中位年齡51歲,腦膠質瘤Ⅲ級11例,Ⅳ級14例。
1.2 方法
1.2.1 放射治療:用頭部熱塑面罩外固定,CT模擬定位及圖像采集后,利用Philips Pinnacle39.2治療計劃系統進行放療靶區勾畫。靶區定義:腫瘤靶體積(gross target volume,GTV)為患者術前及術后磁共振所顯示的病灶。臨床靶區(clinical target volume,CTV1)為GTV外放1~1.5 cm,CTV2為GTV外放2~2.5 cm。計劃靶區(plan target volume,PTV)為CTV外放0.3 cm。計劃要求95% CTV體積達到總處方劑量,CTV1 61.6 Gy/28次,CTV2 56 Gy/28次,2~2.2 Gy/次。采用6MV-X線照射,所有治療計劃均在西門子artiste醫用電子直線加速器上進行實施。
1.2.2 化學治療:同步放射化學治療期間予以口服TMZ膠囊,口服劑量為75 mg/(m2·d),連續服用6周,晨起空腹服用。放射化學治療結束后4周開始行TMZ輔助化學治療,第1個周期TMZ劑量為150~200 mg/(m2·d),1~5 d,每隔4周化學治療1個周期,共6個周期。
1.2.3 隨訪:采用住院、門診及電話隨訪的方式,放療結束后1~3月內復查頭顱增強MRI,之后每3個月復查1次。第2年起每6個月復查1次。自患者手術日期起隨訪至疾病進展、死亡、失訪或者截至2020年3月31日。
1.2.4 療效觀察指標:總生存期(overall survival,OS)指自手術當天起到患者死亡或者最后1次隨訪的時間,無進展生存時間(progression-free survival,PFS)定義為從手術后至病灶開始進展或復發的時間,病灶進展或復發的評價依據為患者的癥狀及影像學檢查結果。
1.3 統計學分析
應用SPSS 21.0軟件進行統計學分析,采用Kaplan-Meier法分析生存率及繪制生存曲線圖,單因素分析采用Log-rank法進行檢驗。
2 結果
2.1 生存情況
全組27例患者均完成同步放射化學治療療程,截至2020年3月31日,均無失訪,隨訪率100%,死亡8例,復發3例。
2.2 單因素分析
2.2.1MGMT啟動子甲基化(χ2=4.22,P<0.05)較非甲基化者的OS明顯延長 (圖1),MGMT甲基化患者的PFS較非甲基化患者的PFS延長(圖2)、IDH1陽性患者的OS、PFS延長(圖3,4)較陰性患者均有延長趨勢。
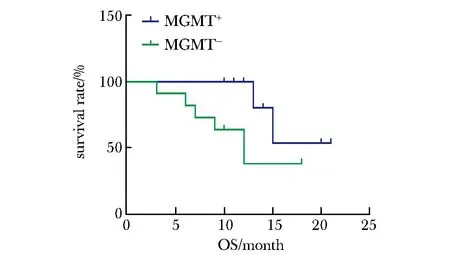
圖1 MGMT對膠質瘤患者總生存期的影響Fig 1 Influence of MGMT on glioma patients’OS
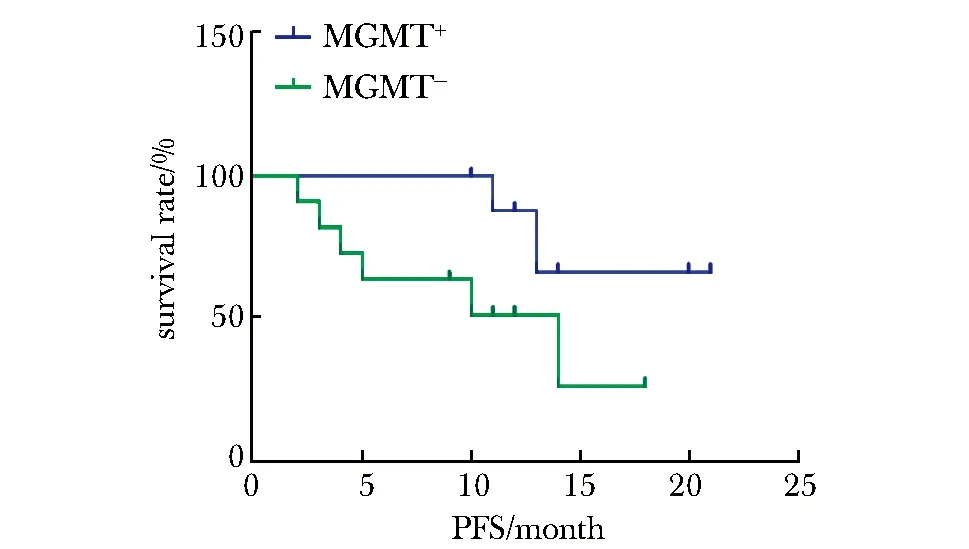
圖2 MGMT對膠質瘤患者無進展生存時間的影響Fig 2 Influence of MGMT on glioma patients’PFS
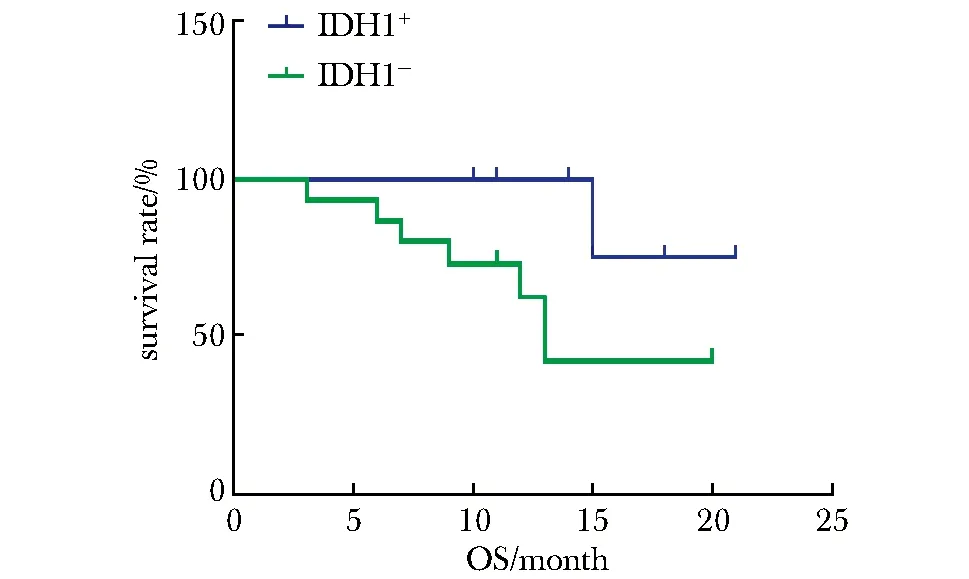
圖3 IDH1對膠質瘤患者總生存期的影響Fig 3 Influence of IDH1 on glioma patients’OS
2.2.2 將患者分為3組,分別是MGMT甲基化+IDH1突變組(6例),MGMT甲基化+IDH1無突變及MGMT非甲基化+IDH1突變組(6例)和MGMT非甲基化+IDH1無突變組(8例),比較3組的OS(圖5)及PFS(圖6),均提示第1組生存期最長,第3組生存期最短(P<0.05)。
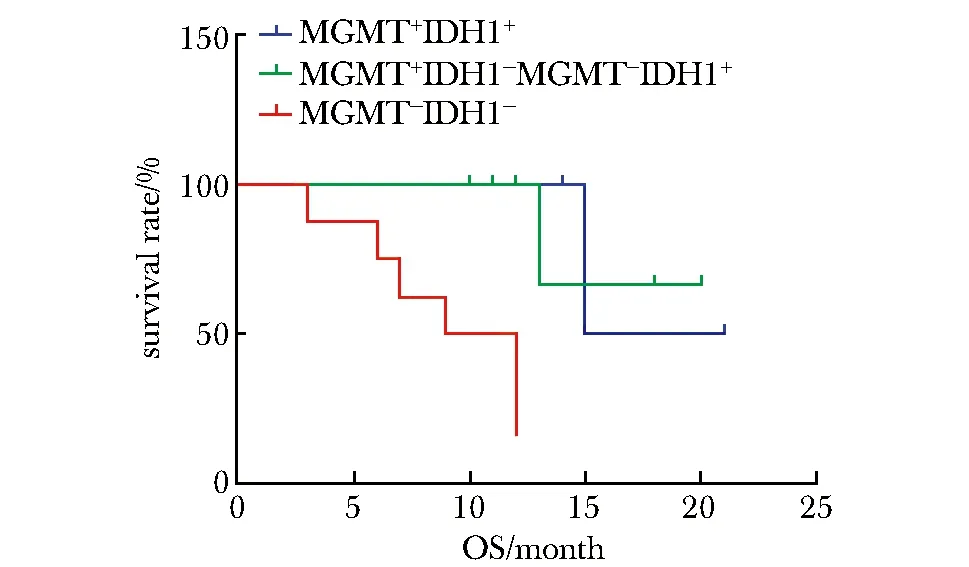
圖5 MGMT聯合IDH1對膠質瘤患者總生存期的影響Fig 5 Influence of MGMT combined with IDH1 on glioma patients’OS
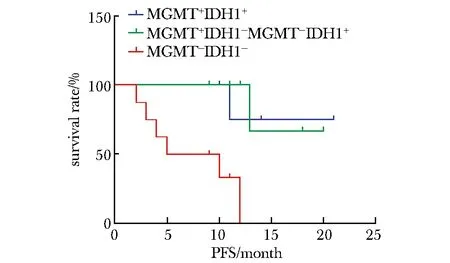
圖6 MGMT聯合IDH1對膠質瘤患者無進展生存時間的影響Fig 6 Influence of MGMT combined with IDH1 on glioma patients’PFS
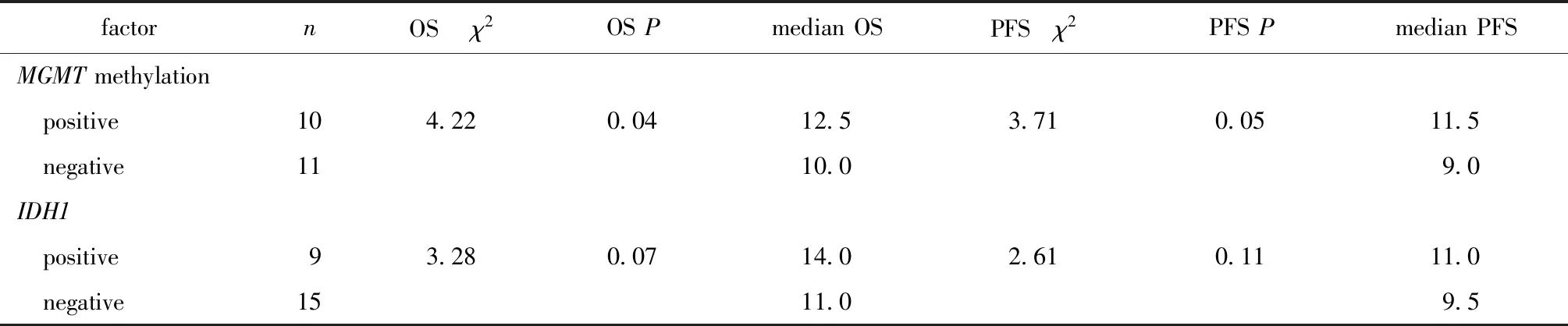
表1 25例腦膠質瘤患者單因素分析結果Table 1 Univariate analysis of 25 glioma patients
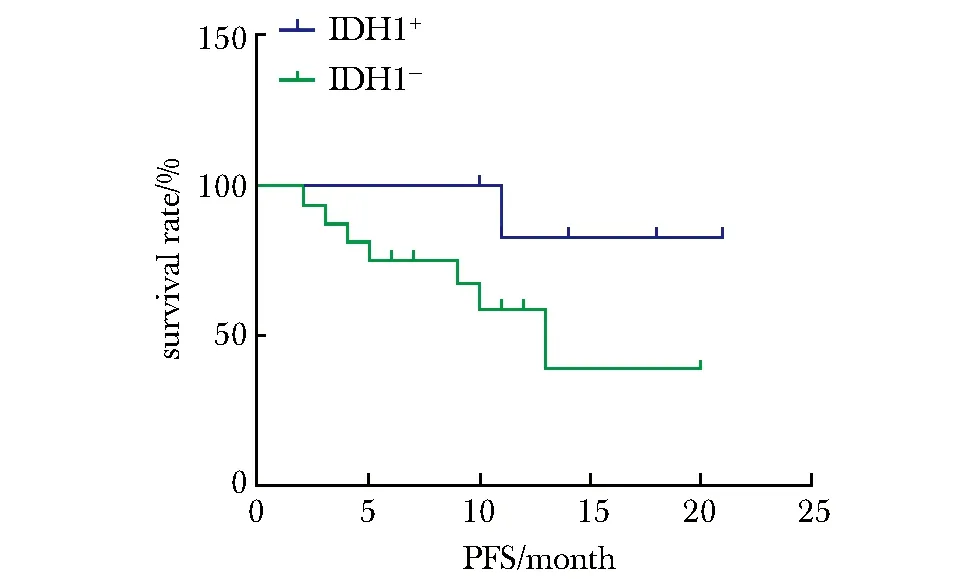
圖4 IDH1對膠質瘤患者無進展生存時間的影響Fig 4 Influence of IDH1 on glioma patients’PFS
3 討論
在腦膠質瘤的綜合治療中,烷化劑化療藥物TMZ可以通過血腦屏障進入中樞神經系統,造成顱內腫瘤細胞DNA序列中O6-甲基鳥嘌呤損傷,從而抑制腫瘤生長。MGMT則可以對上述作用進行修復逆轉[5],減少相應的致突變、細胞毒作用等,導致腫瘤細胞對TMZ的耐藥[6],所以MGMT能夠直接反映細胞耐受的DNA損傷程度,是評價和預測TMZ治療是否敏感的重要參考指標。MGMT啟動子的CpG島結構富含CpG序列,此關鍵位點甲基化之后,可以抑制啟動子進行基因轉錄,從而降低MGMT蛋白的表達水平,甲基化程度越高者,其蛋白表達水平越低[7]。目前約35%的膠質瘤患者有MGMT啟動子甲基化,此外在長期生存患者的進一步檢測發現,該項指標比例約為90%[8]。有研究表明,MGMT陽性表達者中位生存期明顯低于陰性表達者,MGMT蛋白的表達水平與生存期呈負相關[9]。本研究結果證實MGMT啟動子甲基化的腦膠質瘤患者接受治療后的OS明顯長于非甲基化患者,結果有統計學意義;MGMT甲基化陽性的患者的PFS亦有延長。有Meta分析研究亦顯示MGMT甲基化的膠質瘤患者較非甲基化者的OS延長,PFS無明顯區別[10]。上述結果提示MGMT基因表達狀況是影響患者預后的重要因素,考慮原因系MGMT甲基化患者的MGMT蛋白水平下降,抑制受攻擊腫瘤細胞的DNA修復功能,增加了患者對TMZ的敏感性,故而有助于指導后續治療方案的制定。
IDH是一種催化異檸檬酸脫羧生成α-酮戊二酸的酶,IDH1作為還原型煙酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)的主要來源,參與了細胞的代謝轉化功能。IDH1突變常見于星形細胞瘤、少突膠質細胞瘤、少突星形細胞瘤及繼發性膠質母細胞瘤[11],有研究[9,12]發現IDH1突變的腦膠質瘤患者的中位生存期明顯高于無突變者,與生存率呈正相關性,且IDH1突變陽性率從低級別到高級別顯著下降。本研究結果亦表明,IDH1突變腦膠質瘤患者的OS及PFS較無突變患者延長,無統計學意義考慮系樣本量較少,但亦進一步提示IDH1突變與膠質瘤患者的生存預后存在密切聯系。本研究另一結果提示,MGMT甲基化聯合IDH1突變膠質瘤患者較MGMT非甲基化聯合IDH1無突變患者生存期明顯延長,考慮提示兩種分子病理指標進行聯合檢測,較單獨檢測更加有利于協助臨床工作中的診斷分級、預后及隨訪,有研究[13]發現兩種指標聯合檢測可以更好地預測膠質瘤患者的生存時間。亦有研究[14]提示腦膠質瘤患者中MGMT基因啟動子甲基化和IDH1突變之間關聯顯著,提示兩者之間可能存在互相促進調節的作用,考慮可能因為IDH1突變可導致2-羥基戊二酸(2-hydroxyglutaric acid,2-HG)異常增高,有效抑制去甲基化酶活性,從而誘導MGMT啟動子甲基化[15],且突變與P53突變、染色體lp19q雜合性缺失等狀態呈正相關,可影響腫瘤的惡性程度及對藥物敏感性,繼而延長患者生存時間[16]。
綜上所述,本研究表明腦膠質瘤患者的MGMT甲基化及IDH1是否突變與生存期顯著相關,是影響患者治療效果及生存預后的重要因素,兩者相結合對臨床工作中進行早期診斷、制定治療計劃、觀察療效及評價預后有一定的價值,兩者之間的分子水平聯系,與其他分子病理學指標的關系以及相應的臨床意義,尚需進一步的研究。

