細菌脲酶分解尿素機制及其調控
熊展博,趙圣國,王加啟
中國農業科學院北京畜牧獸醫研究所動物營養學國家重點實驗室,北京 100193
0 引言
脲酶(EC3.5.1.5)又稱尿素胺基水解酶,是一種高活性的非氧化還原金屬酶[1],其具有催化尿素分解產生二氧化碳和氨的能力[2]。相較于非催化反應,在脲酶催化作用下的尿素分解速度提高1.0×104~1.0×105倍,脲酶也被認為是目前已知的催化效率最高的水解酶[3]。在畜牧業中,尿素作為脲酶底物,是一種重要的反芻動物非蛋白氮飼料原料,可替代30%左右的蛋白飼料[4]。由于脲酶活性過高,使得尿素快速分解生成二氧化碳和氨,尿素分解速度大于尿素被利用的速度,從而降低了尿素的利用率和微生物蛋白合成效率,而且尿素氮的過度排放,造成環境污染[5]。反芻動物瘤胃內短期產大量氨氣提高血液中氨濃度,對動物機體的生產性能造成不利影響[6]。在環境生態方面,土壤中存在大量產脲酶微生物,脲酶高效的催化機制導致pH值的快速上升,導致氨揮發引發了大量土壤氮流失[7]。在人體健康方面,目前已知多種細菌脲酶是人類病原體的毒力因子,包括幽門螺旋桿菌(Helicobacter pylori)、金黃色葡萄球菌(Staphylococcus aureus)、結核分枝桿菌(Mycobacterium tuberculosis)、小腸結腸炎耶爾森菌(Yersinia enterocolitica)和新生隱球菌(Cryptococcus neoformans)[8]。目前,脲酶抑制劑可以有效調控脲酶活性,減少產氨反應。鑒于此,本文將按照細菌脲酶活性中心的結構特征、尿素水解機制和抑制劑調控脲酶活性機制進行闡述,研究細菌脲酶分解尿素的機制為有效調控脲酶活性提供理論基礎,探討化合物抑制脲酶活性的機制,以期對設計和合成新型環境友好脲酶抑制劑提供理論支持和參考。
1 細菌脲酶活性中心的結構特征
1.1 蛋白復合體
不同細菌脲酶結構蛋白的亞基數量與種類不同,但是不同細菌脲酶同一亞基具有同源性。第一個獲得三維脲酶結構的產氣克雷伯氏菌脲酶(Klebsiella Aerogenesurease,KAU)結構蛋白由UreA、UreB、UreC基因編碼的γ、β、α亞基組成,大多數細菌脲酶中,四級結構由三聚體(αβγ)3組成,三聚體有三個相同的活性位點均位于α亞基中,小腸結腸炎耶爾森菌脲酶是由(αβγ)3低聚體組裝成四面對稱的十二聚合體[(αβγ)3]4空心球體結構,幽門螺旋桿菌脲酶由4 個(αβ)3三聚體組成[(αβγ)3]4復合球體結構[9](圖1)。

圖1 不同細菌脲酶蛋白結構的組裝方式[9]
1.2 活性中心結構
隨著三維(3D)結構解析技術的日益成熟,高分辨率脲酶蛋白結構被越來越多的發現。目前蛋白數據庫(PDB)中含有312 個細菌源脲酶結構,其中來源于產氣克雷伯氏菌(Klebsiella aerogenes)(31個),巴氏芽孢桿菌(Sporosarcina pasteurii)(26個),大腸桿菌(Escherichia coli)(34 個),缺陷短波單胞菌(Brevundimonas diminuta)(25 個),枯草芽孢桿菌(Bacillus subtilis)(10 個),綠膿假單胞菌(Pseudomonas aeruginosa)(9 個),幽門螺旋桿菌(Helicobacter pylori)(4 個),炭疽芽孢桿菌(Bacillus anthracis)(2 個),小腸結腸炎耶爾森氏菌(Yersinia enterocolitica)(2 個)等。
脲酶活性位點位于UreC編碼的α亞基中,每個活性位點含有兩個鎳離子(Ni2+),每個金屬離子都與2 個組氨酸殘基的咪唑N原子結合,并與遠端的中性水分子結合[10],存在活性口袋中的水分子不僅與蛋白質主鏈或者氨基酸側鏈形成氫鍵,而且這些水分子之間相互形成氫鍵構成一個水合網絡。活性位點附近具有一個螺旋-轉角-螺旋基序(Helix-Turn-Helix),被稱作Flap區域(圖2),其功能是控制底物進入催化部位和釋放產物[3]。Flap區域上組氨酸的質子化狀態決定活性口袋的開放構象和閉合構象,并且受pH值的影響。例如在pH值6.5~7.0范圍內,巴氏芽孢桿菌的αHis323以50%的質子化和50%的中性形式存在;pH值<6.5時,脲酶晶體結構的鎳離子占有率比較低,Flap區域的電子密度弱,過酸條件破壞了活性中心的蛋白支架;而在pH值>7.5條件下脲酶蛋白結晶困難。通過閉合活動瓣,使脲酶蛋白Flap區域上組氨酸殘基接近活性位點,達到穩定活性口袋中尿素末端氨基的目的[11](圖3)。
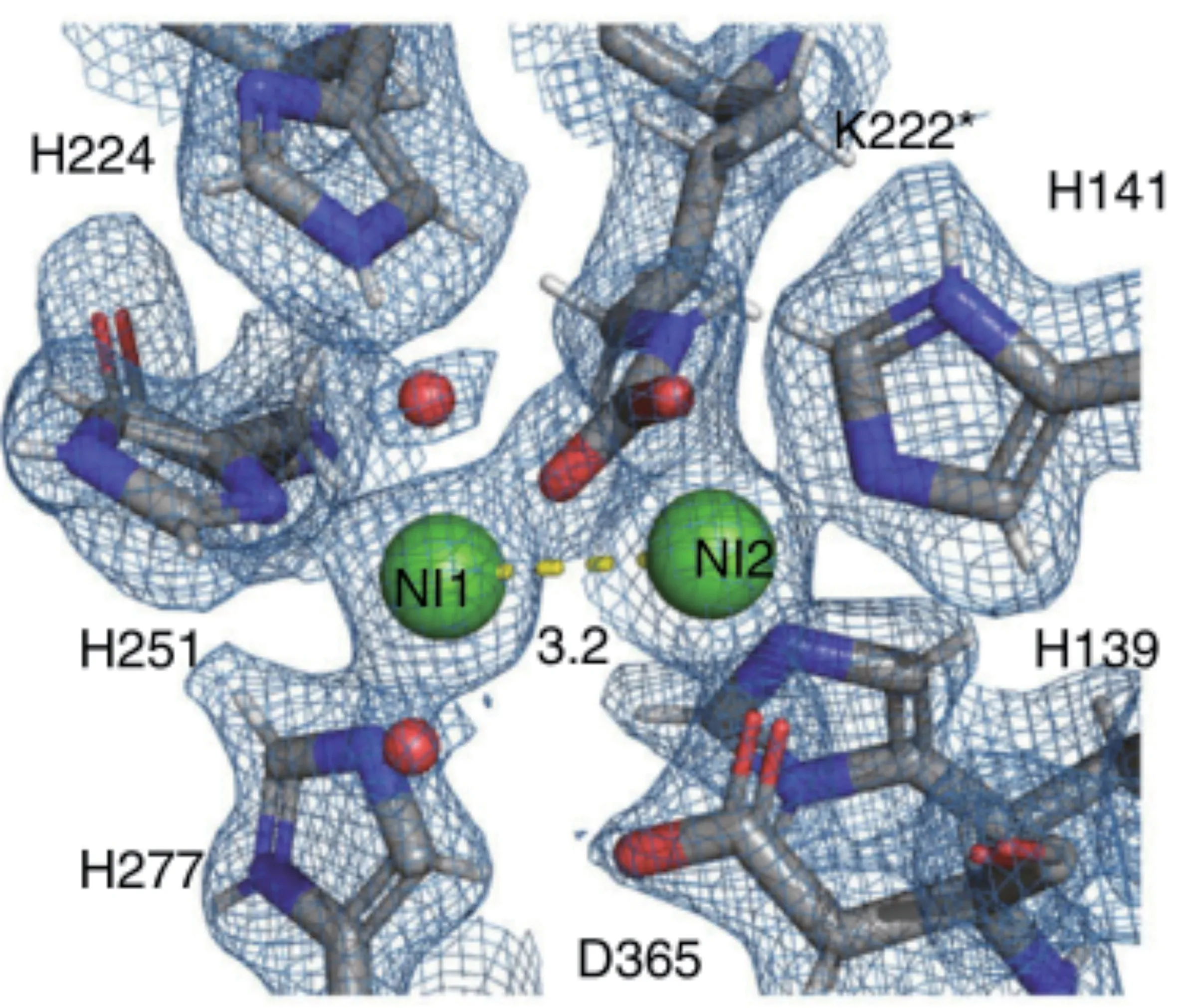
圖2 脲酶活性中心結構[10]
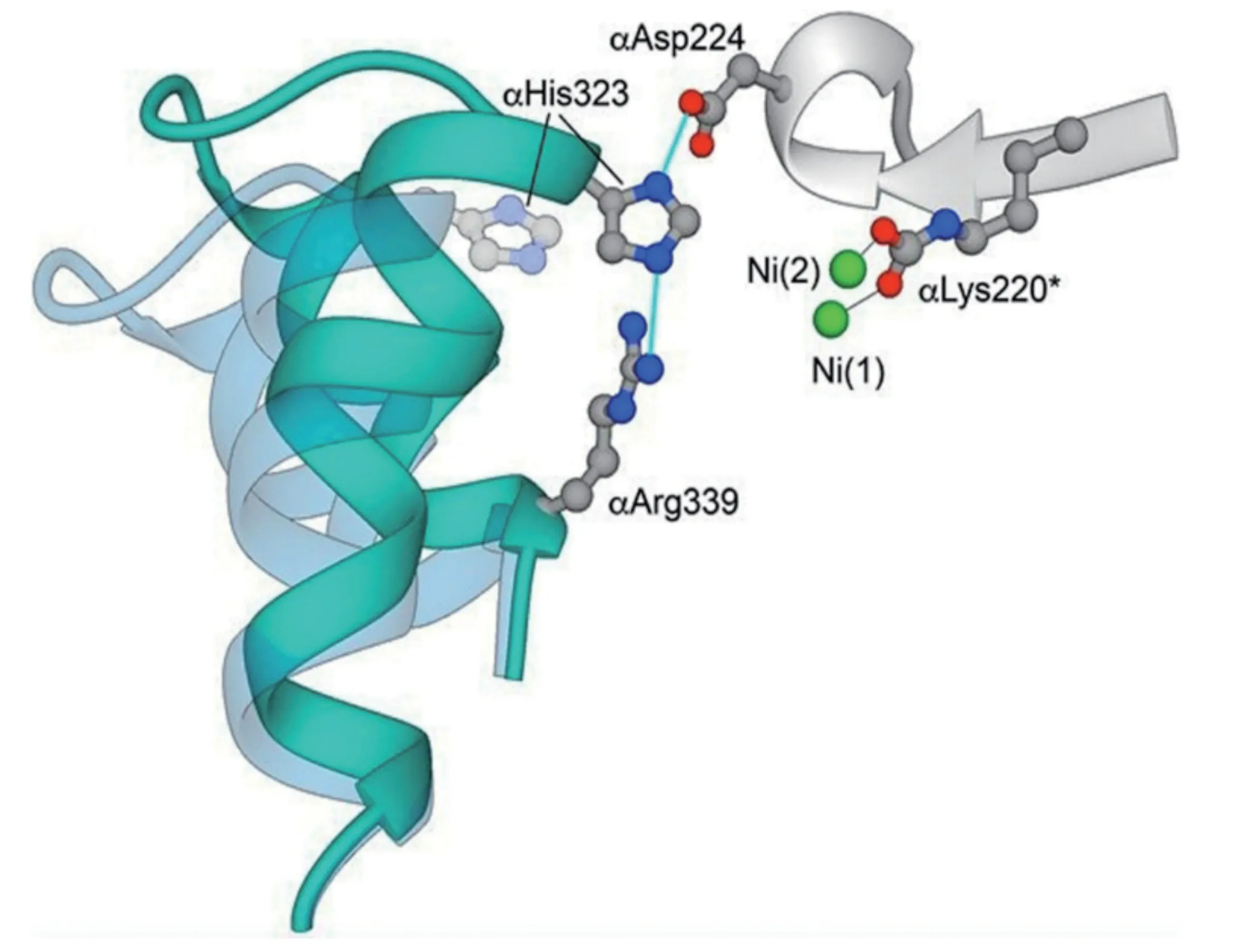
圖3 巴氏芽胞桿菌脲酶活性中心Flap 區域的閉合(寶藍色)和開放(透明藍色)結構圖[11]
2 尿素水解機制
尿素上的羰基氧與脲酶活性中心的Ni(1)螯合,然后在覆蓋活性中心的Flap區域的構象發生改變,脲酶活性口袋形成閉合構象,尿素上的氨基氮與Ni(2)進行結合,使尿素的中心碳原子缺乏電子。鎳橋上的氫氧化物對尿素中心缺電碳原子更容易進行親核攻擊,一個質子從金屬橋聯的C-OH基團轉移到氨基末端,產生的C-NH3+鍵斷裂后產生氨分子。Flap區域活動瓣打開后會釋放出氨和氨基甲酸鹽,后者會自發水解成一分子氨和碳酸氫鹽分子[2](圖4)。

圖4 脲酶水解尿素的模式圖[2]
3 抑制劑調控脲酶活性機制
脲酶活性的調控依賴于抑制劑化合物,目前,常用的脲酶抑制劑為乙酰氧肟酸。
乙酰氧肟酸(AHA)(分子式為C2H5NO2)屬于異羥肟酸化合物,具有良好的金屬螯合能力,乙酰氧肟酸可以與脲酶活性中心的鎳離子進行螯合,使其失去催化尿素分解的活性。在畜牧養殖業中廣泛應用于脲酶抑制劑領域,通過降低反芻動物生產中氮排出,提高動物的尿素等非蛋白氮利用效率。此外,AHA也是重要的人體藥物。
關于乙酰氧肟酸在脲酶催化位點的作用機制已經被充分證實,根據Zerner等[12]的研究表明,在正常pH值下天然刀豆脲酶的兩個鎳離子分別與1 個水分子和1 個氫氧根離子配位,活性中心是由與αAsp360連接的羧基[13]、αCys319硫醇的巰基[14]和組氨酸上的未知基團組成[15]。在此模型下,AHA的共振形式與鎳離子雙齒方式配位,該形式下的AHA-Ni復合物由活性部位附近陰離子(未知的堿基)平衡電位。與鎳離子配位的氫氧根離子對AHA羰基氧的親核攻擊可能導致更穩定復合物的形成,進而導致脲酶失活。該機制被Morrison和Walsh歸類為經典的快速結合競爭抑制機制[16,17]。
Stemmler 等[18]首次將乙酰氧肟酸與脲酶活性中心鎳離子結晶,并確定該復合物的X射線結構,發現乙酰氧肟酸通過羥肟酸鹽和羰基氧以雙齒形式與鎳離子結合,并且兩個鎳離子形成二聚肟橋。雖然已經有大量二聚肟絡合物相關研究[19],但是異羥肟酸氧與過渡金屬的橋聯雙齒形式是首次被觀察到[20]。廣泛認可的機制是異羥肟酸酯的羰基氧與活性位點一個鎳離子結合,隨后橋聯鎳離子的羥基陰離子對異羥肟酸的羰基碳的親核攻擊,出現二聚肟橋結構,從而形成更穩定的脲酶-抑制劑復合物,這是一種類似底物結合的過渡態四面體,阻止活性中心與底物結合達到抑制效果。
Matthew 通過對位于產氣克雷伯氏菌脲酶(Klebsiella Aerogenes Urease,KAU)活性部位的Flap區域上半胱氨酸319位點進行定點突變,發現該氨基酸殘基在催化中不起重要作用,但是對脲酶穩定性有影響。突變獲得多種變異體,發現變異體Cys319A具有接近野生型的活性和更穩定的結構。Cys319A與AHA結合的晶體結構表明:AHA與活性中心的兩個鎳離子結合,AHA的羰基氧與Ni(1)相互作用并且與His219的氮原子形成氫鍵,另一個氧原子橋聯兩個鎳離子。AHA取代活性位點中三個水分子(Wat-500、Wat-501和Wat-502)的空間位置,AHA的氮原子與Ala363主鏈羰基氧形成了額外的氫鍵。與AHA結合的Cys319A脲酶和天然Cys319A脲酶相比沒有明顯構象變化(圖5)。AHA的甲基與His320的氮原子相互作用可能迫使Flap區域活性瓣遠離活性位點,成為無序狀態[21]。
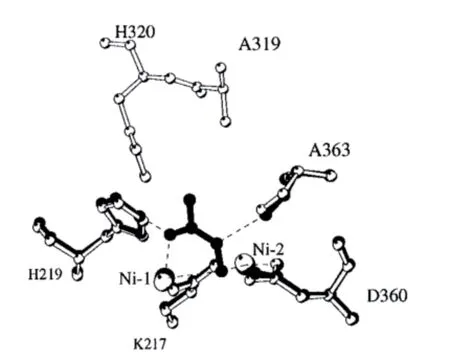
圖5 與AHA 結合的Cys319A 脲酶和天然Cys319A 脲酶結構比較[21]
4 展望
脲酶分解尿素機制涉及到脲酶活性的關鍵位點和氨基酸殘基,通過對關鍵位點結構分析,人工合成具有特異性的抑制劑化合物。目前研究者通過分子對接和化學修飾的方法獲得大量具有脲酶抑制作用的化合物,但用于動物生產和人類醫藥的化合物相對稀少。天然植物源的提取物具有天然安全、無毒害的特點,開發天然植物提取物作為脲酶抑制劑將是一個新思路。

