雙能CT虛擬單能量圖像在放療計劃系統中的應用研究
【作 者】李京,肖青,張祥斌,戴谷宇,柏森,鐘仁明
四川大學華西醫院 放療科,成都市,610041
0 引言
雙能CT的特點是高低兩種能量同源、同時、同向進行掃描,一次掃描后可以重建不同千電子伏特(keV)對應的虛擬單能量圖像,重建原理是將原始圖像分離成兩種基礎物質(通常用水和碘)并獲取物質密度投影數據對,通過在給定keV處線性組合質量密度圖來合成虛擬圖像[1],能提供準確的CT值[2],有替代常規圖像進行放療靶區勾畫和劑量計算的可能。
與常規圖像相比,VMI可以改善軟組織對比度和對比噪聲比(contrast-to-noise ratio,CNR)[3]。高keV圖像可以減少金屬偽影,改善金屬偽影對靶區及危及器官勾畫和劑量計算的不良影響[4]。已有研究證明:VMI在40 keV時可顯著提高胰腺癌腫瘤對比度和CNR[5],實現大腸癌肝轉移的最佳定量和定性病變描述[6],改善腹部惡性淋巴瘤的病變輪廓顯示[7];在60 keV時能獲取更好的頭頸部腫瘤對比度和CNR[8],可用于在深度學習網絡中[9]自動勾畫頭頸部危及器官;在75 keV時對肺癌患者的腫瘤顯示和CNR最佳[10],用140 keV重建并使用MARS(metal artifact reduction software)能很好地降低金屬偽影,且改善劑量計算問題[11]。
劑量計算是放療計劃的重要環節,治療計劃系統將圖像的CT值轉換成相對電子密度后才能進行劑量計算。因此VMI應用于放療的前提是探究其圖像能否被TPS識別,CT值轉化成相對電子密度后劑量計算結果的準確性。多項實驗使用DECT完成模體CT值到電子密度的轉化[12-14],但是VMI實際應用于放療計劃的劑量學研究尚不完善。筆者使用已獲得放療醫生和物理師批準的計劃,將相同的計劃參數移植到VMI和常規圖像上,探究劑量分布的差異。
1 材料和方法
1.1 模體選擇
本研究采用CIRS-062電子密度參考模體、仿真頭模和成年女性體模進行劑量學研究。CIRS-062電子密度模體,內含電子密度已知的人體各組織模擬插件(見圖1),用于測量不同keV參數重建圖像對應的CT值,并與常規圖像進行對比。仿真頭模和成年女性體模用于劑量分布驗證。
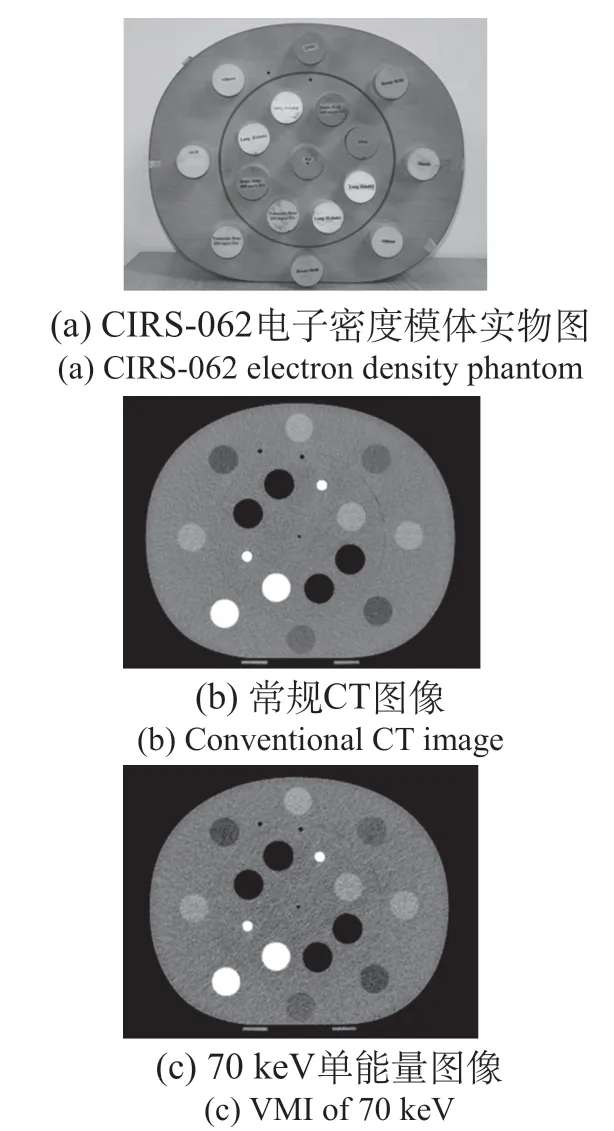
圖1 CIRS-062電子密度模體圖像Fig.1 Images of CIRS-062 electron density phantom
1.2 圖像獲取
在GE Revolution CT掃描儀上分別對三個模體進行CT掃描和圖像重建。放療常規使用峰值電壓(kilovolt peak,kVp)為120 kV的混合能量成像,其掃描參數為:管電壓120 kV,管電流180~540 mA,螺距0.992,層厚0.625 mm,重建圖像層厚3 mm,設為對照組。GSI[15]掃描參數為:管電壓80 kV/140 kV,管電流280 mA,螺距0.992,層厚0.625 mm,掃描后以10 keV為間隔從40 keV到140 keV重建出11組虛擬單能量圖像,重建層厚3 mm,設為試驗組。
1.3 CT值獲取
將獲得的CIRS-062電子密度模體的12組圖像導入治療計劃系統Eclipse(Version 13.5,Varian Medical System Inc.,Palo Alto,CA),選擇圓形感興趣區(range of interest,ROI)測量每組圖像上各插件CT值(致密骨插件ROI取38.05 mm2,其他插件取502.45 mm2,ROI與插件半徑之間留1 mm邊緣)[16-17],即為人體各組織對應的CT值,比較不同圖像CT值的差異。
1.4 計劃選擇與驗證
在Eclipse中導入仿真頭模和體模的對照組和試驗組CT圖像,選擇臨床使用的標準CT值-電子密度曲線(常規120 kVp掃描獲取)進行CT值到電子密度的轉化。選取經放療醫生和物理師批準的3例不同類型的放療計劃(見表1),將其計劃參數、計劃靶區體積(planning target volume,PTV)分別移植到12組圖像上,重新計算后得到劑量分布[18]。在放療計劃中,靶區需要接受足夠劑量的照射,因此PTV的劑量體積直方圖(dose volume histogram,DVH)是評估劑量分布的重要指標。從Eclipse獲取DVH,統計SBRT計劃中覆蓋100%體積的劑量(D100),IMRT和VMAT計劃中覆蓋95%體積的劑量(D95),并計算VMI 與常規圖像上的標準化劑量差(δD=|DVMI-D120kVp|/Dprescription)[19]。將Eclipse的驗證計劃、PTV結構、劑量分布和CT圖像導入3DVH(Version 3.3.1,Sun Nuclear Corporation,Melbourne,FL,USA)三維劑量驗證系統,重建靶區的劑量分布,調整γ通過率參數(標準2%/2.000 mm,閾值0.001%)后可分析VMI和常規圖像每個體素的劑量差值[20]。
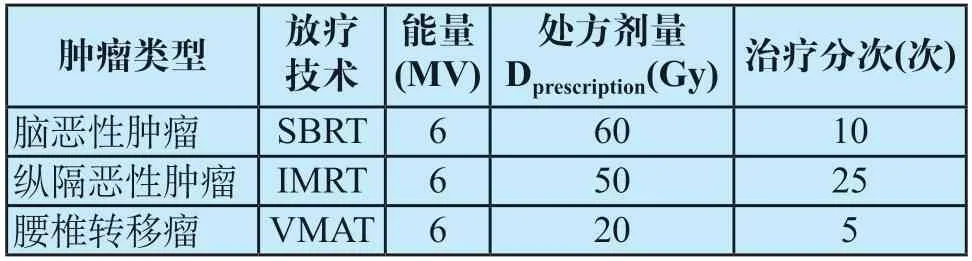
表1 三例放療計劃的基本信息Tab.1 The basic information of the 3 treatment plans
2 結果
2.1 CT值比較
通過對CIRS-062電子密度模體掃描和測量,各插件對應組織的CT值列于表2。致密骨在不同圖像上CT值變化最大,70 keV、80 keV圖像與常規圖像差值僅有70~80 Hu,40 keV圖像則高達1 212 Hu。梁骨差異略小,差值范圍在20~365 Hu之間。脂肪、乳腺差異均在100 Hu以內,呼氣肺、吸氣肺、肌肉和肝臟在不同圖像上的CT值變化小于40 Hu。水的CT值變化均在3 Hu以內。不同單能量圖像間CT值比較發現,40 keV圖像與常規圖像CT值的差值高于其他虛擬單能量圖像,70 keV、80 keV圖像的差值最小。

表2 不同圖像上測得的各組織CT值(Hu)Tab.2 CT value of tissues measured on different images
2.2 劑量分布
三例計劃表現出的靶區劑量分布差異一致:在40 keV圖像上,DVH與常規圖像差異最大;在40~70 keV圖像上,差異隨能量增加而逐漸減小;在70~140 keV圖像上差異較小。部分VMI與常規圖像的局部DVH比較,如圖2所示。
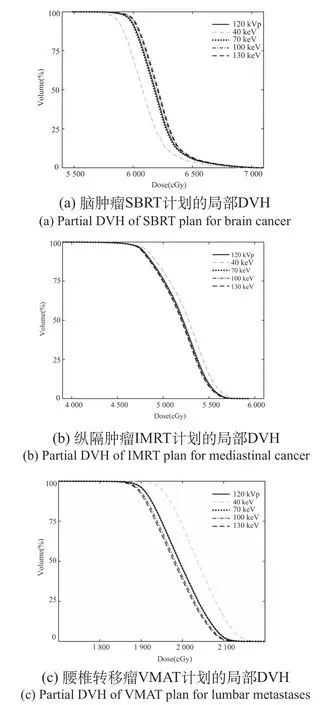
圖2 VMI和常規圖像驗證計劃中PTV的局部劑量體積直方圖Fig.2 Partial DVH of PTV in VMI and normal image verification plan
從常規圖像的靶區DVH中讀取劑量學特征值作為對照,試驗組VMI的DVH特征值及其與對照組的比較如表3所示。所有單能量圖像的標準化劑量差均在2%以內,其中70 keV的特征值與對照組最相似,δD接近于0%。
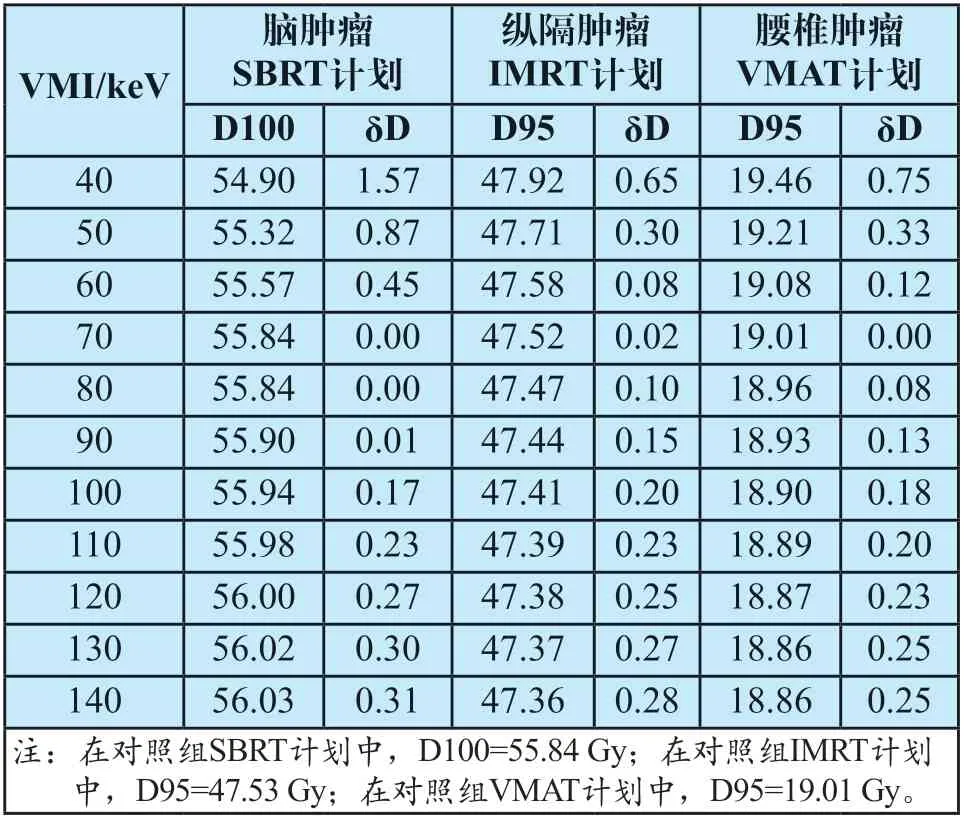
表3 靶區劑量(Gy)及標準化劑量差(%)統計Tab.3 Statistics of target dose (Gy) and standardized dose difference (%)
將常規圖像的劑量分布作為對照組,統計其與VMI劑量分布在每個體素的差值(見表4)。以70 keV為例,體素的劑量差統計直方圖如圖3所示,在±0.1 Gy以內的頻數最高,較大劑量差值的頻數很低。
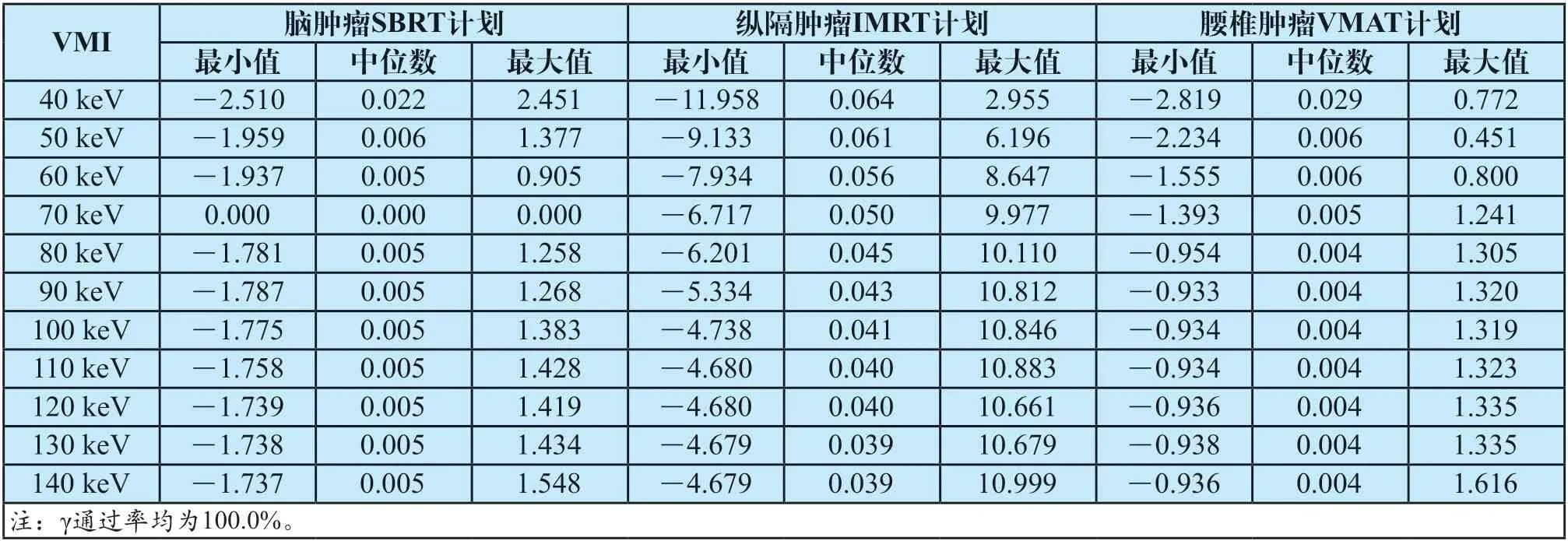
表4 體素劑量差值統計(Gy)Tab.4 Statistics of voxel dose difference (Gy)
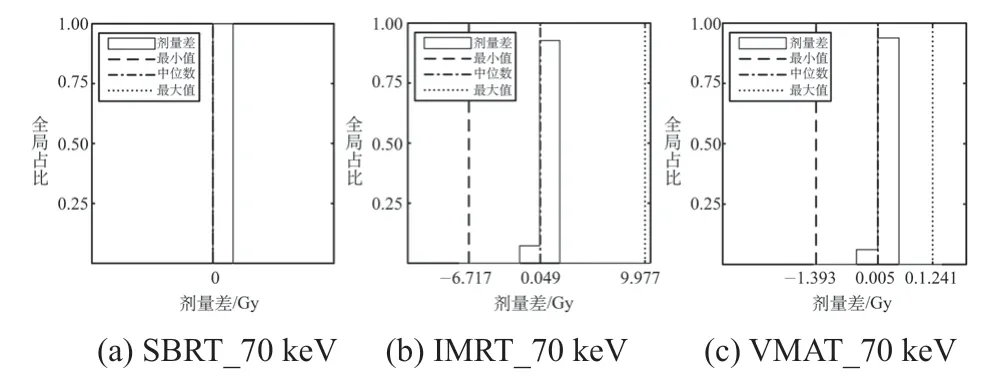
圖3 三例計劃在70 keV與對照組中體素劑量差的統計直方圖Fig.3 Statistical histogram of voxel dose difference between 70 keV and control group for the three plans
3 討論
虛擬單能量圖像對腫瘤病灶顯示有很大優勢,高keV圖像還能有效減少金屬偽影及其產生的劑量學效應[4]。與放療常規成像方式相比,雙能CT在更低或相等的輻射劑量下獲取補充重建[8],可改善放療流程中的靶區勾畫和劑量計算。研究使用CIRS電子密度模體和人體仿真模體,測量不同VMI的CT值并在將其應用于TPS中,對6 MV光子計劃的劑量學差異進行了初步研究。
各組織在不同VMI中CT值與常規圖像有不等的差別,例如致密骨在40 keV時CT值的差別高達1 212 Hu,水的CT值在各單能量圖像上均低于3 Hu。CT值的差異取決于各組織相應的衰減系數μ,μ隨射線能量、物質的有效原子序數和電子密度而變化[21],常規成像得到峰值電壓為120 kV的混合圖像,VMI則是雙源峰值電壓80 kV和140 kV掃描后重建的單能量圖像,且各組織的物理性質不同,因此表現出不同程度的CT值差異。但兩種成像方式獲得的CT值經過TPS中標準曲線(常規120 kVp掃描)轉化成電子密度,以及AAA算法對組織不均勻性的校正后,相同計劃參數下獲得的劑量分布差異并不大。具體表現為:在體素劑量差值統計中,差值集中分布在0 Gy,且全局劑量γ通過率(2%/2 mm)均為100.0%,劑量差異非常細微。在靶區劑量評估中,試驗組和對照組的劑量差在處方劑量2%以內,是臨床上可以接受的誤差,70~140 keV圖像的DVH曲線與對照組很接近,證明累計劑量差異也在臨床可接受的范圍。
本研究證實了雙能CT掃描后重建的虛擬單能量圖像可采用已有的標準CT-電子密度曲線直接應用于TPS中,且70~120 keV圖像與常規120 kVp圖像6 MV光子計劃的劑量分布基本一致。在此前提下,可以探究不同部位腫瘤在臨床上圖像質量最佳的虛擬單能量圖像以用于精確的靶區勾畫,再將靶區結構移植到70 keV圖像上,基于TPS標準CT值-相對電子密度曲線進行放療計劃設計。也可以探究去金屬偽影效果最佳的高keV圖像,直接應用于TPS中進行CT值和相對電子密度的轉換并設計治療計劃。

