米諾環素通過Wnt/β-Catenin通路對大鼠牙髓干細胞成骨分化的影響
杜帥俠,姚秀翠,段 珂,王 靜
牙周病是一種常見的口腔疾病,會引起成人失牙,臨床上表現為牙齦出血、炎癥、牙槽骨吸收及牙齒松動移位等,嚴重影響患者正常生活。近年來,越來越多的學者展開了基于干細胞的骨組織工程相關研究,使骨再生成為可能。牙髓干細胞(dental pulp stem cells, DPSCs)是一種間充質干細胞,來源豐富、易于取材并且使用無倫理爭議,是骨組織工程的重要種子細胞[1-2]。Wnt/β-連環蛋白(Wnt/β-Catenin)信號通路是促進組織損傷修復和再生的重要通路之一,在DPSCs成骨分化和牙齒生長發育過程中起著重要的調控作用[3-4]。Wnt/β-Catenin信號通路激活后,會抑制糖原合成酶激酶-3β(glycogen synthase kinase-3β, GSK-3β)的磷酸激酶活性,拮抗β-Catenin的降解,使其大量聚集并進入細胞核激活下游靶基因,發揮生物學效應[5-6]。Mao等[7]研究表明,可通過調控GSK-3β/β-Catenin信號通路,在正畸過程中促進牙齒移動部位骨形成,該通路可作為潛在的臨床牙科治療靶點。米諾環素(minocycline, MINO)是一種廣譜抗菌的四環素類抗生素,近年來研究者們發現它除了具有抗菌作用,還有抑制骨吸收、促進新骨形成的作用[8],但其作用機制尚未明確。據此,本研究擬采用不同劑量的米諾環素干預體外培養的大鼠牙髓干細胞(RDPSCs),觀察并檢測RDPSCs成骨分化各項指標以及Wnt/β-Catenin通路的變化,探討米諾環素對RDPSCs成骨分化的作用及機制,以期為RDPSCs應用于牙周病治療的臨床研究提供一定科學指導。
1 材料與方法
1.1 主要試劑與儀器
RDPSCs購自上海ATCC細胞庫;米諾環素購自默克化工技術(上海)有限公司;DMEM培養基和細胞培養板購自賽默飛世爾科技(中國)有限公司;二甲基亞砜(dimethyl sulfoxide, DMSO)和0.2%胰蛋白酶溶液購自武漢普諾賽生命科技有限公司;堿性磷酸酶(alkaline phosphatase, ALP)染色試劑盒、蛋白質免疫印跡(Western blot, WB)二抗購自上海碧云天生物技術公司;骨鈣素試劑盒購自上海酶聯生物科技有限公司;茜素紅、蛋白提取試劑盒和蛋白濃度測定試劑盒購自北京索萊寶科技有限公司;RNA提取試劑盒購自南京諾唯贊生物科技股份有限公司;反轉錄試劑盒購自北京百奧萊博科技有限公司;實時熒光定量PCR檢測試劑盒購自北京鼎國昌盛生物技術有限責任公司;ALP檢測試劑盒、β-Catenin抗體、GSK-3β抗體和Runx2抗體購自艾博抗(上海)貿易有限公司。
生物安全柜購自賽默飛世爾科技(中國)有限公司;CO2培養箱購自美國Forma公司;臺式高速冷凍離心機購自德國Eppendorf公司;Facscalibur流式細胞儀購自美國BD公司;垂直板電泳槽、蛋白轉膜儀、凝膠成像系統、酶標儀購自美國Bio-Rad公司。
1.2 方法
1.2.1 實驗分組 將RDPSCs復蘇培養24 h后隨機分為5組,每組6個平行對照,A組:對照組(不加米諾環素);B組:0.1 mg/L米諾環素組;C組:1.0 mg/L米諾環素組;D組:10.0 mg/L米諾環素組;E組:100.0 mg/L米諾環素組。各組均加入成骨分化誘導液(每100 mL 10% FBS DMEM培養基中含10 mmol/L β-甘油磷酸鈉、0.2 mmol/L抗壞血酸和100 nmol/L地塞米松)。
1.2.2 CCK-8法檢測細胞增殖率 將RDPSCs細胞以1×104個/mL的密度接種于96孔板中,細胞貼壁后按照1.2.1中的分組進行處理。分別在細胞培養1、7、14 d時,加入10 μL的CCK-8溶液,培養箱中孵育1 h,使用酶標儀檢測每孔450 nm處OD值。細胞增殖率=(實驗組-空白組)÷ (對照組-空白組)×100%。當培養至7 d時,細胞增殖率最接近50%,選取7 d作為后續實驗培養時間點。
1.2.3 測定細胞堿性磷酸酶(ALP)活性和骨鈣蛋白(OCN)含量 將RDPSCs細胞配制為2×105個/mL密度的單細胞懸液,2 mL/孔接種于6孔板中培養至貼壁,按照1.2.1中的分組進行處理。培養箱中培養7 d,每3 d換液1次。棄去培養基后用胰蛋白酶消化細胞,終止并4 ℃、1 500 r/min離心10 min,無菌PBS洗滌細胞2次,收集細胞加入細胞裂解液,隨后按照ALP檢測試劑盒或骨鈣素試劑盒說明書操作,于405 nm或450 nm處測OD值,計算ALP或OCN水平。
1.2.4 細胞ALP染色 取對數生長期的RDPSCs細胞,以5×104個/mL的密度接種于24孔板中,待細胞貼壁后,按照1.2.1中的分組進行處理,37 ℃、5% CO2條件下培養7 d,每3 d更換1次培養基。棄去培養基并用磷酸鹽緩沖液(phosphate buffered saline, PBS)洗滌細胞3次,甲醛固定細胞后再次PBS洗滌,加入200 μL/孔的ALP染液,室溫避光顯色20 min,棄去染液后用PBS洗滌,晾干后于顯微鏡下觀察結果并記錄。
1.2.5 茜素紅S染色檢測細胞鈣鹽沉積量 將RDPSCs細胞以5×104個/mL的密度接種于24孔板中,培養至貼壁后按照1.2.1中的分組進行處理。37 ℃、5% CO2條件下培養7 d,每3 d更換1次培養基。棄去培養基,PBS洗滌細胞,固定細胞后進行茜素紅S染色,PBS洗滌,顯微鏡下觀察并拍照,隨后用20%醋酸溶解,檢測每孔405 nm處OD值。
1.2.6 qRT-PCR檢測ALP和OCN mRNA表達情況 根據RNA提取試劑盒說明書提取各組細胞中的總RNA,以其為模板反轉錄成cDNA后進行qRT-PCR檢測ALP和OCN mRNA表達情況,引物序列如表1所示。
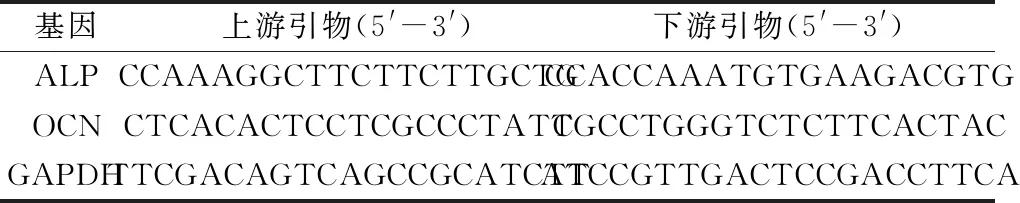
表1 引物序列
1.2.7 WB檢測GSK-3β、β-Catenin和Runx2蛋白表達水平 在6孔板中接種2 mL密度為2×105個/mL的RDPSCs細胞,待貼壁后按照1.2.1中的分組進行處理。培養7 d后棄去培養基,加入胰蛋白酶消化細胞,PBS終止后低溫1 500 r/min離心10 min,洗滌2次后收集細胞,加入細胞裂解液,按照試劑盒說明書提取細胞總蛋白并根據BCA試劑盒測定蛋白總濃度。后取50 μg進行SDS-PAGE電泳,電泳結束取出凝膠,使用電轉儀將蛋白轉至PVDF膜,用5%脫脂奶室溫封閉1 h,加入稀釋(1∶1 000)的對應一抗,4 ℃孵育過夜,棄去一抗溶液并洗滌PVDF膜,加入稀釋(1∶2 000)的二抗溶液,室溫搖床1 h,洗膜3次,ECL顯色并用凝膠成像系統拍照。
1.3 統計學方法
各組實驗數據以平均數±標準差表示,采用SPSS 20.0軟件對數據進行統計學分析,多組間比較采用單因素方差分析,兩組間比較采用SNK-q檢驗。F表示整個擬合方程的顯著性,F越大表示越顯著,擬合程度也就越好;P反映對照組與實驗組差異大小,以P<0.05表示差異有統計學意義。
2 結 果
2.1 RDPSCs細胞形態學觀察
如圖1所示:細胞形態以纖維狀為主,排列緊密且具有典型的旋渦狀特點,符合RDPSCs特點。

圖1 RDPSCs細胞形態學光鏡下觀察( ×200)
2.2 米諾環素對RDPSCs細胞增殖率的影響
結果顯示,與對照組相比,米諾環素各組細胞增殖率顯著升高(P<0.05),14 d時,10.0 mg/L組相比0.1 mg/L組、100 mg/L組相均比1.0 mg/L組有所下降,如表2、圖2所示。

表2 米諾環素對RDPSCs細胞增殖率的影響

*:與A組相比,P<0.05
2.3 米諾環素對RDPSCs細胞ALP活性和OCN含量的影響
由結果可知,與對照組相比,0.1、1.0 mg/L米諾環素組ALP活性和OCN含量顯著升高(P<0.05),10.0、100.0 mg/L米諾環素組ALP活性和OCN含量顯著降低(P<0.05),如表3,圖3、4所示。
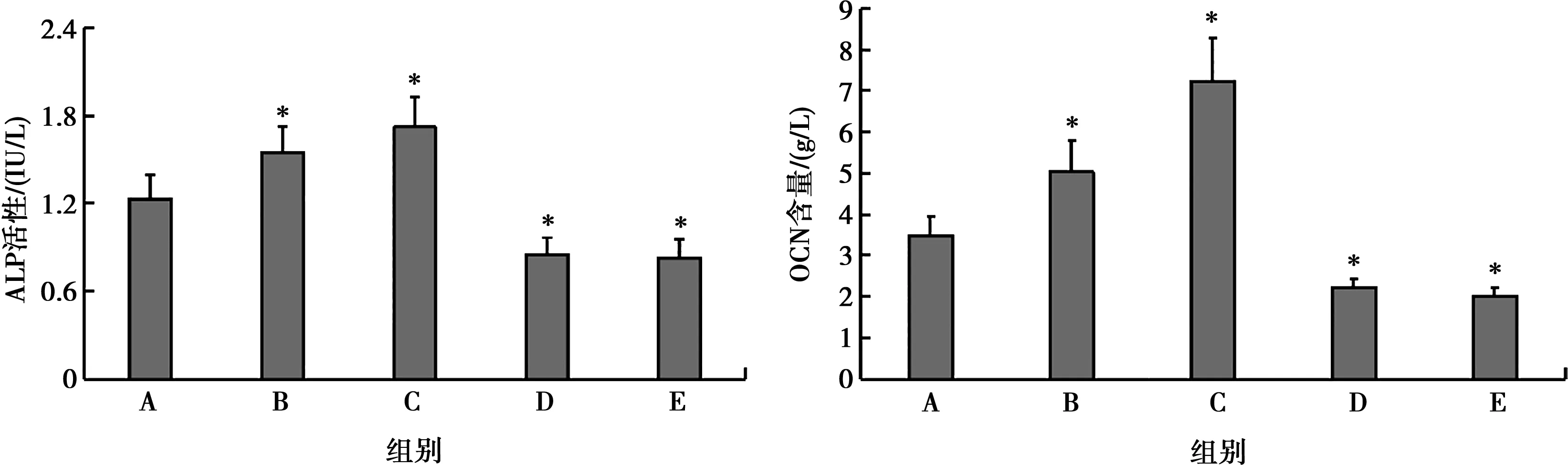
*:與A組比較,P<0.05

表3 米諾環素對RDPSCs細胞ALP活性和OCN含量的影響
2.4 米諾環素對RDPSCs細胞鈣鹽沉積的影響
結果顯示,與對照組相比,0.1、1.0 mg/L米諾環素組細胞鈣鹽沉積量明顯上升(P<0.05),10.0、100.0 mg/L米諾環素組細胞鈣鹽沉積量明顯下降(P<0.05),如表4,圖5、6所示。
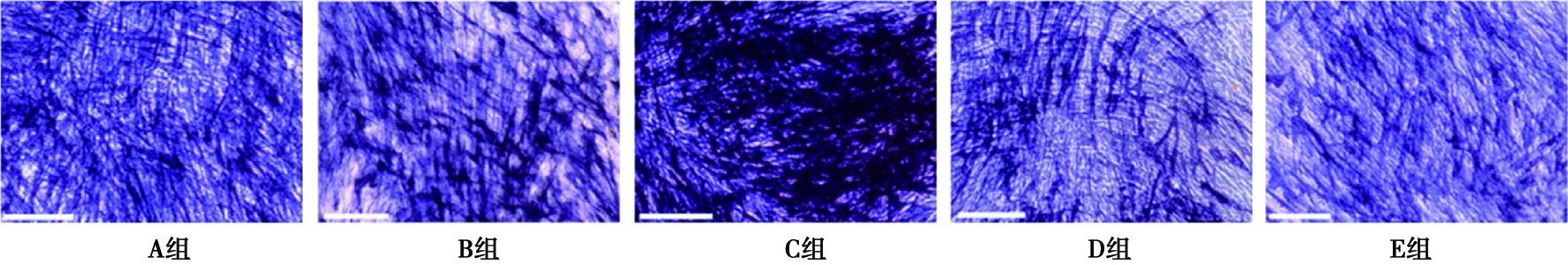
比例尺:200 μm
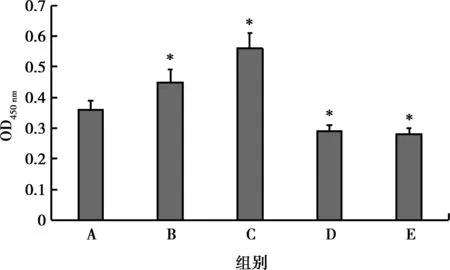
*:與A組比較,P<0.05
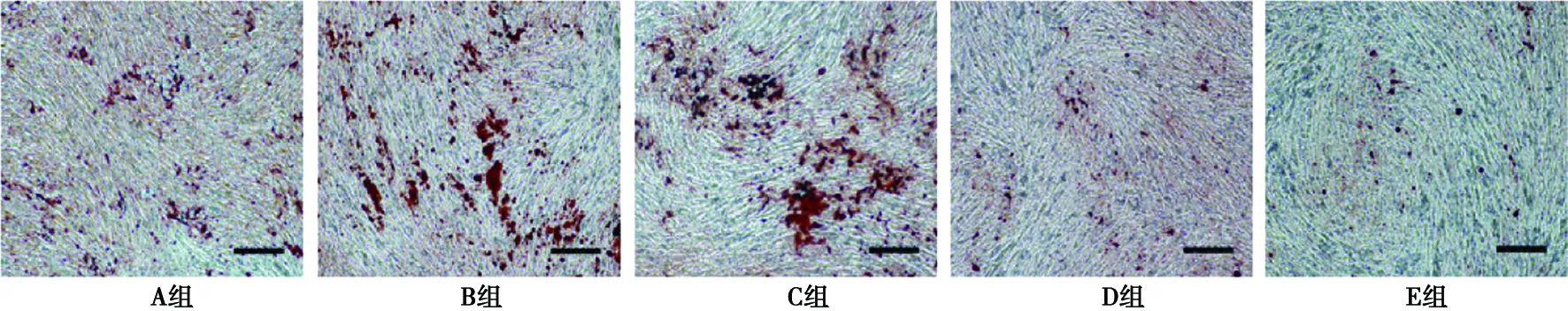
比例尺:500 μm

表4 米諾環素對RDPSCs細胞鈣鹽沉積的影響
2.5 米諾環素對RDPSCs細胞ALP和OCN mRNA表達的影響
由結果可知,與對照組相比,0.1、1.0 mg/L米諾環素組ALP和OCN mRNA表達水平顯著升高(P<0.05),10.0、100.0 mg/L米諾環素組ALP和OCN表達顯著降低(P<0.05),如表5、圖7所示。

*:與A組相比,P<0.05

表5 米諾環素對RDPSCs細胞ALP和OCN mRNA表達的影響
2.6 米諾環素對RDPSCs細胞GSK-3β、β-Catenin和Runx2蛋白表達的影響
由結果可知,與對照組相比,0.1、1.0 mg/L米諾環素組GSK-3β蛋白表達量顯著降低,β-Catenin和Runx2蛋白表達量顯著升高(P<0.05),10.0、100.0 mg/L米諾環素組GSK-3β蛋白表達量顯著升高,β-Catenin和Runx2蛋白表達量顯著降低(P<0.05),如表6,圖8、9所示。
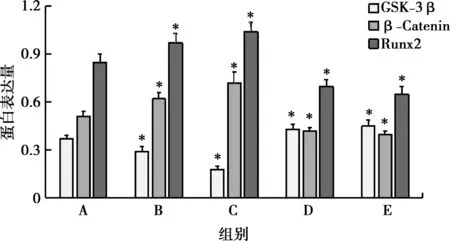
*:與A組相比,P<0.05
表6 米諾環素對RDPSCs細胞GSK-3β、β-Catenin和Runx2蛋白表達的影響
3 討 論
牙周病可導致牙槽骨的病理性吸收,造成成人失牙。DPSCs增殖活性高,具有多向分化潛力,目前關于它的組織工程應用研究主要集中在修復受損牙本質、成骨分化和成神經細胞分化等方面[9-13], 為臨床口腔疾病的治療帶來希望。米諾環素是一種半合成的四環素類藥物,研究表明它能夠有效抑制牙周致病菌繁殖,消除細菌感染,抑制破骨細胞活性并減少骨吸收,還可以促進牙周組織再生、新骨形成[14]。
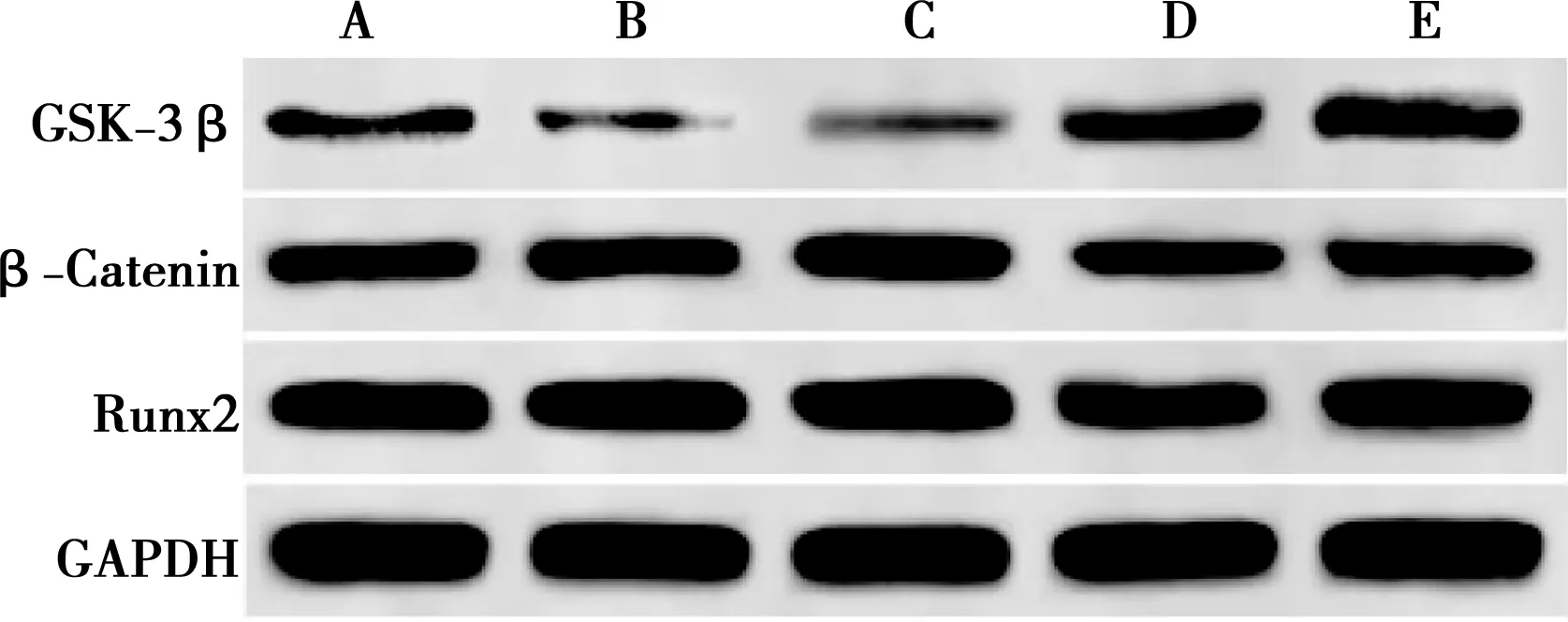
圖9 米諾環素對RDPSCs細胞GSK-3β、β-Catenin和Runx2蛋白表達的影響
Tabatabaei等[15]發現,DPSCs可在體外被誘導分化為成骨細胞,表達典型的成骨細胞標志物ALP和OCN,產生礦化基質。有研究發現,米諾環素作用于成骨細胞后,可促進細胞ALP和OCN表達,促進細胞增殖、成骨分化和礦化[16]。米諾環素還可促進損傷脊髓處骨髓間充質干細胞的募集,并且促進其體外增殖[17]。本研究結果顯示,與對照組相比,0.1、1.0 mg/L米諾環素組牙髓干細胞的增殖率、骨形成指標ALP和OCN含量、細胞鈣鹽沉積量均顯著升高,10.0、100.0 mg/L米諾環素組細胞增殖率較對照組顯著升高,骨形成指標ALP和OCN含量及二者表達水平、細胞鈣鹽沉積量均顯著降低,提示低濃度的米諾環素對牙髓干細胞成骨分化起促進作用,高濃度則起抑制作用,提示臨床用藥時應注意把握劑量。
Wnt/β-Catenin信號通路參與調節多個生物過程,當通路未激活時,細胞質中的β-Catenin、GSK-3β和軸抑制蛋白(axis inhibitor, Axin)、腺瘤樣息肉蛋白(adenoatous polyposis coli, APC)結合形成四聚體,使得GSK-3β能夠持續磷酸化β-Catenin,磷酸化的β-Catenin在蛋白酶的作用下發生降解,Wnt信號通路就此被抑制;當Wnt信號通路激活時,會產生傳導信號抑制GSK-3β、Axin和APC的活性,四聚體發生解離從而釋放β-Catenin,使得細胞質中不斷積累β-Catenin,隨后未降解的β-Catenin進入細胞核,與轉錄因子結合,啟動Wnt信號通路下游靶基因Runt相關轉錄因子2(recombinant Runt related transcription factor 2, Runx2)[18-19]。Luo等[20]研究報道,激活Wnt/β-Catenin通路可抑制骨髓干細胞成脂分化,促進其成骨分化。Jiang等[21]研究發現,在體外培養的人牙周膜干細胞中加入雌激素,可激活Wnt/β-Catenin信號通路從而促進細胞的成骨分化。本研究結果顯示,與不加米諾環素的對照組相比,0.1、1.0 mg/L米諾環素組牙髓干細胞β-Catenin和Runx2蛋白水平顯著升高,GSK-3β蛋白水平顯著降低,而10.0、100.0 mg/L米諾環素組牙髓干細胞β-Catenin和Runx2蛋白水平顯著降低,GSK-3β蛋白水平顯著升高,表明低濃度的米諾環素可激活Wnt/β-Catenin通路,高濃度則可抑制Wnt/β-Catenin通路活化,與上述不同濃度米諾環素對RDPSCs成骨分化的影響一致。
綜上所述,米諾環素可通過調控Wnt/β-Catenin信號通路影響RDPSCs成骨分化,低濃度米諾環素促進RDPSCs成骨分化,高濃度米諾環素則抑制RDPSCs成骨分化。本研究僅初步探討了米諾環素對RDPSCs成骨分化以及Wnt/β-Catenin信號通路的影響,RDPSCs的成骨分化還涉及Wnt信號通路與許多其他通路的共同協作,明確其中機制還需更深一步的研究。

