膿毒癥休克患者血清Kal、VE-Cad的變化及與預后的關系*
吳微華,俞振飛,程抗,安鵬,張偉,陳雲,葉肖琳
(1.杭州市丁橋醫院 重癥醫學科,浙江 杭州310021;2.浙江中醫藥大學附屬第二醫院重癥醫學科,浙江 杭州310005)
膿毒癥休克是重癥監護病房(ICU)患者死亡的主要原因,具有發病急、進展快、病死率高等特點,由于膿毒癥休克臨床表現錯綜復雜,因此準確評估膿毒癥休克患者的病變嚴重程度及預后,對降低病死率具有重要意義[1]。人源性激肽釋放酶結合蛋白(Kallistatin, Kal)是一種絲氨酸蛋白酶抑制劑,在人類組織和體液中廣泛分布,具有抗炎、抗腫瘤、抗血管生成、抗氧化應激和抗凋亡等作用,參與炎癥、高血壓、心肌梗死、腫瘤、纖維化、血管生成等多種疾病的病理生理學過程,有研究顯示Kal 在肺炎[2]、血管炎[3]、骨關節炎[4]等多種疾病中發揮抗炎作用,然而,血清Kal 作為評估膿毒癥休克患者預后的生物標志物的臨床價值仍有待闡明。膿毒癥休克的核心病理過程是炎癥和氧化應激導致血管內皮損傷、毛細血管滲漏,血管內皮鈣黏蛋白(vascular endothelial cadherin, VE-cad)是血管內皮細胞之間黏附連接的特異性鈣黏蛋白,在維持血管內皮細胞極性和完整性等方面具有重要作用[5],但血清VE-cad 的表達與膿毒癥休克患者疾病嚴重程度及預后的研究尚不多見。本研究通過檢測不同預后膿毒癥休克患者血清Kal、VE-cad 水平變化,分析Kal、VE-cad 與急性生理學及慢性健康狀況Ⅱ(APACHE Ⅱ)評分和序貫器官功能衰竭估計(SOFA)評分的相關性,旨在探討兩者對膿毒癥休克患者預后評估的意義。
1 資料與方法
1.1 一般資料
前瞻性選取2016年3月—2018年3月杭州市丁橋醫院重癥醫學科收治的膿毒癥休克患者252例。納入標準:①臨床資料完整;②符合“膿毒癥3.0 指南”的診斷標準[6];③年齡≥18 歲;④住院時間>1 d;⑤患者或家屬知情同意并簽署同意書。排除標準:①妊娠;②中樞神經系統或嚴重免疫缺陷;③心力衰竭;④慢性肝腎疾病終末期、腫瘤晚期;⑤既往存在煙草、酒精或毒品依賴;⑥臨床資料不完整;⑦依從性差。最終納入研究的患者為178例。本研究經杭州市中醫院倫理委員會批準。根據患者28 d預后,分為存活組120例和死亡組58例。兩組年齡、性別、感染類型、病原學情況比較,差異無統計學意義(P>0.05),具有可比性。
1.2 儀器與試劑
Sysmex XT-4000i 全自動五分類血細胞分析儀購自日本希森美康株式會社,BS-600 全自動生化分析儀購自中國深圳邁瑞生物醫療電子股份有限公司,OTTOMAN 全自動特定蛋白即時檢測分析儀購自中國武漢錦之琪醫療器械有限公司,VITROS5600 全自動生化免疫分析儀購自美國強生公司。酶聯免疫吸附試驗(ELISA)試劑盒購自美國R&D systems 公司,“三明治免疫夾心法”檢測試劑盒購自美國Abcam 公司。
1.3 方法
采集患者入院24 h 內外周靜脈血5 ml,2 管分裝,其中一管注入EDTA 抗凝試管,不經離心處理,置于-20℃冰箱保存,采用Sysmex XT-4000i 全自動五分類血細胞分析儀檢測白細胞(WBC)水平,另一管經3 000 r/min 離心5 min,取上清液,置于-20℃冰箱保存,采用BS-600 全自動生化分析儀檢測血清白蛋白(ALB)水平;采集患者入ICU 第1 天、第3 天、第5 天的外周靜脈血5 ml,3 000 r/min 離心5 min,取上清液,置于-20℃冰箱保存,采用OTTOMAN 全自動特定蛋白即時檢測分析儀檢測血清C 反應蛋白(CRP)、降鈣素原(PCT)水平;采用ELISA 法檢測血清Kal 水平,采用“三明治免疫夾心法”檢測血清VE-cad 水平,操作嚴格按照試劑盒說明書進行。
1.4 膿毒癥休克患者治療措施及觀察指標
積極液體復蘇、抗感染、肺保護性機械通氣、血管活性藥物和控制血糖等,血管活性藥物多巴胺初始劑量為1 μg/(kg·min)、逐漸增加劑量≤20 μg/(kg·min),去甲腎上腺素初始劑量為0.05 μg/(kg·min)、逐漸增加劑量≤0.5 μg/(kg·min)[7]。收集患者的姓名、年齡、性別、機械通氣時間、感染類型、ICU住院時間。入院24 h內行PICCO監測,當日指標為每天3次測量的平均值,并記錄血管外肺水指數(EVLWI)及其他血流動力學指標,連續監測5 d 或患者死亡。患者入院24 h內采集外周靜脈血進行血培養并檢測病原學情況,同時對患者進行APACHEⅡ評分[8]及SOFA 評分[9]。
1.5 統計學方法
數據分析采用SPSS 23.0 統計軟件,計量資料以均數±標準差(x±s)表示,比較做t檢驗或重復測量設計的方差分析;計數資料以構成比或率(%)表示,比較采用χ2檢驗;相關分析用Pearson 法,繪制ROC 曲線,采用Logistic 回歸分析膿毒癥休克死亡的危險因素。P<0.05 為差異有統計學意義。
2 結果
2.1 兩組臨床指標的比較
兩組性別、年齡、感染部位、病原學、WBC比較,差異無統計學意義(P>0.05);兩組CRP、PCT、氧合指數、EVLWI、ALB、機械通氣時間、ICU 住院時間、APACHEⅡ評分及SOFA 評分比較,差異有統計學意義(P<0.05),死亡組的氧合指數和ALB 低于存活組,機械通氣時間、ICU 住院時間長于存活組,CRP、PCT、EVLWI、APACHEⅡ評分和SOFA 評分高于存活組。見表1。

表1 兩組臨床指標的比較
2.2 兩組血清Kal、VE-cad水平比較
兩組入住ICU 第1 天、第3 天、第5 天血清Kal、VE-cad 水平比較,采用重復測量設計的方差分析,結果:不同時間點的血清Kal、VE-cad 水平有差異(F=185.920 和308.918,均P=0.000);兩組血清Kal、VE-cad 水平有差異(F=456.521 和535.773,均P=0.000),死亡組血清Kal 水平均低于存活組,死亡組血清VE-cad 水平均高于存活組;兩組血清Kal、VE-cad 水平變化趨勢有差異(F=24.068 和3.965,P=0.000 和0.047)。見表2 和圖1。
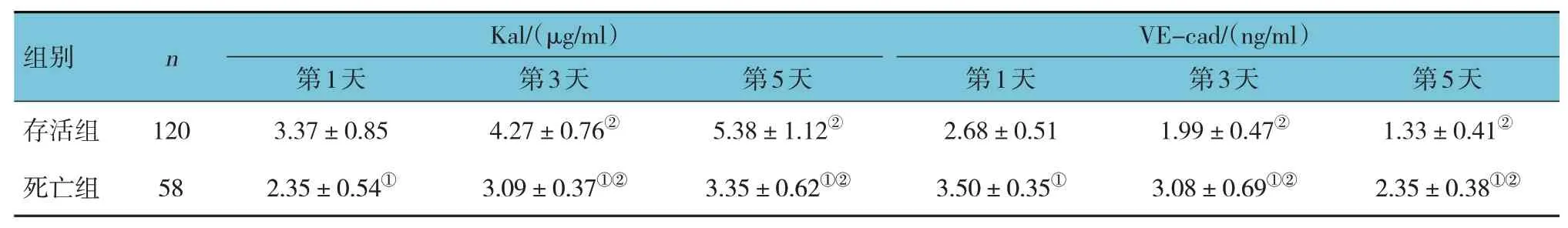
表2 兩組血清Kal、VE-cad水平的比較 (x±s)
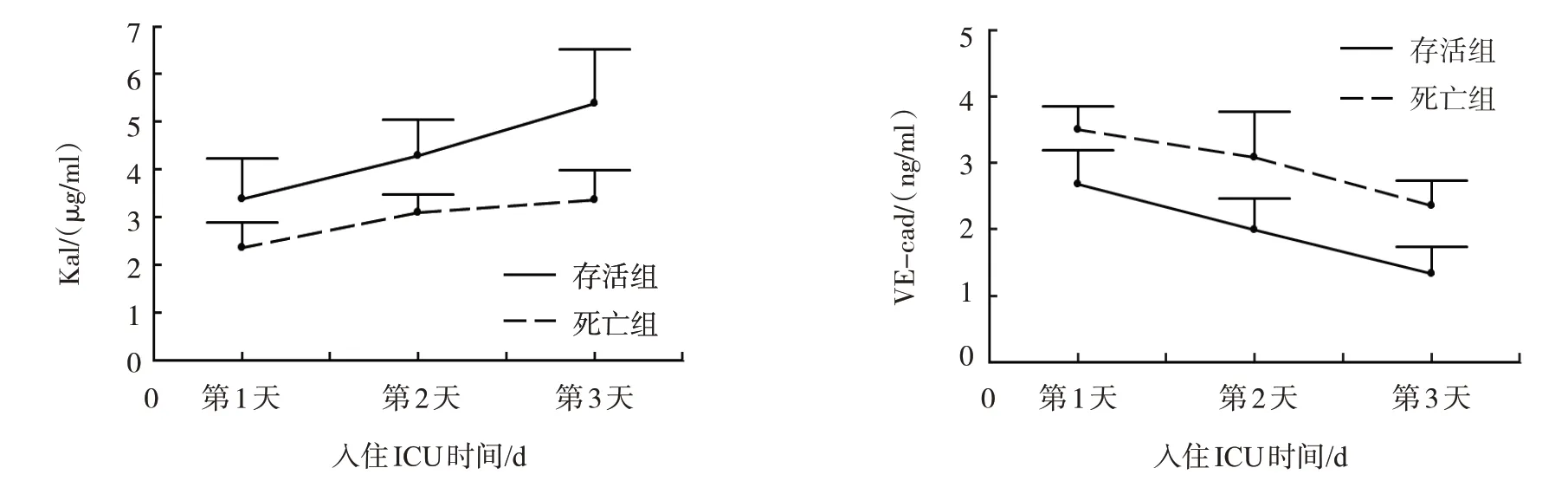
圖1 存活組和死亡組血清Kal、VE-cad水平的不同時間點變化趨勢
2.3 血清Kal、VE-cad與APACHEⅡ評分和SOFA評分的相關性
血清Kal 與APACHE Ⅱ評分和SOFA 評分呈負相關(P<0.05);血清VE-cad 與APACHEⅡ評分和SOFA 評分呈正相關(P<0.05)。見表3。
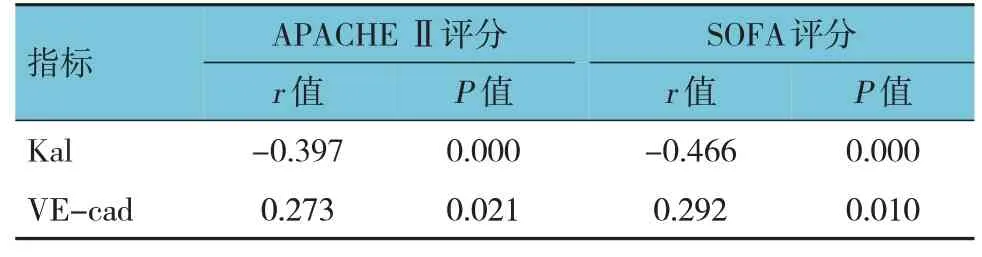
表3 血清Kal、VE-cad與APACHEⅡ評分和SOFA評分的相關性
2.4 入院24 h 內血清Kal、VE-cad 單獨及聯合檢測對膿毒癥休克患者死亡的預測價值
入院24 h 內血清Kal、VE-cad 單獨與兩者聯合檢測的曲線下面積(AUC)分別為0.687(95%CI:0.604,0.770)、0.859(95%CI:0.805,0.912)、0.890(95%CI:0.845,0.936)。血清Kal 檢測預測膿毒癥休克患者死亡的敏感性為81.0%(95%CI:0.772,0.854),特異性為50.0%(95%CI:0.474,0.531);VE-cad 檢測預測膿毒癥休克患者死亡的敏感性為69.0%(95%CI:0.649,0.726),特異性為86.7%(95%CI:0.822,0.914);血清Kal 和VE-cad 聯合檢測預測膿毒癥休克患者死亡的敏感性為82.2%(95%CI:0.781,0.868),特異性為89.6%(95%CI:0.852,0.954)。見表4 和圖2。
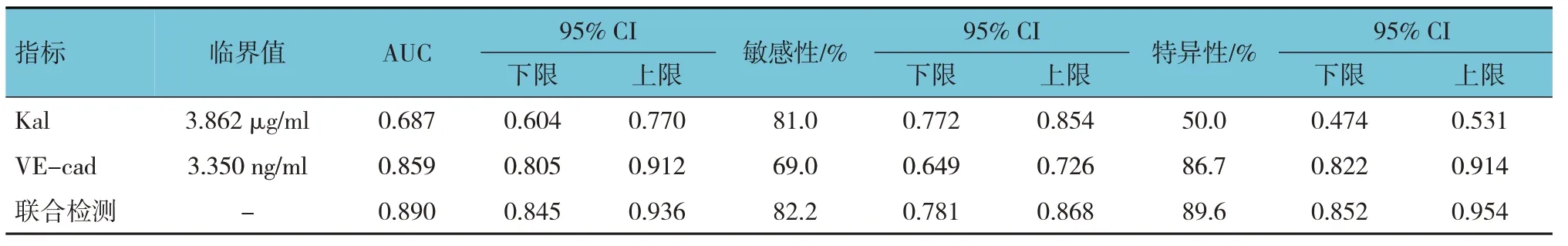
表4 Kal、VE-cad單獨及聯合檢測對膿毒癥休克患者死亡的預測價值

圖2 Kal、VE-cad單獨及聯合檢測判斷膿毒癥休克預后的ROC曲線
2.5 膿毒癥休克患者死亡的影響因素
以膿毒癥休克患者28 d 預后狀況為因變量(1=死亡,0=存活),以表1、2 中有統計學意義的因素為自變量,建立非條件Logistic 回歸模型。初選11 個指標作為自變量,考慮到陽性樣本量較少,將由患者病情嚴重程度引起的4 個關聯指標(機械通氣時間、ICU 住院時間、APACHE Ⅱ評分及SOFA 評分)剔除,實際納入7 個自變量。回歸過程采用逐步后退法,α入=0.05,α出=0.10。結果:CRP[=1.221(95% CI:1.022,1.459)]、PCT[ O^ R=1.195(95% CI:1.035,1.380)]、VE-cad[=1.373(95% CI:1.055,1.787)]、EVLWI[=1.846(95% CI:1.178,2.893)]是膿毒癥休克患者死亡的危險因素,Kal[=0.428(95CI%:0.190,0.966)]是膿毒癥休克患者死亡的保護因素。見表5。
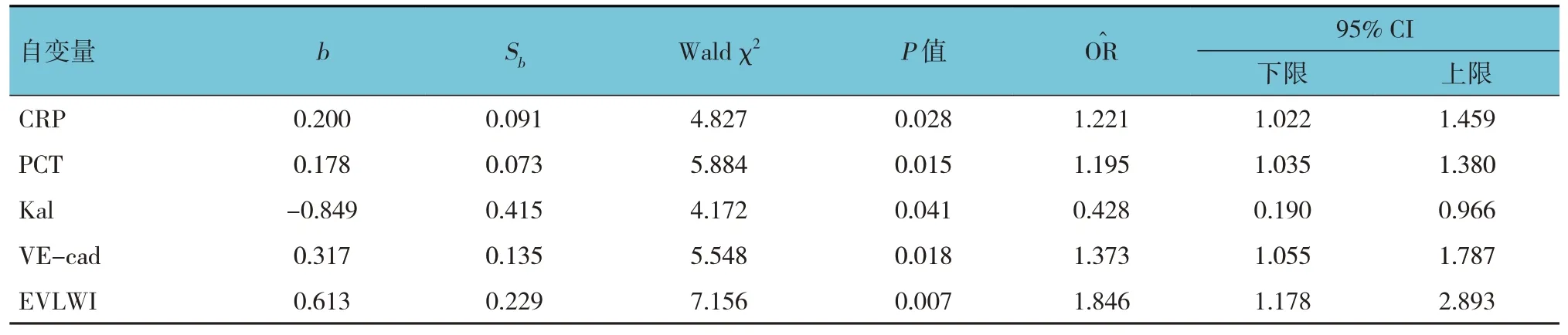
表5 膿毒癥休克死亡的二元Logistic回歸分析參數
3 討論
膿毒癥是一種危及生命器官功能障礙綜合征,是因宿主對感染的反應失調而引起,膿毒癥休克是一種更為嚴重的危及生命的膿毒癥類型,盡管對膿毒癥休克的發病機制和治療的認識不斷進步,但其死亡率仍然很高[10-11]。內皮細胞活化是一種對感染的正常適應性反應,內皮功能障礙是膿毒癥和膿毒癥休克的重要病理生理過程之一,其特征是血管通透性增加、血管舒縮張力改變、細胞黏附、凝血和內皮細胞凋亡得到促進,在膿毒癥的發生發展過程中,內皮細胞功能失調導致血管張力明顯降低,微血管彌散性改變、通透性增加和彌散性血管內凝血[12]。現有臨床研究顯示,許多生物標志物與內皮功能障礙有關[13],并且用于評估血管內皮活性的血清生物標志物與膿毒癥疾病嚴重程度和預后密切相關[14]。
Kal 是一種激肽釋放酶結合蛋白,目前已知其具有多種功能,包括抗炎、抗腫瘤、抗血管生成、抗氧化應激和抗凋亡等作用[15]。研究顯示Kal 作為膿毒癥、社區獲得性肺炎、急性胰腺炎、血管和器官損傷、主動脈瘤等疾病的新型血清分子標志物具有廣闊前景[16-17]。Kal 對膿毒癥休克患者器官保護的可能機制如下:誘導內皮型一氧化氮合酶的合成,抑制促炎因子如高遷移率族蛋白B1(HMGB1)、Toll樣受體4(TLR4)、血管黏附因子-1 和細胞內黏附分子-1 的表達,抑制核因子-κB(NF-κB)激活,抑制Caspase-3 活性和凋亡[18]。血管內皮生長因子(VEGF)、堿性成纖維細胞生長因子(bEGF)是血管新生的重要分子,Kal 可與VEGF、bEGF 競爭性結合其內皮細胞表面的乙酰肝素蛋白聚糖(HSPG)受體從而阻斷血管生成信號通路[19]。LIN 等[20]研究顯示血清Kal 水平在膿毒癥休克合并社區獲得性肺炎患者表達較低。LI 等[17]體內研究顯示,外源性Kal明顯減輕膿毒癥造模大鼠的炎癥反應、器官損傷,并且可有效降低模型大鼠的病死率。王宏斌等[21]研究顯示膿毒癥休克患者死亡組血清Kal 水平低于存活組,Kal 水平與膿毒癥休克、APACHEⅡ評分、SOFA 評分及CRP 水平呈負相關。本研究結果顯示,死亡組血清Kal 水平低于存活組,且膿毒癥休克患者血清Kal 水平與APACHEⅡ評分和SOFA 評分呈負相關;ROC 曲線分析顯示,當血清Kal 水平到達臨界值3.862 μg/ml 時,其預測膿毒癥休克患者死亡的敏感性為81.0%,特異性為50.0%,表明血清Kal 預測膿毒癥休克患者死亡的敏感性較高,但特異性較差。本研究進一步采用Logistic 回歸分析結果顯示Kal 水平高是影響膿毒癥休克患者死亡的保護因素。王宏斌等[21]研究顯示Kal 水平低是膿毒癥休克和嚴重膿毒癥患者預后的危險因素。LIN 等[20]研究顯示,膿毒癥休克合并社區獲得性肺炎患者第1 天Kal 水平越高,死亡的風險越低,因此他們認為Kal 水平可以作為膿毒癥休克合并社區獲得性肺炎患者病情嚴重程度的預測標志物,這可能與Kal 本身具有抗炎和抗凝作用有關,當然Kal 能否作為診斷標志物仍需大量臨床研究進一步證實。
VE-cad 在維持血管內皮屏障完整性方面發揮著重要作用,在膿毒癥的發生發展過程中,其水平不斷升高[22-23]。本研究顯示,死亡組血清VE-cad 水平較存活組高,并且持續保持較高水平,而存活組血清VE-cad 水平逐漸降至正常水平,表明血管內皮屏障遭到破壞,并且膿毒癥休克組血清VE-cad 水平與APACHEⅡ評分和SOFA 評分呈正相關,ROC 曲線分析顯示,當血清VE-cad 水平到達臨界值3.350 ng/ml時,其預測膿毒癥休克患者死亡的敏感性為69.0%,特異性為86.7%,表明血清VE-cad 預測膿毒癥休克患者死亡的特異性較高,但敏感性較差。但兩者聯合檢測時其敏感性和特異性分別為82.2%和89.6%,說明聯合檢測對評估膿毒癥休克患者的預后具有較高的預測價值,因此兩者的聯合檢測可能作為臨床評估膿毒癥休克患者預后的重要手段。
本研究亦發現,死亡組ALB 水平、氧合指數均低于存活組,而機械通氣時間、ICU 住院天數長于存活組,EVLWI 水平高于存活組,并且VE-cad、EVLWI 是影響膿毒癥休克患者死亡的危險因素。其可能機制如下:在炎癥和氧化應激刺激下,VE-cad與連環蛋白連接遭到破壞,血管內皮屏障遭到破壞,血液中的白蛋白滲漏到組織間隙,導致ALB 水平下降,而ALB 水平降低可致肺水腫,進而影響肺換氣彌散功能,導致氧合指數降低,EVLWI 升高,死亡組血清VE-cad 升高,表明嚴重的血管屏障受損使液體正平衡被促發,而液體正平衡是影響該疾病患者死亡的獨立危險因素[24-25]。液體正平衡可使心臟前負荷增加,影響VE-cad 與血管內皮細胞之間的緊密連接,使細胞連接張力下降,導致血管內皮細胞間形成出現縫隙[26]。由于VE-cad 在維持內皮屏障完整性中的重要意義,目前已有研究認為VE-cad可能作為血管內皮屏障修復的靶標[27]。
綜上所述,CRP、PCT、Kal、VE-cad、EVLWI均是膿毒癥休克患者死亡的影響因素,研究膿毒癥休克患者血清中Kal、VE-Cad 水平變化有助于評估疾病預后,并且兩者作為新型血清分子標志物具有廣闊的應用前景。

