冠狀動脈粥樣硬化性心臟病患者心外膜脂肪組織和皮下脂肪組織之間差異表達基因的生物信息學分析▲
連 溯 劉雪玲 莫秋艷 王金花 王慶高 傅葉葉 蘇虹月
(廣西中醫藥大學第一附屬醫院超聲科,南寧市 530023,電子郵箱:271857173@qq.com)
冠狀動脈粥樣硬化性心臟病(coronary atherosclerotic heart disease,CAD)是全球最常見的心臟病之一,以進行性冠狀動脈粥樣硬化閉塞為特征,患者心肌供需不匹配,嚴重時可出現心肌梗死、心力衰竭,甚至死亡[1]。脂肪由脂肪源性干細胞、前脂肪細胞、內皮細胞和白細胞組成,可分泌上百種生物活性成分,包括瘦素、脂聯素、脂肪酶、補體或細胞因子(例如腫瘤壞死因子、趨化因子等)[2-3]。根據旁分泌特征不同可將脂肪分為皮下脂肪和內臟脂肪兩類。心外膜脂肪組織(epicardial adipose tissue,EAT)是內臟脂肪的一種,位于心肌和心包臟層之間,與心肌直接接觸,由冠狀動脈分支供血,并圍繞冠狀動脈下行至心尖,參與小血管和微血管管壁的構成。EAT與心肌或冠狀動脈壁可通過細胞、代謝物或信號分子直接進行串擾[4]。EAT可以防止高水平的循環游離脂肪酸對心肌和冠狀動脈產生毒性作用,也可以促進心肌和冠狀血管的局部炎癥反應[5]。相較于被心肌包圍的節段(中部分支和心肌橋下),冠狀動脈粥樣硬化更可能發生在被 EAT 包圍的節段中[6]。有學者發現,實驗性去除血管周圍的EAT,可阻止豬冠狀動脈粥樣硬化的進一步發展[7]。還有研究顯示,EAT炎癥與冠狀動脈痙攣之間存在明顯的關聯,提示冠狀動脈與EAT之間具有潛在的相互作用[8]。但目前關于EAT參與CAD的機制尚未完全明確。本研究基于兩個獨立的微陣列數據庫對EAT和皮下脂肪組織的差異表達基因進行分析,探討EAT參與CAD發展的分子機制,為尋找新的CAD生物標志物及制定新的治療策略提供參考。
1 材料與方法
1.1 數據來源 通過GEO數據庫(https://www.ncbi.nlm.nih.gov/geo/),查找并篩選出已接受冠狀動脈旁路移植術的CAD患者,同時具有EAT和皮下脂肪組織的轉錄組測序數據及表達矩陣的2個數據集:GSE24425和GSE64554。GSE24425使用Illumina Human WG-6 V3.0芯片,包含6個成對的EAT和皮下脂肪組織樣本。GSE64554使用Illumina Human HT-12 V3.0芯片,包含13個成對的EAT和皮下脂肪組織樣本。需要使用R語言軟件(http://www.r-project.org/)對數據進行歸一化的線性處理,以確保數據集的完整性和可比性。
1.2 差異表達基因的篩選 應用R語言環境的“edgeR”包對數據集GSE24425、GSE64554中CAD患者EAT與皮下脂肪組織之間的差異表達基因進行篩選。差異表達基因需同時滿足以下條件:(1)∣log2倍數變化∣>2;(2)P<0.05。
1.3 差異表達基因的生物信息學分析 采用Metascape在線數據庫(https://metascape.org)對差異表達基因進行基因本體論(Gene Ontology,GO)分析和京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。最小富集度設定為1.5,P<0.05,最小計數為3。
1.4 差異表達基因的相互作用分析 將差異表達基因導入在線數據庫Metascape,數據庫內置STRING6(http://www.stringdb.org/)、BioGrid7(http://thebiogrid.org/)、OmniPath8(http://omnipathdb.org/)和InWeb/u IM9(http://www.inweb.org.br/),構建CAD患者心包脂肪差異表達基因蛋白-蛋白相互作用(protein-protein interaction,PPI)網絡,設定條件為STRING的物理相互作用評分>0.187。結果網絡中差異表達基因兩兩之間的聯系節點≥1。運用Cytoscape 3.1.2軟件進行可視化分析,使用軟件中的插入式分子復合物檢測(MCODE插件,使用默認參數,最小網絡節點設置為3)篩選出PPI網絡中的樞紐模塊和關鍵基因,然后對關鍵基因進行GO分析。
1.5 與關鍵基因相關的微小RNA的預測 利用在線預測工具微小RNA(microRNA,miRNA)數據集成門戶網站mirDIP(http://ophid.utoronto.ca/)對潛在的miRNA進行靶向預測。提交篩選出的關鍵基因,選擇每種基因的前3個預測miRNA,同時,采用miRBase數據庫(http://www.mirbase.org)驗證關鍵模塊基因與預測miRNA的相關性。
2 結 果
2.1 差異表達基因的篩選結果 對數據集GSE24425、GSE64554進行篩選,共得到179個差異表達基因,其中,下調基因92個,上調基因87個。取兩個數據集的交集后,得到76個差異表達基因,其中上調基因41個,下調基因35個。見圖1、圖2。
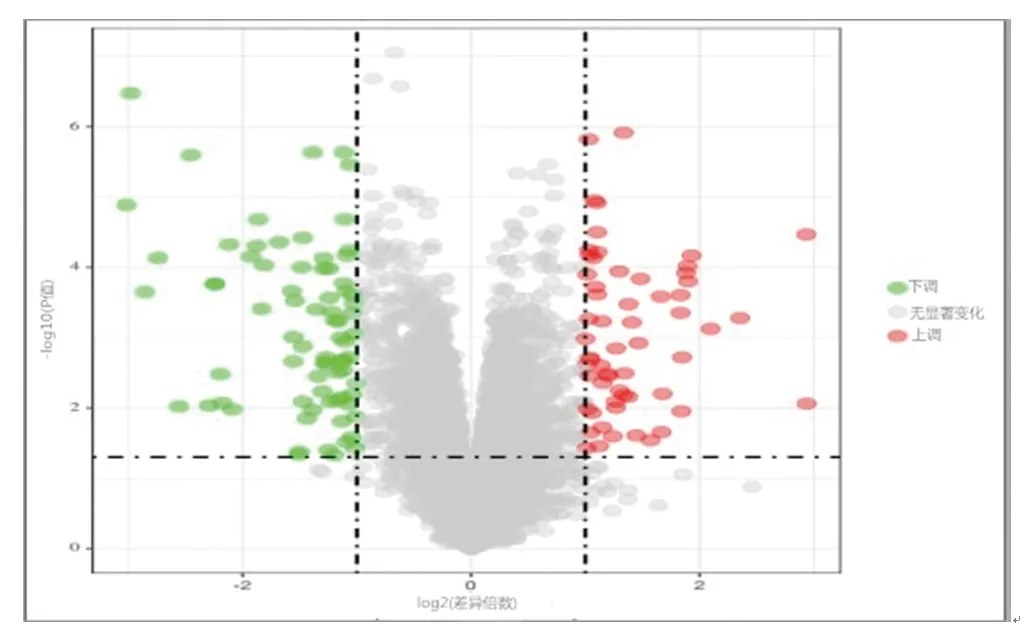
圖1 差異表達基因的分布火山圖

圖2 數據集GSE24425、GSE64554的交集基因
2.2 差異表達基因的GO富集分析 41個上調基因主要與嗜酸性粒細胞(eosinophil,EOS)趨化性、細胞對脂質的反應、后腦發育、細胞外基質等生物學過程有關;而35個下調基因主要與胚胎骨骼系統發育、細胞外基質、上皮管形態發生、上皮細胞分化等生物學過程有關,見表1。
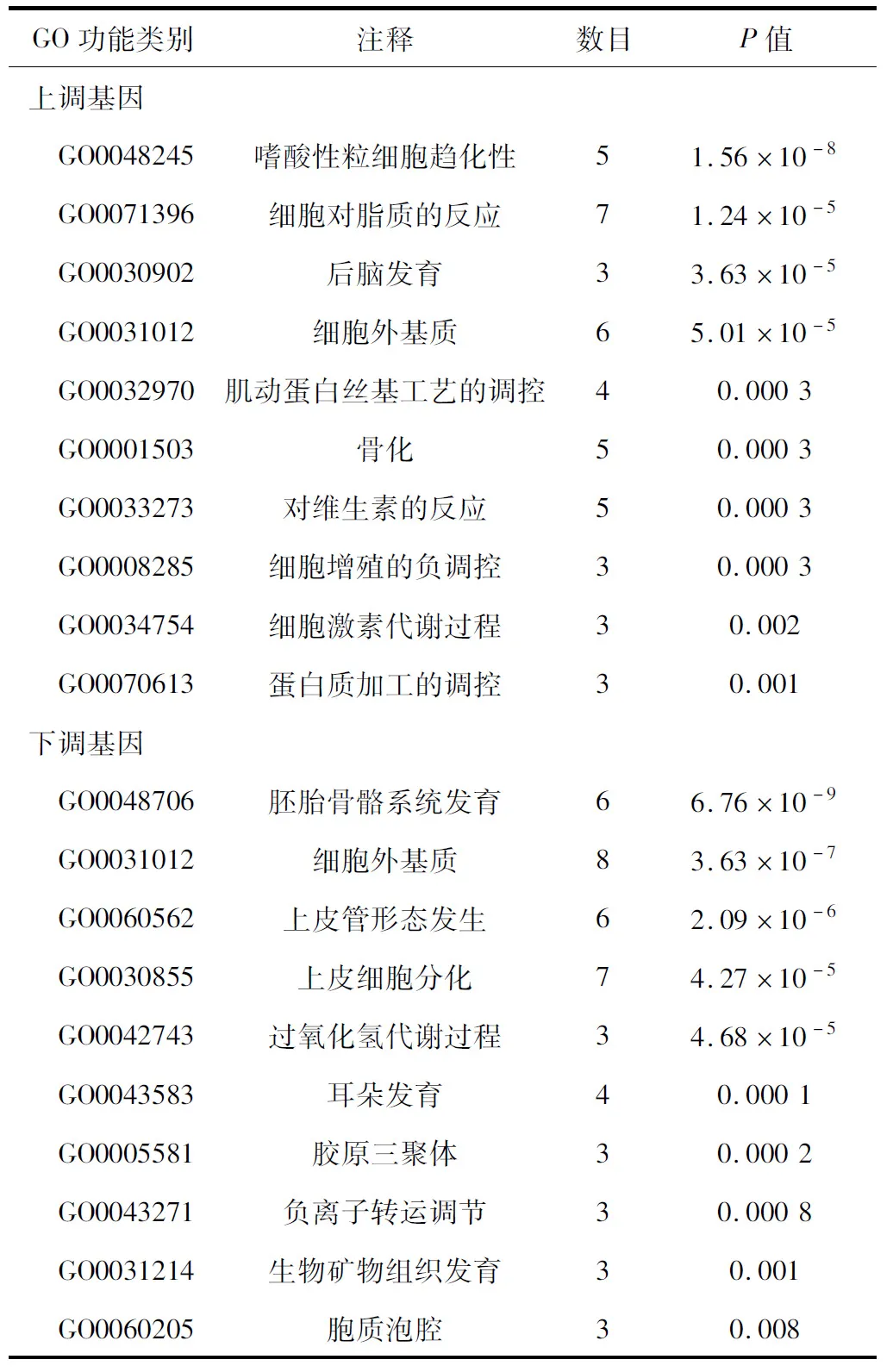
表1 差異表達基因的GO富集過程圖
2.3 差異表達基因KEGG富集分析 76個差異表達基因主要參與細胞因子-細胞因子受體相互作用、朊病毒病、精氨酸和脯氨酸代謝信號通路,見表2。

表2 差異表達基因的通路注釋結果
2.4 差異表達基因PPI網絡的構建與分析 采用Metascape在線工具內置的STRING構建PPI網絡,采用Cytoscape 3.1.2軟件進行可視化分析,結果如圖3、圖4所示。采用MCODE插件分析獲得的最顯著的相互作用模塊,結果共得出10個關鍵基因,其中,上調基因中的關鍵基因有CC基序趨化因子配體(C-C motif chemokine ligand,CCL)2、CCL5、CCL8、CCL21、早期生長反應蛋白2(early growth response 2,EGR2)和白細胞介素7受體(interleukin 7 receptor,IL-7R),見圖5;下調基因中的關鍵模塊基因有同源異型盒(homeobox,HOX)A5、HOXB5、HOXB7、HOXC8,見圖6。關鍵上調基因與EOS趨化性、EOS遷移和趨化因子受體結合生物學過程相關;關鍵下調基因與胚胎骨骼系統形態發生、胚胎骨骼系統發育和前/后模式規范生物學過程相關,見表3。
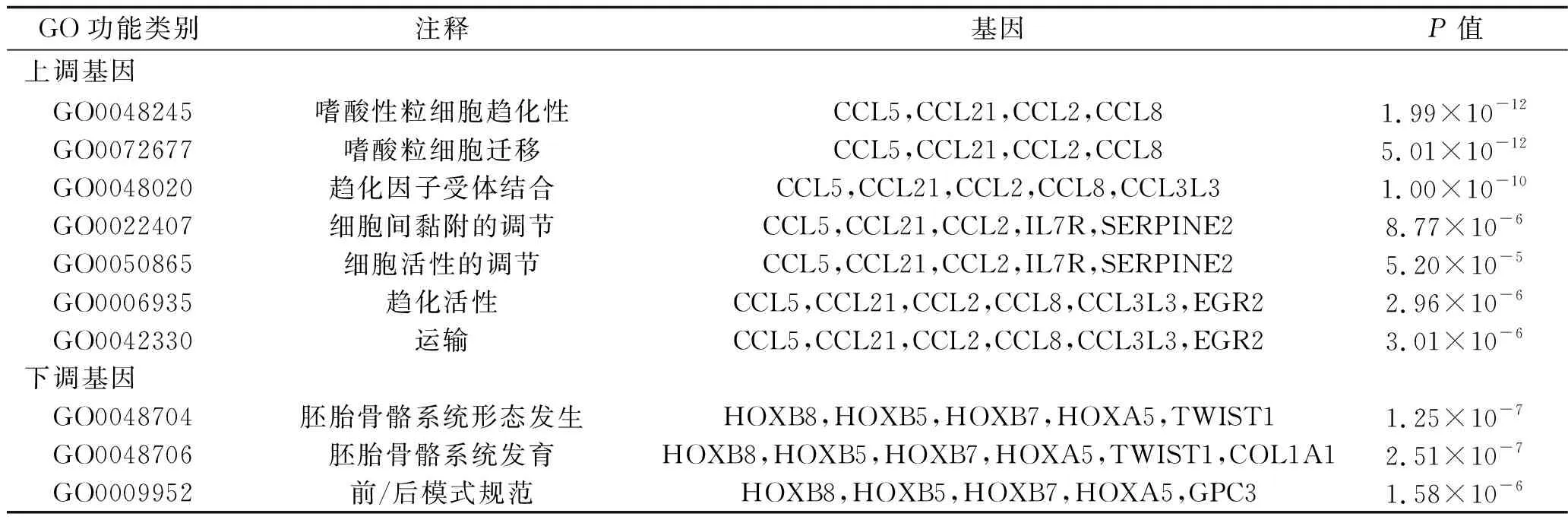
表3 關鍵基因GO富集

圖3 上調基因PPI網絡圖 圖4 下調基因PPI網絡圖

圖5 上調基因關鍵模塊圖 圖6 下調基因關鍵模塊圖
2.5 miRNA預測結果 hsa-miRNA-196a-5p和hsa-miRNA-196b-5p均與HOXA5、HOXB7、HOXC8高度相關。見表4。

表4 關鍵基因的前3個預測miRNA
3 討 論
本研究通過生物信息學分析方法,從GSE24425、GSE64554芯片中篩選出CAD患者的心包脂肪組織和皮下脂肪組織之間的差異表達基因共179個,取兩個數據集的交集后,獲得上調基因41個,下調基因35個。通過構建PPI網絡,獲得2個關鍵模塊共10個關鍵基因:CCL2、CCL5、CCL8、CCL21、EGR2、IL-7R、HOXA5、HOXB5、HOXB7、HOXC8。通過預測與關鍵基因相關的miRNA,發現hsa-miR-196a-5p和hsa-miR-196b-5p均與HOXA5、HOXB7、HOXC8高度相關。
CAD的發生是多因素共同作用的復雜過程,包括動脈粥樣硬化、血栓形成、冠狀動脈痙攣等,其最重要的病理基礎為動脈粥樣硬化。動脈粥樣硬化以動脈壁內的慢性炎癥性反應為特征,表現為脂質、細胞外基質和細胞的聚集并浸潤血管壁。趨化因子是相對分子量介于8 000~12 000之間的蛋白質,介導細胞運動(趨化性)、白細胞脫粒和血管生成[9]。趨化因子序列高度保守,具有相似的結構,一般由N端Loop區、3個反向平行的β折疊和1個碳端α螺旋組成[10]。根據N端半胱氨酸殘基的數量和位置,將其分為4個趨化因子亞家族:C、CC、CXC和CX3C。CCL2、CCL5、CCL8和CCL21均屬于趨化因子CC亞家族。一種趨化因子可以結合多種趨化因子受體,反之亦然,它們相互作用構成了復雜的趨化因子調控網絡,趨化因子及其受體協調免疫細胞的活化、募集和浸潤,以及隨后的炎癥表型變化。因此,在CAD發生和發展的各個階段中,趨化因子及其受體是以網絡形式而不是單個細胞因子形式起作用。本研究中,GO富集結果顯示,上調基因CCL2、CCL5、CCL8和CCL21大量存在于細胞外基質中,這或可增強嗜酸性粒細胞趨化性,介導嗜酸性粒細胞的遷移,并通過趨化因子-趨化因子受體結合作用參與CAD。
CCL2可與CC趨化因子受體(C-C motif chemokine receptor,CCR)1結合,與慢性促炎狀態相關[11-12]。CCL2還可刺激內皮細胞與CCR的相互作用[13],并在動脈粥樣硬化斑塊中大量表達[14]。有學者發現,動脈粥樣硬化患者的血清CCL2水平與冠狀動脈鈣化有關[15];與CCL2低水平表達的患者相比,血清CCL2高水平表達的CAD患者的冠狀動脈斑塊更不穩定,因此CCL2水平是預測高危冠狀動脈斑塊的血清學指標[16]。最近有研究顯示, CCL2 被以晝夜節律方式振蕩的髓樣細胞有節奏地釋放到動脈內皮中[17],基于該研究結果提出的 “慢性藥理學治療策略”,針對動脈粥樣硬化性髓樣細胞作用的峰值,強調將復雜的手術安排在CCL2釋放量較少的時間進行。
CCL5能結合CCR1、CCR3和CCR5等多種受體[18]。研究顯示,血小板衍生的CCL5沉積在活化的內皮細胞上可引起單核細胞停滯,從而在動脈粥樣硬化病變的發展中具有關鍵作用[19];其還可促進單核細胞在內皮上停滯以及免疫細胞浸潤到病變中,從而促進動脈粥樣硬化的形成[20-21]。CCL5水平升高與較大的動脈粥樣硬化病變有關[22-23]。盡管CCL5在動脈粥樣硬化斑塊的形成和失穩過程中具有重要作用,但其在CAD發生、發展中的作用仍存在爭議。例如,在Versteylen等[22]的研究結果顯示,與狹窄程度小于50%的患者相比,阻塞性CAD患者的CCL5顯著升高。Kong等[23]的研究卻表明,動脈粥樣硬化病變進展較輕的CAD患者的CCL5濃度更高。
CCL8主要來源于巨噬細胞,主要與CCR1、CCR2、CCR3、CCR5和CCR8結合發揮作用[24]。目前關于CCL8在心臟疾病中的作用研究較少。Dai等[25]的體外細胞實驗表明,經血小板衍生生長因子-BB刺激后人主動脈平滑肌細胞(human aortic smooth muscle cell,HASMC)中CCL8的表達上調,表達上調的CCL8又可促進血小板衍生生長因子-BB增殖和遷移,并通過調節HASMC中關鍵分子的表達來加速細胞周期和表型的轉換,將正常靜止狀態下的收縮表型轉變成為具有強大增殖和遷移能力的促炎表型,而沉默CCL8具有相反的作用,這表明CCL8可能是動脈粥樣硬化的治療靶標。
CCL21和CCL19共享相同的受體CCR7,與正常人相比,頸動脈粥樣硬化患者血漿中的CCL19和CCL21水平上調[26]。體外實驗表明,CCL21具有促進巨噬細胞脂質蓄積的作用,或可直接促進動脈粥樣硬化的發展[27]。急性心肌梗死動物模型的循環CCL21水平和心臟CCR7的水平升高,通過靜脈注射抗CCL21單克隆抗體中和CCL21可減少急性心肌梗死后的梗死面積,降低急性心肌梗死后血清中性粒細胞和單核細胞化學引誘劑的水平,抑制梗死心肌中中性粒細胞和巨噬細胞的募集,且抗CCL21治療也可緩解心臟擴大并改善左心室功能,由此推測CCL21參與了急性心肌梗死后的心臟重塑[28]。
針對CAD中趨化因子及其受體作用機制的研究絕大多數定位于巨噬細胞、中性粒細胞和淋巴細胞介導的經典炎癥途徑,而探討EOS介導的過敏性炎癥途徑的研究較少。既往研究表明EOS可能具有促炎和促凝血的功能[29],其能夠產生活性氧,誘導內皮損傷和血小板活化,從而促進血栓形成,并增強冠狀動脈血管收縮[30]。血清EOS濃度升高可能與心壁血栓和栓塞事件有關[31],是冠狀動脈疾病患者危險分層的新生物標志物[32]。此外,嗜酸性粒細胞陽離子蛋白(eosinophil cationic protein,ECP)是EOS的活化標志物,較高的血清ECP水平與置入藥物洗脫支架和裸金屬支架患者的不良預后有關[33]。而有研究顯示,藥物洗脫支架的EOS浸潤濃度比裸金屬支架更高,且藥物洗脫支架植入后6周的EOS總數是支架內再狹窄發生的唯一預測因子,這表明經皮冠狀動脈介入術治療后患者對藥物洗脫支架的免疫敏感性反應與支架內再狹窄的發生存在關聯[34]。因此,EOS介導的過敏性炎癥途徑在CAD發生、發展中的作用值得進一步探討。結合本研究結果,CAD患者EAT中的CCL2、CCL5、CCL8和CCL21表達上調,其通過與CCR結合增強細胞對脂質的反應,并可能通過促進免疫細胞激活和聚集,參與粥樣硬化斑塊的形成;同時,這些因子可增強嗜酸性粒細胞的遷移和趨化,通過過敏性炎癥途徑,增強冠狀動脈收縮,促進血栓生成,參與CAD的發展并影響治療后的轉歸。
白細胞介素7受體(interleukin 7 receptor,IL-7R)的生物學效應主要通過與白細胞介素7(interleukin 7,IL-7)相結合來完成。IL-7/IL-7R 對骨髓、胸腺的中樞性T淋巴細胞、B淋巴細胞的發育和成熟具有重要作用,并可上調抗凋亡蛋白,下調促凋亡蛋白,抑制已分化和激活的T淋巴細胞凋亡[35]。結合本研究關鍵基因的富集分析結果,IL-7R與細胞間黏附的調節和細胞活性的調節相關,因此,IL-7R可能通過調節淋巴細胞的黏附和免疫活性來參與CAD的發生、發展。EGR2是EGR家族中的一員,目前,人們對于EGR家族的認識主要集中在調控神經功能可塑性方面。EGR2可反式調控細胞的增殖、分化、凋亡及轉移等生物學行為[36],在周圍神經髓鞘形成、T淋巴細胞成熟、后腦分割和脂質生物合成中起重要作用[37]。本研究的關鍵基因富集結果提示EGR2具有運輸和趨化作用,因此我們認為,EGR2可能是趨化因子的活性調節和定向黏附基因。盡管關于IL-7及其受體信號途徑在病毒感染、骨髓移植、免疫重建中作用的研究,以及EGR2在大腦神經發育等領域中的研究均較多,但兩者在心臟領域中的研究幾乎均為空白,今后需開展相關研究探討兩者在心臟領域中的作用。
HOX由180個核苷酸構成,其堿基順序和在染色體中的位置高度保守,通過其同源域識別并結合特異的DNA序列[38-39]。HOX基因在不同的染色體上成簇排列又稱HOX基因簇。哺乳動物共有39個HOX基因,按結構劃分為4簇,即HOXA、HOXB、HOXC、HOXD;根據序列同源性及其在簇中的相對位置,HOX又分為13個旁系同源基因組,它們在蛋白質結構和表達模式上具有相似性[40]。 HOX基因編碼的轉錄因子可以調節目標基因的表達,以及早期胚胎發育過程中脂肪組織和心血管系統等多種結構和器官的形成和發育;出生后HOX基因仍持續表達,參與維持血管壁的完整性、體內平衡和破壞后的血管重塑。研究表明,在正常人群中,與皮下脂肪相比,內臟脂肪中HOXA5高表達[41]。有學者發現在高脂飲食誘導的肥胖小鼠脂肪組織中HOXA5的表達降低[42]。還有類似的研究表明,高脂飲食小鼠脂肪組織中的HOXA5基因高度甲基化,使HOXA5 mRNA和蛋白表達下調,而恢復標準飲食兩個月后,小鼠體重減輕,HOXA5甲基化和mRNA水平幾乎完全恢復正常[43]。本研究中,HOXA5在CAD患者EAT中呈低表達,與肥胖狀態下內臟脂肪組織的HOXA5的表達類似[44]。肥胖是公認的CAD的危險因素之一,因此,我們認為CAD患者保持健康的生活方式并關注其肥胖程度,可能有助于HOXA5表達恢復正常水平,但這需要進一步研究。同時,HOX基因參與維持血管壁的完整性、體內平衡,以及破壞后的血管重塑,在血管床的不同部位其表達有所不同。HOX基因可通過表觀遺傳機制調節血管壁干細胞向血管平滑肌細胞分化,而血管壁干細胞的失調在動脈粥樣硬化和新內膜斑塊形成中起重要作用[45-46]。這可能是某些部位更容易發生粥樣硬化的原因之一。
此外,較高的生理性剪切應力具有保護性,在動脈的分支和彎曲處,容易出現血流紊亂的血流模式進而產生低剪切應力。研究表明,在血流紊亂的情況下,HOXA5的啟動子在小鼠主動脈中高度甲基化(即轉錄被抑制),這種HOXA5過度甲基化可激活血管內皮細胞炎癥表型從而導致炎癥增加[47]。Jiang等[48]的研究結果也顯示,HOXA5在豬主動脈的紊流區域中被甲基化。有學者指出,HOX基因在主動脈中的表達模式是由胚胎模式中建立的“HOX代碼”決定,具有指定位置同一性的保守特點,“HOX代碼”失調時,會促進動脈粥樣硬化的發展[49]。本研究中,除HOXA5基因外,HOXB5、HOXB7和HOXC8這3個關鍵基因在CAD的EAT中表達下調。既往研究中,上述基因被證實是預測癌癥預后的生物標志物和治療靶標,包括胰腺癌[50]、皮膚鱗狀細胞癌[51]、卵巢癌[52]等,但其在CAD中的作用卻少有研究。然而,由于 HOX 在調節Wnt信號通路、抑制轉化生長因子、絲裂原活化蛋白激酶、磷脂酰肌醇3-激酶/蛋白激酶B、核因子κB、Notch、缺氧誘導因子1、扭體家族bHLH轉錄因子1等多種信號通路中具有重要功能[46]。因此,我們認為HOX基因的下調可以抑制保護性脂肪細胞因子的轉錄、促發成年人動脈振蕩血流區域的動脈粥樣硬化,進而在CAD的病理生理過程中發揮重要作用。
本研究采用在線工具預測與關鍵模塊基因相關的miRNA,在這些 miRNA 中,hsa-miRNA-196a-5p和hsa-miRNA-196b-5p與下調關鍵基因HOXA5、HOXB7和HOXC8均高度相關。目前有研究表明,hsa-miRNA-196a/b可直接或間接調控人臀部脂肪組織中HOX基因的表達,HOXA5在hsa-miRNA-196a的調節下抑制胃癌的腫瘤生長[53],hsa-miRNA-196a通過靶向促進骨肉瘤中HOXA5 mRNA的3′-非翻譯區來促進細胞遷移、侵襲和上皮-間質轉化[54]。但是,這兩個 miRNA 在 CAD中的作用如何,仍需進行更多的探索。
綜上所述,CCL2、CCL5、CCL8、CCL21、EGR2、IL-7R、HOXA5、HOXB5、HOXB7和HOXC8在CAD患者EAT中表達失調,EAT可能通過HOX基因、hsa-miRNA-196/HOX信號通路及CCL促炎基因,以旁分泌的方式,通過趨化免疫細胞聚集,抑制保護性脂肪細胞因子轉錄、改變冠狀動脈動脈血管表型參與到CAD的病理機制中。

