大承氣湯抑制高遷移率族蛋白1- Toll樣受體4信號通路減輕炎癥反應改善重癥胰腺炎大鼠腎損傷
王 艻,王 佳
(1.華中科技大學同濟醫學院附屬同濟醫院腎內科,湖北 武漢 443000;2.四川省醫學科學院·四川省人民醫院全科,四川 成都 610072)
重癥急性胰腺炎(SAP)是臨床常見的急腹癥,占急性胰腺炎的10%~20%。具有發病快、進展快、并發癥多、預后差的特點[1]。此外,早期還可引起全身炎癥反應綜合征(SIRS)和多器官功能障礙綜合征(MODS),死亡率為10%~30%[1]。Devani 等[2]研究顯示SAP并發腎臟損傷時死亡率高達14.5%。相關研究證實炎癥反應與SAP誘發的腎損傷發生發展密切相關[3],而大承氣湯可通過抑制炎癥反應減輕SAP[4]。本研究擬探討大承氣湯對重癥急性胰腺炎大鼠腎損傷的保護作用及作用機制。
1 材料與方法
1.1 實驗動物2018年1月至2020年12月在四川省人民醫院開展本研究。SPF級雄性SD大鼠60只,體重為(210±20) g,購買于武漢大學實驗動物中心,動物許可證號:SCXL (鄂) 2013-012。
1.2 實驗試劑血清淀粉酶(amylase,AMS)、脂肪酶(LIS)、肌酐(Cr),高遷移率族蛋白1(HMGB1)和尿素氮(BUN)活性以及白介素-6(IL-6),單核細胞趨化蛋白-1(MCP-1)和腫瘤壞死因子-α(TNF-α)試劑盒均買于南京建成生物研究所。牛磺膽酸鈉(Sigma,USA),大承氣湯(厚樸 24 g,大黃 12 g,芒硝 6 g,枳實 12 g)購自于上海雷允公司,利用水提醇沉法制作大承氣湯凍干粉),濃縮至生藥量為(1.2 g/ml)。重組HMGB1(r-HMGB1)購買于Sigma 公司,Acetyl-HMGB1,HMGB1,TLR-4,Myd88,p-p65 和p65 一抗均購買于美國Abgent 公司。HE染色試劑由四川省人民醫院病理實驗室提供。水合氯醛(武漢谷歌),實時熒光定量PCR相關試劑盒購自TOYOBO 公司。
1.3 實驗分組和模型構建60只SD大鼠采用隨機數字表法分為假手術組(Sham)、重癥急性胰腺炎組(SAP)、大承氣湯治療組(DCQD)和r-HMGB1組各15只。SAP組,DCQD組和r-HMGB1組通過十二指腸壁經胰膽管逆行注射牛磺膽酸鈉構建重癥急性胰腺炎模型[4],Sham組操作同上,但不注射牛磺膽酸鈉。DCQD組在術前2 h灌胃給藥(12 g/kg),r-HMGB1組在術前2 h灌胃給藥(12 g/kg)和r-HMGB1,SAP和Sham組術后1 h腹腔注射相同生理鹽水[4,5]。術后12 h通過水合氯醛麻醉處死大鼠,收集血清和腎臟。部分腎組織經甲醛固定,脫水,包埋成蠟塊
1.4 生化指標測定利用酶聯免疫吸附(ELISA)檢測血清和腎組織勻漿中AMS、LIS、Cr,HMGB1和BUN的活性以及IL-6、MCP-1 和TNF-α表達水平,具體步驟參考試劑說明書。
1.5 腎臟病理形態檢測取腎臟蠟塊4 μm切片,脫蠟,透明,后行PAS染色,在顯微鏡下評估形態,損傷評分標準參考文獻[8]。
1.6 腎組織IL-6、MCP-1 和TNF-α mRNA表達測定應用(PE Biosystems)軟件設計引物序列,嚴格參照說明書提取腎組織總RNA,利用逆轉錄生成 cDNA,然后以 cDNA 做、作為模板進行Q-PCR。以20 μl 作為反應體系,SYBGreen qPCRMix為 10 μl,下游引物(10 μmol/L)為0.4 μl,上游引物(10 μmol/L)為0.4 μl,模板為5 μl,ROX reference dye為0.4 μl 并加入3.8 μl滅菌蒸餾水。擴增條件:預熱 50 ℃ (2 min),預變性 95 ℃ (10 min),變性 95 ℃ (15 s),退火 60 ℃ (30 s),延伸 72 ℃ (30 s),總共 35 個循環;并以2-△△Ct 值代表目標基因IL-6、MCP-1 和TNF-α mRNA。
1.7 Western blotting檢測Acetyl-HMGB1,HMGB1,TLR-4,MyD88,p-NF-κB和 NF-κ B表達將腎組織在磷酸酶抑制劑和RIPA作用下冰上勻漿,提取腎組織總蛋白,利用BCA法檢測蛋白濃度,經上樣,電泳,轉膜,封閉,洗滌,加入一抗Acetyl-HMGB1 (1∶500)、HMGB1 (1∶1000)、TLR-4(1∶400)、Myd88(1∶400)、p-NF-κBp65(1∶500)、p65(1∶1000)和β-actin(1∶3000),4 ℃孵育過夜,洗滌,二抗IgG(1∶400),37 ℃孵育1 h。洗滌,顯影顯色,利用Image G進行圖像分析檢測蛋白表達量(β-actin為內參條帶)。
1.8 統計學方法采用SPSS12.0統計學軟件分析數據。計量資料以均數±標準差表示,采用單因素方差分析,兩兩比較采用t檢驗。P< 0.05為差異有統計意義
2 結果
2.1 各組大鼠血清AMS、LIS、Cr和BUN含量的比較與Sham組比較,SAP組血清AMS、LIS、Cr和BUN含量增高;與SAP組比較,DCQD組血清AMS、LIS、Cr和BUN含量降低(P<0.05);與DCQD組比較,r-HMGB1組血清AMS、LIS、Cr和BUN含量增高(P<0.05)。見表1。
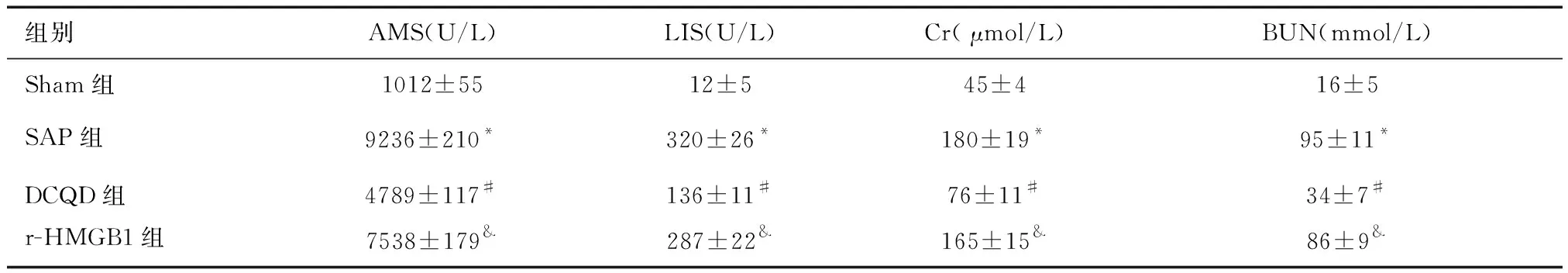
表1 各組大鼠血清AMS、LIS、Cr和BUN含量的比較
2.2 各組大鼠腎臟病理形態的比較如圖1所示,Sham組腎小管細胞形態大小正常;SAP組可見腎小管刷狀緣缺失,管腔擴張或塌陷,細胞脫離管狀基底膜,炎癥細胞浸潤及腎臟病理損傷較Sham組明顯增高。與SAP組相比,DCQD組腎小管刷狀緣缺失,管腔擴張或塌陷,細胞脫離管狀基底膜,炎癥細胞浸潤及腎臟病理損傷評分均減輕。與DCQD組相比,r-HMGB1組腎小管刷狀緣缺失,管腔擴張或塌陷,細胞脫離管狀基底膜,炎癥細胞浸潤及腎臟病理損傷評分均明顯加重。
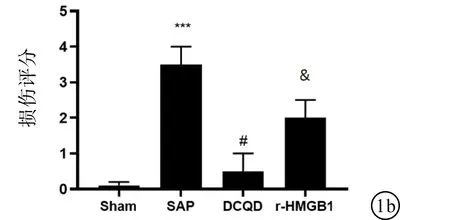
圖1 PAS染色檢測DCQD對腎組織病理損傷影響 a:PAS檢測DCQD對腎組織病理結構的影響(200×); b:腎臟病理損傷評分。***與Sham組比較,P<0.001;#與SAP組比較,P<0.05;&與DCQD組比較,P<0.05
2.3 各組腎臟Acetyl-HMGB1,HMGB1以及血清中HMGB1蛋白表達水平比較與Sham組相比,SAP組腎臟Acetyl-HMGB1和血清中HMGB1表達升高,腎臟HMGB1表達量降低(P<0.05);與SAP組相比,DCQD組、SAP組腎臟Acetyl-HMGB1和血清HMGB1表達降低,腎臟HMGB1表達量增高(P<0.05);與DCQD組相比,r-HMGB1組、SAP組腎臟Acetyl-HMGB1和血清HMGB1表達升高,腎臟HMGB1表達量降低(P<0.05)。見圖2。
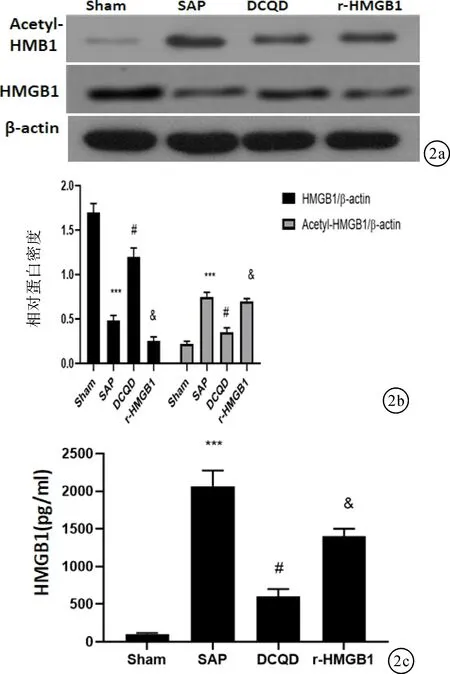
圖2 Western blotting和ELISA檢測DCQD對腎臟Acetyl-HMGB1,HMGB1表達以及血清中HMGB1含量的影響 a:Western blotting檢測Acetyl-HMGB1和HMGB1表達;b:半定量評估Acetyl-HMGB1和HMGB1表達;c:ELISA檢測血清中HMGB1活性。***與Sham組比較,P<0.001;#與SAP組比較,P<0.05;&與DCQD組比較,P<0.05
2.4 各組腎臟TLR-4、MyD88、p-p65和 p65蛋白表達水平比較與Sham組相比,SAP組TLR-4、MyD88、p-p65蛋白表達量增高(P<0.05);與SAP組相比,DCQD組TLR-4、MyD88、p-p65蛋白表達量降低(P<0.05);與DCQD組相比,r-HMGB1組TLR-4、MyD88、p-p65蛋白表達量增高(P<0.05),各組p65蛋白表達量比較,差異無統計學意義(P>0.05)。見圖3。
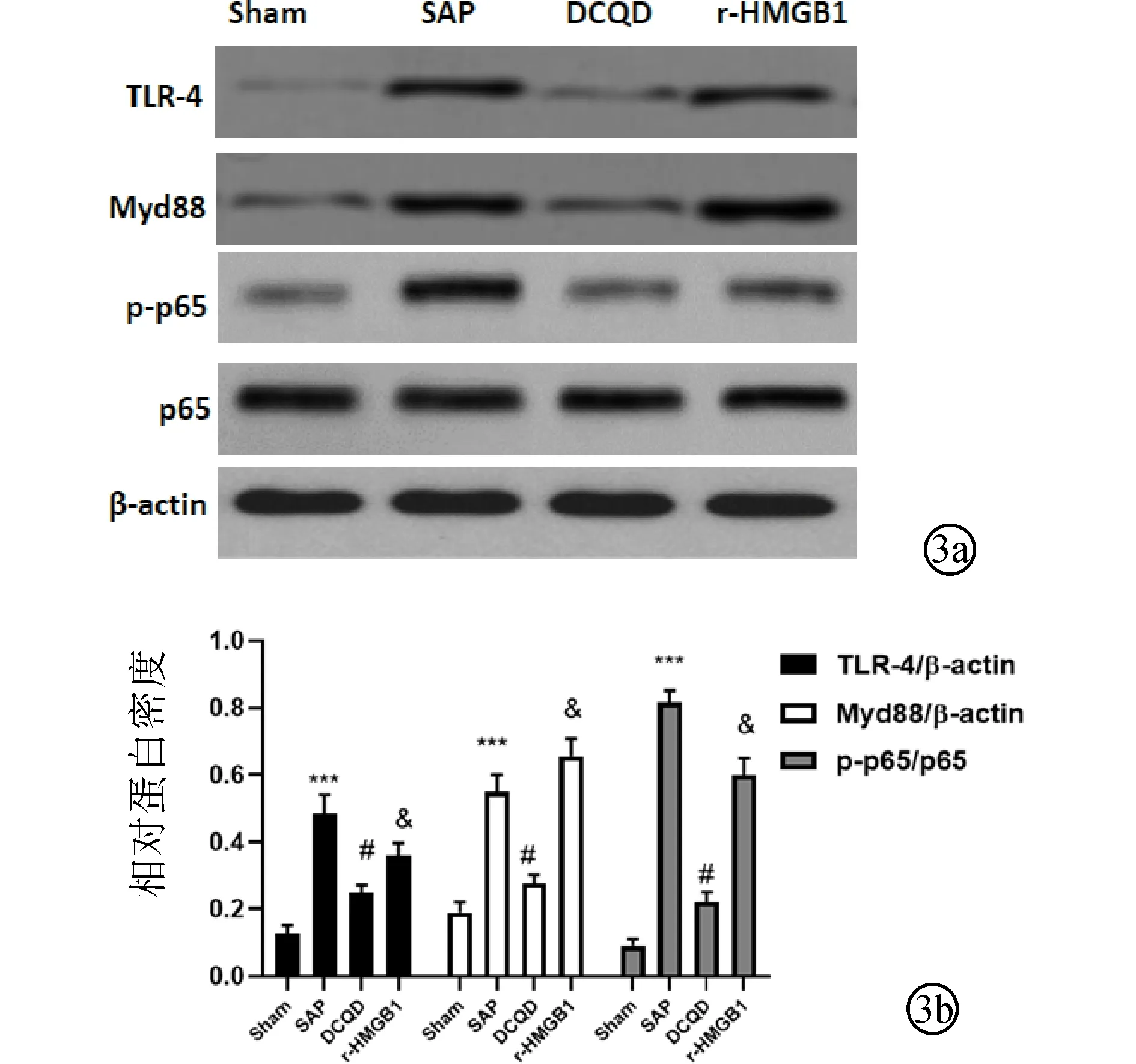
圖3 Western blotting檢測DCQD對腎臟TLR-4、MyD88、p-p65和 p65蛋白表達影響 a:Western blotting檢測TLR-4、MyD88、p-p65和p65蛋白表達;b:半定量評估TLR-4,MyD88,p-p65和 p65蛋白表達。***與Sham組比較,P<0.001;#與SAP組比較,P<0.05;&與DCQD組比較,P<0.05
2.5 各組腎臟中IL-6、MCP-1 和TNF-α mRNA的比較與Sham組相比,SAP組腎臟中IL-6、MCP-1 和TNF-α mRNA表達水平增高(P<0.05);與SAP組相比,DCQD組腎臟中IL-6、MCP-1 和TNF-α mRNA表達水平降低(P<0.05);與DCQD組相比,r-HMGB1組腎臟中IL-6、MCP-1 和TNF-α mRNA表達水平增高(P<0.05)。見表2。
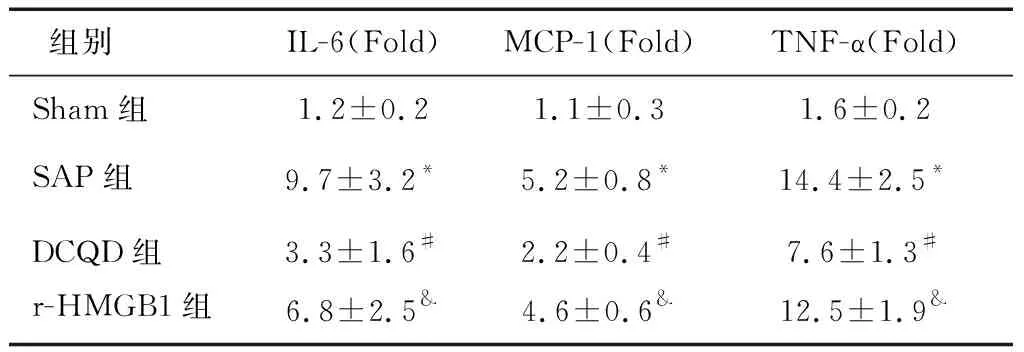
表2 各組腎臟中IL-6、MCP-1 和TNF-α mRNA的比較
2.6 各組血清中IL-6、MCP-1 和TNF-α 含量比較
與Sham組相比,SAP組血清中IL-6、MCP-1 和TNF-α 含量增高(P<0.05);與SAP組相比,DCQD組血清中IL-6、MCP-1 和TNF-α 含量降低(P<0.05);與DCQD組相比,r-HMGB1組血清中IL-6、MCP-1 和TNF-α含量增高(P<0.05)。見表3。
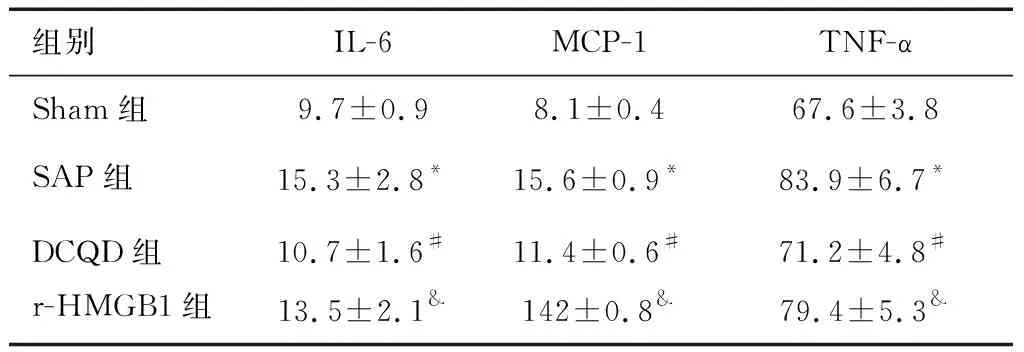
表3 各組血清中IL-6、MCP-1 和TNF-α 含量比較 (pg/ml)
2.7 各組腎組織IL-6、MCP-1 和TNF-α 含量比較
與Sham組相比,SAP組腎組織中IL-6、MCP-1和TNF-α含量增高(P<0.05);DCQD組與SAP組相比,腎組織中IL-6、MCP-1 和TNF-α 含量降低(P<0.05);與DCQD組相比,r-HMGB1組腎臟中IL-6,MCP-1和TNF-α含量增高(P<0.05)。見表4。
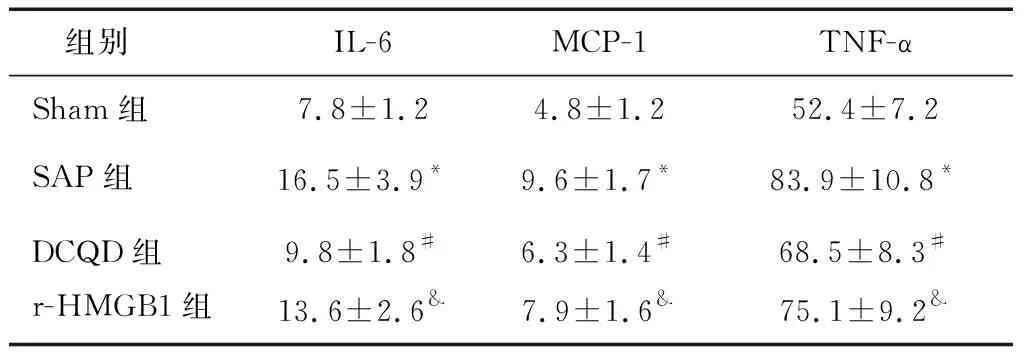
表4 各組腎組織IL-6、MCP-1 和TNF-α 含量比較 (pg/ml)
3 討論
繼發性腎損傷是SAP最常見,最兇險的胰腺外并發癥,是導致SAP患者死亡的重要原因之一。既往研究證實繼發的腎臟受損程度與SAP的危重程度呈正相關,而腎臟受損程度會嚴重影響SAP患者的病程和預后。因此研究SAP并發腎損傷的發病機制具有重大意義[2,3]。
本研究通過胰膽管在大鼠逆行注射牛磺膽酸鈉構建SAP模型,結果顯示血清中AMS、LIS、ALT和AST含量以及腎臟病理損傷均明顯增高,這與既往研究報道相一致,提示重癥胰腺炎誘導腎臟損傷模型構建成功,并進一步證實了SAP可繼發嚴重的腎臟損害[3,4]。大承氣湯的主要成分包括厚樸、大黃、芒硝和枳實,其中大黃等多種成分研究發現具有抑制炎癥和調節免疫等功效評[4]。而HMGB-TLR-4介導的炎癥通路在重癥胰腺炎的發生發展中起著重要作用,但對SAP繼發的腎臟損傷作用機制尚不清楚[3-5]。結果顯示大承氣湯治療可明顯減輕血清中AMS、LIS、Cr和BUN活性以及腎臟病理損傷,提示大承氣湯可減輕SAP誘發的腎臟損害。r-HMGB1可明顯增加血清中AMS、LIS、Cr和BUN活性以及腎臟病理損傷,提示r-HMGB1可抑制大承氣湯對SAP誘發的腎臟損害有保護作用。
既往研究顯示炎癥反應在SAP誘發腎臟損害中起重要作用[3]。IL-6、MCP-1和TNF-α是SAP誘發腎臟損害中最受關注的炎癥因子[3]。IL-6由巨噬細胞、T細胞和T 淋巴細胞分泌,可調節機體免疫反應[6];MCP-1是趨化因子之一,可啟動炎癥級聯反應,調節炎癥因子的分泌和組織損傷[7]。TNF-α是炎癥的始動因子,可調節多種炎癥因子釋放如 IL-6,還可促進氧自由基和一氧化氮的生成以及白細胞的趨化和黏附[7]。結果顯示IL-6、MCP-1和TNF-α在血清和腎臟均明顯增高,進一步證實了炎癥反應在SAP誘發腎臟損害中的關鍵作用,大承氣湯治療可明顯減少血清和腎臟中IL-6、MCP-1和TNF-α的表達,提示大承氣湯可通過抑制炎癥反應減輕SAP誘發的腎損傷。而r-HMGB1可明顯增加血清和腎臟中IL-6、MCP-1和TNF-α的表達,提示r-HMGB1可減輕大承氣湯對炎癥反應的抑制作用HMGB1-TLR4/NF-κB 信號通路在腎臟炎癥反應中起著關鍵的樞紐作用[8]。高遷移率族蛋白1是真核細胞核中的一種非DNA結合蛋白,是損傷相關模式分子的典型代表[8]。當實質細胞壞死或受損,以及免疫細胞激活時,核內的HMGB1可由于乙酰化修飾導致結構的改變而釋放至胞外,作為內源性的“危險信號分子”被天然免疫系統識別,在早期啟動免疫反應,募集免疫效應細胞,“瀑布式”放大免疫反應,導致炎癥和免疫損傷,成為激活免疫炎癥損傷的“扳機點[8]。既往研究顯示HMGB1可通過激活廣泛分布在腎臟細胞表面的模式識別受體TLR4在SAP合并器官損傷的發生及發展過程中起重要作用[9]。激活的TLR4 可通過激活MYD88引起NF-κB上游的IκB蛋白磷酸化降解以及NF-κBp65 的磷酸化激活,然后促使IL-6、MCP-1和TNF-α等炎癥因子的表達[9]。結果顯示,DCQD治療可明顯減輕SAP誘導的腎臟HMGB1乙酰化的修飾,減少HMGB1的分泌以及腎臟TLR-4、MyD88,p-p65蛋白的表達,而r-HMGB1可減輕DCQD對HMGB1乙酰化修飾抑制作用以及促進HMGB1-TLR4/NF-κB 信號通路的激活,提示DCQD可通過抑制HMGB1乙酰化修飾,繼而抑制HMGB1-TLR-4/NF-κB信號途徑介導的炎癥反應。

