血液病并發革蘭陽性菌血流感染患者的臨床特點及預后影響因素▲
袁詩思 吳瑩瑩 劉繼聰 王麗淋 王佩錫 李橋川
(廣西醫科大學第一附屬醫院血液內科,南寧市 530021,電子郵箱:1664121724@qq.com)
由于原發病特點、細胞毒性藥物治療后粒細胞缺乏(粒缺)及侵入性操作等原因,血液病患者血流感染發生率為11%~38%,病死率達12%~42%[1]。血培養陽性率低、結果存在滯后性,導致臨床上抗生素的使用主要為經驗性用藥,而經驗性抗生素的選擇主要依據病原菌流行病學及耐藥特點。故本研究回顧性分析我院血液科血液病并發革蘭陽性菌血流感染患者的臨床資料,為臨床經驗性抗感染治療提供依據。
1 資料與方法
1.1 臨床資料 收集2012年6月至2020年5月在我院血液科確診為革蘭陽性菌血流感染的164例患者的一般資料、血培養及藥敏結果。納入標準:血流感染的診斷符合《醫院感染診斷標準(試行)》[2]中的相關標準,且經血培養確診為革蘭陽性菌引起的血流感染。排除標準:血培養結果陽性但未經治療即放棄治療出院者。患者年齡2~78歲,中位年齡36歲,其中男性101例、女性63例,共發生167例次革蘭陽性菌血流感染。134例(81.7%)為惡性血液病患者,包括白血病97例(59.1%)、淋巴瘤15例(9.1%)、多發性骨髓瘤11例(6.7%)及骨髓異常增生綜合征11例(6.7%);30例為良性血液病患者,包括重型地中海貧血21例(12.8%)、再生障礙性貧血3例(1.8%)、特發性血小板減少性紫癜3例(1.8%)、血栓性血小板減少性紫癜3例(1.8%)。發生血流感染時有111例(67.7%)患者處于粒細胞缺乏(粒缺)期,106例(64.6%)患者合并肺炎。按照細菌分離培養時間將病例及其檢出病原菌分為A組(2012年6月至2016年5月)及B組(2016年6月至2020年5月)。
1.2 菌株培養及鑒定方法 參照《全國臨床檢驗操作規程》[3]進行細菌分離培養。使用法國生物梅里埃ATB細菌鑒定系統及配套的ID32GN細菌鑒定試劑卡進行菌株鑒定,藥敏試驗方法采用K-B法。同一患者連續分離出同一菌株不重復計入。
1.3 指標收集 患者的性別、年齡、入院至血流感染發生的間隔時間、是否為造血干細胞移植后患者、是否為粒缺患者及粒缺天數、血流感染當天白蛋白水平、血流感染前1個月及至感染控制期間抗菌藥物使用情況、血流感染2周前使用免疫抑制劑情況、血流感染時合并癥(例如合并其他部位感染、感染性休克、心功能不全等)、血培養及藥敏試驗結果,并隨訪患者確診血流感染后30 d內的轉歸情況。
1.4 相關定義 (1)粒缺定義為患者外周血中性粒細胞絕對計數 < 0.5×109/ L,粒缺持續時間以患者診斷為粒缺的時間開始計算。(2)感染性休克定義為伴有足以引起死亡概率增加的持續循環和/或細胞代謝紊亂的膿毒癥[4]。(3)心功能不全定義為由于各種心臟功能或結構性障礙使心臟充盈和/或射血能力受損[5]。(3)多重細菌感染定義為同一血標本同時培養出2種或以上細菌,或連續多次分離出2種及以上細菌;多重耐藥菌為病原菌對3類或3類以上抗菌藥物不敏感[6]。
1.5 統計學分析 應用SPSS 24.0、MedCalc軟件進行統計學分析。非正態分布計量資料以中位數(四分位數)表示,組間比較采用Mann-Whitneyu檢驗;計數資料以例數(百分比)表示,組間比較采用χ2檢驗或Fisher確切概率法;將單因素分析中P<0.05的指標納入多因素Logistic回歸模型進行分析;繪制受試者工作特征(receiver operating characteristic,ROC)曲線評估各指標對預后的預測價值。以P<0.05為差異有統計學意義。
2 結 果
2.1 血液病并發革蘭陽性菌血流感染患者的病原菌分布 164例患者共檢出172株革蘭陽性菌,其中球菌168株(97.7%)、桿菌4株(2.3%)。檢出率位列前4的病原菌依次為凝固酶陰性葡萄球菌(87株,50.6%)、草綠色鏈球菌(31株,18.0%)、金黃色葡萄球菌(26株,15.1%)、腸球菌(15株,8.7%),其中凝固酶陰性葡萄球菌以表皮葡萄球菌、人葡萄球菌及溶血葡萄球菌為主,腸球菌包括屎腸球菌12株、糞腸球菌3株。172株革蘭陽性菌中,A組有63株,B組有109株,B組的金黃色葡萄球菌檢出率高于A組(P<0.05)。見表1。

表1 A組與B組病原菌分布的比較[n(%)]
2.2 血液病并發革蘭陽性菌血流感染患者的耐藥情況 變遷藥敏結果提示,172株革蘭陽性菌中多重耐藥菌共有106株,A、B組多重耐藥菌檢出數量分別為43株(68.3%)及63株(57.8%)。(1)葡萄球菌屬中,凝固酶陰性葡萄球菌對大部分抗生素耐藥率普遍高于金黃色葡萄球菌,兩者均未檢出對萬古霉素、替考拉寧、利奈唑胺及替加環素耐藥的株菌;我院藥敏試驗利用苯唑西林代表甲氧西林,耐甲氧西林凝固酶陰性葡萄球菌(methicillin-resistant coagulase-negativeStaphylococci,MRCNS)的總檢出率為83.9%(73/87),2016年6月至2020年5月檢出率變化較小,耐甲氧西林金黃色葡萄球菌(methicillin-resistantStaphylococcusaureus,MRSA)總檢出率53.8%(14/26),2016年6月至2020年5月檢出率由75%降至50%;凝固酶陰性葡萄球菌對復方新諾明、利福平耐藥率呈下降趨勢。(2)金黃色葡萄球菌對慶大霉素、左氧氟沙星、復方新諾明及利福平耐藥率<30%或不耐藥。(3)草綠色鏈球菌對頭孢曲松、萬古霉素、利奈唑胺及利福平均敏感。(3)腸球菌對紅霉素、左氧氟沙星、青霉素G及克林霉素高度耐藥,對替考拉寧、利奈唑胺、替加環及萬古霉素敏感,共檢出1株耐萬古霉素腸球菌(vancomycin-resistantEnterococcus,VRE),總檢出率為6.7%(1/15)。見表2。

表2 A組和B組主要革蘭陽性菌耐藥率的比較
2.3 抗菌治療與臨床結局 167例次革蘭陽性菌血流感染中,在明確病原菌和藥敏結果后,69例次進行了抗生素調整,總的抗生素調整率為41.3%。初始應用糖肽類抗生素(萬古霉素或替考拉寧)或利奈唑胺者的抗生素調整率為16.9%(13/77),初始未應用糖肽類抗生素或利奈唑胺者的抗生素調整率為62.2%(56/90),差異有統計學意義(χ2=35.182,P<0.001)。164例患者均進行規律治療,其中20例(12.2%)患者在血流感染30 d內死亡,包括2例因原發病進展死亡,18例因感染未控制死亡。
2.4 血液病患者并發革蘭陽性菌血流感染后30 d內病死的影響因素 為排除非規律治療對預后造成的影響,僅在164例接受規律治療的患者中進行影響因素分析。單因素分析結果顯示,患者年齡、腸球菌血流感染、多重細菌感染、感染性休克、心功能不全、感染前1個月內有喹諾酮類暴露史、血流感染當天血清白蛋白<30 g/L是影響血液病患者并發革蘭陽性菌血流感染后30 d內死亡的相關因素(均P<0.05),見表3。將上述因素納入多因素Logistic回歸模型中進行分析(變量賦值見表4),結果顯示,年齡、腸球菌血流感染、感染性休克、血流感染當天血清白蛋白<30 g/L是血液病患者并發革蘭陽性菌血流感染后30 d內病死的獨立影響因素(均P<0.05),見表5。

表3 單因素分析結果

組別n感染前1個月內有喹諾酮類暴露史[n(%)]入院至血流感染發生的時間間隔>15 d[n(%) ]近2周使用免疫抑制劑[n(%)]血流感染當天血清白蛋白<30 g/L[n(%)]粒缺大于7 d[n(%)]多重耐藥菌[n(%)]死亡組2012(60.0)8(40.0)15(75.0)10(50.0)7(35.0)14(70.0)存活組14436(25.0)61(42.4)118(81.9)19(13.2)66(45.8)88(61.1) χ2/z值10.3910.040——0.8240.590P值0.0010.8410.541*<0.001*0.3610.442

表4 變量賦值情況

表5 多因素Logistic回歸分析結果
2.5 ROC曲線分析 利用年齡、感染性休克情況、腸球菌血流感染情況及白蛋白<30 g/L模擬綜合指標建立Logistic回歸方程:log it(P)=0.079×年齡+2.987×腸球菌血流感染+3.869×感染性休克+1.808×白蛋白<30 g/L-7.281。該綜合指標預測規律治療的血液病患者并發革蘭陽性菌血流感染后30 d內死亡的ROC曲線下面積(area under the curve,AUC)為0.943(P<0.05),敏感度為95.00%,特異度為80.56%,綜合指標的AUC優于單一指標(均P<0.05),見圖1和表6。

圖1 不同指標預測規律治療的血液病患者并發革蘭陽性菌血流感染后30 d內死亡的ROC曲線
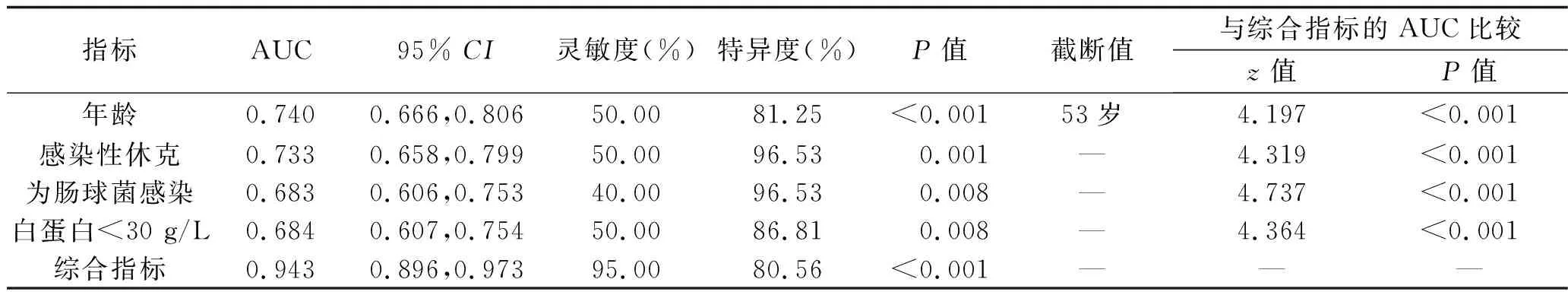
表6 不同指標對規律治療的血液病并發革蘭陽性菌血流感染患者預后的預測價值
3 討 論
血流感染是血液病患者的常見重癥合并癥,以革蘭陰性菌感染為主,但隨著侵入性操作的增多等,革蘭陽性菌占比有上升趨勢[7]。本研究結果顯示,164例血液病合并血流感染患者檢出的172株革蘭陽性菌中,絕大部分為革蘭陽性球菌(97.7%),檢出率最高的為凝固酶陰性葡萄球菌。相較于2012年6月至2016年5月,2016年6月至2020年5月我院血液科革蘭陽性菌血流感染中金黃色葡萄球菌檢出率升高(P<0.05),而凝固酶陰性葡萄球菌、草綠色鏈球菌、腸球菌及桿菌的檢出率無明顯改變(均P>0.05)。
血液病患者發生血流感染后進展迅速、預后不良,早期啟用敏感抗菌藥物可以降低患者住院率和改善預后。本研究中,有67.7%的患者發生血流感染時處于粒缺期。國內外有關粒缺伴發熱患者抗菌的指南[8-9]推薦,針對存在革蘭陽性菌感染風險(導管相關感染、皮膚軟組織感染、肺炎)、MRSA或VRE定植、血流動力學不穩定的粒缺患者,一線用藥應聯用抗革蘭陽性菌藥物。與全球耐藥問題的日趨加重相似,國內對于血液病患者傾向于采用長時間、大劑量廣譜抗菌藥物治療,這使我國耐藥問題亦嚴重。本研究耐藥性分析結果顯示,我院血液病并發革蘭陽性菌血流感染患者中,MRCNS、MRSA、VRE總檢出率分別為83.9%(73/87)、53.8%(14/26)及6.7%(1/15)。凝固酶陰性葡萄球菌、金黃色葡萄球菌、草綠色鏈球菌、腸球菌對萬古霉素、替考拉寧、利奈唑胺及替加環素敏感率為93.3%~100.0%。初始應用糖肽類抗生素或利奈唑胺者的抗生素調整率低,與2017年對粒缺期腫瘤患者血流感染抗菌治療的Meta分析結果[10]相似。這提示,當考慮血液病患者并發革蘭陽性菌血流感染時,經驗性使用抗菌藥物可以選用糖肽類、利奈唑胺或替加環素。
本研究結果顯示,接受規律治療的血液病患者并發革蘭陽性菌血流感染后30 d內的病死率為12.2%,與國內相關研究結果[11-12]類似。有研究顯示,中老年血液病患者(年齡>55或65歲)常合并其他心肺疾病,化療副作用多,預后不良[13-14]。腸球菌感染常發生于老年、免疫力低下、黏膜屏障受損的患者,對頭孢菌素等常見抗菌藥物天然耐藥,且有研究表明VRE與造血干細胞移植患者的病死率密切相關[15]。感染性休克及其導致的心功能不全等多器官功能衰竭的出現往往提示感染嚴重、預后不佳。嚴重感染會加重低白蛋白血癥,而低白蛋白血癥將導致白蛋白的抗炎作用減弱、有效循環血容量不足、藥物有效血液濃度降低,進而影響預后[16]。除此之外,原發疾病狀態、Pitt菌血癥評分>3分、持續粒缺、不適當抗菌藥物管理、革蘭陰性菌感染等也可影響患者的病死率[1,17]。本研究結果顯示,對于接受規律治療的血液病并發革蘭陽性菌血流感染患者,年齡、感染性休克、腸球菌血流感染及血流感染當天血清白蛋白<30 g/L是患者感染后30 d內死亡的獨立影響因素(P<0.05),包含以上4個因素的綜合指標預測患者預后的AUC達0.943,敏感度為95.00%,特異性為80.56%,說明以上4個因素與接受規律治療的血液病并發革蘭陽性菌血流感染患者的預后密切相關,對于預測轉歸有較高的臨床價值。因此,要加強對患者血流動力學的管理及營養支持,并對高齡、腸球菌血流感染、合并感染性休克及血流感染當天血清白蛋白<30 g/L的患者早期重視、及早干預。
綜上所述,血液病患者并發革蘭陽性菌血流感染時以凝固酶陰性葡萄球菌為主,金黃色葡萄球菌檢出率有上升趨勢;常見的病原菌抗生素耐藥率高,但對糖肽類抗生素、利奈唑胺及替加環素仍敏感,因此,對于高度懷疑革蘭陽性菌所致血流感染的血液病患者,在完善血培養的同時,早期可經驗性應用糖肽類抗生素、利奈唑胺等,再根據藥敏結果調整用藥。此外,應重視高齡、合并腸球菌血流感染、感染性休克及血流感染當天血清白蛋白<30 g/L的患者,規律治療的同時需密切、動態觀察病情,以降低病死率。

