肝內膽管癌患者血清CXCL9和IFN-γ水平變化及其臨床意義探討
宋 雪,席子涵,李 婷,周 苗
肝內膽管癌(intrahepatic cholangiocarcinoma,ICC)是原發性肝癌中較為常見的惡性腫瘤,其發病率呈逐年上升的趨勢,預后差,嚴重威脅患者的生命健康[1]。目前,ICC的發病因素尚未完全闡明,但學者們認為其發病與寄生蟲感染、肝內膽管結石、病毒性肝炎、血管生成和免疫調節紊亂等有關。此外,臨床仍缺乏有效評估ICC患者預后的指標[2-4]。因此,尋找與ICC發病有關且可有助于評估患者預后的標志物是關鍵。研究發現,前列腺癌趨化因子配體9(C-X-C motif chemokine ligand 9,CXCL9)表達失調,可能通過抑制T細胞細胞因子表達,從而促進前列腺癌的發病進程[5]。另外,干擾素-γ(interferon-γ, IFN-γ)在肺腺癌患者中表達下調,也可能在疾病的發生發展過程中起重要作用[6]。本研究檢測了ICC患者血清CXCL9和IFN-γ水平變化,并分析了檢測的臨床意義。
1 資料與方法
1.1 臨床資料 2012年1月~2017年1月我院收治的ICC患者63例,男40例,女23例;年齡為36~75歲,平均年齡為(58.66±12.36)歲。參考《美國肝膽胰學會共識聲明》[7]有關ICC判定標準進行診斷。納入標準:(1)經組織病理學檢查確診;(2)術前未進行過放化療等任何抗腫瘤治療。腫瘤<5 cm者20例,腫瘤≥5 cm者43例;TNM Ⅰ/Ⅱ期者47例,Ⅲ/Ⅳ期者16例;淋巴結轉移者12例;低分化者30例,中/高分化者33例;脈管癌栓11例。排除標準:(1)合并肝、腎功能不全、其他惡性腫瘤;(2)失訪者。另選擇同期在我院健康體檢者63例,男38例,女25例;年齡為35~77歲,平均年齡為(59.02±12.54)歲。ICC組與健康人男女性別比例和年齡比較,差異無統計學意義(P>0.05),具有可比性。所有研究對象或其家屬簽署知情同意書,本研究符合《赫爾辛基宣言》,并獲得我院醫學倫理委員會批準。
1.2 治療方法 63例ICC患者均接受根治性腫瘤切除術,并清掃周圍淋巴結。
1.3 血清CXCL9和IFN-γ水平檢測 采用ELISA法檢測(上海恒斐生物科技有限公司,貨號:CSB-E11718h-1和江蘇普諾生生物科技有限公司,貨號:PK-EL-61806),于冰箱中取出試劑盒內配套的標準品,配制成標準品溶液,檢測各濃度標準品溶液的吸光度,繪制標準回歸曲線。將血清解凍,平衡至室溫,將血清加入酶標板中,設置3個復孔,每孔100μL;將酶標板放入37℃培養箱中,孵育20~30 min,每孔分別加入相應含有CXCL9 生物素工作液100 μL或IFN-γ生物素工作液100 μL,37℃孵育50~60 min,棄掉反應液,用PBS洗滌2次;每孔加親和素-過氧化物酶復合物工作液100 μL,37℃孵育30 min,棄去反應液,用PBS洗滌3次;每孔添加顯色液90 μL,37℃孵育20 min,每孔加入終止液10 μL,于Q3000型酶標儀(北京鼎國昌盛生物技術有限責任公司)450 nm處檢測各樣本吸光度值。依據標準回歸曲線計算血清CXCL9和IFN-γ水平。
1.4隨訪 采取電話/門診隨訪,以ICC患者接受手術日期為隨訪起點,以死亡或隨訪截止至2020年1月為隨訪終點。

2 結果
2.1 兩組血清CXCL9和IFN-γ水平比較 與健康人比,ICC患者血清CXCL9水平顯著升高(P<0.05),而血清IFN-γ水平顯著降低(P<0.05,表1)。
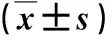
表1 兩組血清CXCL9和IFN-γ水平比較
2.2 不同臨床和病理學特征ICC患者血清CXCL9和IFN-γ水平比較 不同TNM分期、有無淋巴結轉移、不同分化程度的ICC患者血清CXCL9和IFN-γ水平差異顯著(P<0.05),而不同性別、年齡、腫瘤大小、有無脈管癌栓的ICC患者血清CXCL9和IFN-γ水平無顯著性差異(P>0.05,表2)。

表2 不同臨床和病理學特征ICC患者血清CXCL9和IFN-γ水平比較
2.3 不同血清CXCL9和IFN-γ水平的ICC患者預后比較 對63例ICC患者進行36個月的隨訪,結果死亡42例(66.7%),生存21例(33.3%);以ICC患者血清CXCL9水平為820.7 pg/mL為截斷點,低水平者30例,高水平者33例,經Kaplan-Meier生存分析顯示,血清CXCL9低水平的ICC患者術后36個月生存16例(53.3%),顯著高于CXCL9高水平組的5例(15.2%)。經卡方檢驗,兩組生存率比較存在統計學差異(x2=12.448,P<0.001);以ICC患者血清IFN-γ水平為18.7 ng/L為截斷點,低水平者34例,高水平者29例,IFN-γ低水平組術后36個月生存5例(14.7%),顯著低于高水平組的16例(55.2%),兩組生存率存在統計學差異(x2=10.554,P=0.001)。
3 討論
ICC是一種消化道惡性腫瘤,其起病隱匿,早期易發生淋巴結轉移,對放化療敏感性低,多數患者治療預后極差,對人類健康構成極大的威脅[8-10]。因此,尋找ICC發病相關因素,并及早干預,對改善患者預后有一定的積極意義。
趨化因子是一類蛋白多肽小分子,包含CC、C、C3XC4、CXC等4個亞族。CXC類趨化因子在腫瘤發病過程中發揮重要的作用,包括調控腫瘤有關血管生成、白細胞浸潤、刺激宿主對腫瘤的免疫應答、以旁分泌/自分泌方式影響腫瘤細胞增殖和調節腫瘤細胞運動等[11,12]。CXCL9屬于趨化因子CXC亞族,其基因位于4q21染色體上,可調節細胞生長、凋亡,介導血管穩定,影響免疫調節,與結直腸癌、胃癌、ICC等癌癥發展過程相關[13-15]。近期研究發現,CXCL9在早期乳腺癌發病過程中水平異常升高,其與乳腺癌患者不良預后及腫瘤浸潤有關,CXCL9可作為判定乳腺癌患者預后的生物學標志物[16]。另外,CXCL9在胰腺癌中呈高表達,其可能與其參與趨化免疫細胞作用,與患者不良預后相關,有望成為治療胰腺癌的潛在靶標[17]。以上研究證實,CXCL9水平異常可能與多種腫瘤的病變過程密切相關。Fukuda et al[18]研究認為CXCL9可能通過調節ICC腫瘤浸潤性自然殺傷細胞,進而影響患者預后,因此認為CXCL9可作為評估ICC患者預后及治療ICC的生物學靶點。在本研究中ICC組患者血清CXCL9水平顯著高于健康組,與其在胰腺癌中的表現趨勢一致[16],提示CXCL9可能在ICC發生發展過程中具有重要的作用,推測CXCL9作為趨化因子家族成員之一,其水平升高可能促進腫瘤細胞浸潤、細胞增殖,影響機體免疫應答或血管生成等,進而促進ICC的發展,但具體作用機制仍需進一步探究證實。
IFN-γ主要是由自然殺傷細胞和活化的T細胞分泌的細胞因子,人IFN-γ基因位于第12號染色體,其可抑制腫瘤細胞增殖、轉移、血管生成,影響腫瘤微環境,促使腫瘤細胞凋亡。另外,IFN-γ可通過增加巨噬細胞膜表面Fc受體表達水平,進而增加巨噬細胞因子合成抑制因子,從而抑制活化的Th1淋巴細胞產生IFN-γ和白細胞介素-2,抑制免疫應答,與多種腫瘤病理學發展關系密切[19-21]。研究發現,IFN-γ在胃癌患者血清中水平降低,與淋巴結轉移、臨床分期顯著相關,其可能參與并影響胃癌病理學發展結局[22,23]。在本研究中ICC患者血清IFN-γ水平顯著低于健康人,提示IFN-γ可能在ICC發病過程中起重要作用,究其原因,一方面,低水平的IFN-γ降低了機體對腫瘤細胞增殖、轉移、血管生成的抑制作用,對腫瘤細胞的促凋亡作用降低,進而促進ICC發生和發展;另一方面,Th1型細胞主要介導細胞免疫,Th2型細胞主要介導體液免疫,且機體對腫瘤的免疫調節以Th1型細胞為主。若發生免疫功能偏移,形成Th2型細胞,腫瘤細胞易發生免疫逃逸,促進腫瘤的發生和發展,故低水平IFN-γ抑制自然殺傷細胞分泌IFN-γ,降低自然殺傷細胞的殺傷性,不利于Th1細胞分化,反而能促進Th2型細胞形成,影響免疫平衡,促進腫瘤細胞發生免疫逃逸,促進ICC病理學生長和發展,但仍需進一步探討其作用機制。
在本研究中ICC患者血清CXCL9和IFN-γ水平與腫瘤TNM分期、淋巴結轉移、分化程度相關,進一步提示CXCL9和IFN-γ與ICC患者臨床和病理學特征有關,兩者均可能在ICC發生發展過程中具有重要作用。本研究顯示,CXCL9低水平組和IFN-γ高水平組ICC患者術后36個月生存率分別顯著高于CXCL9高水平組或IFN-γ低水平組,提示ICC患者血清CXCL9和IFN-γ水平異常變化與患者不良預后密切相關,兩者有望成為評估ICC預后的標志物。
綜上所述,ICC患者血清CXCL9水平顯著上調,而血清IFN-γ水平顯著降低,兩者均可能參與并影響ICC患者發病的進展,檢測血清CXCL9和IFN-γ水平有利于臨床評估ICC患者預后情況。但本研究未深入探究CXCL9和IFN-γ在ICC患者的變化規律,且樣本較少,易造成檢測誤差,后期將擴大研究樣本量進行深入研究。

