西羅莫司對肝臟熱缺血-再灌注損傷小鼠肝組織TLR4表達和細胞自噬功能的影響*
唐雙意,王希斌,丘 岳,覃福禮,張宏亮,蔣 霞
肝臟缺血-再灌注(ischemia-reperfusion,I/R)損傷是指中斷的肝臟血供重新恢復血供灌注后所引起的肝組織損傷的病理生理過程[1,2]。肝臟I/R損傷是肝移植、肝切除和外傷后肝損傷的主要原因,然而目前臨床上針對肝臟I/R損傷仍缺乏有效的保護手段。西羅莫司是一種大環內酯類化合物,作為主要的免疫抑制劑在器官移植術后抗排異反應中被廣泛應用。在體內,西羅莫司通過抑制哺乳類雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)發揮免疫抑制活性。文獻[3]報道,在大鼠腎臟I/R損傷模型,西羅莫司能減少腎小球濾過率下降,減輕腎組織損傷。國內報道[4]顯示,西羅莫司在大鼠肝臟I/R損傷過程中具有保護作用。然而,目前對西羅莫司抗I/R損傷的具體機制尚不完全清楚。本研究通過構建小鼠部分肝臟I/R損傷模型,觀察了西羅莫司預處理的保護作用,并從Toll樣受體4(Toll-like receptor 4,TLR4)介導的免疫炎癥損傷和自噬方面探討了其可能的作用機制,以期為肝臟I/R損傷的治療尋找新思路。
1 材料與方法
1.1 動物、主要試劑與儀器 雄性Balb/c小鼠40只,6~8周齡,購自北京維通利華實驗動物技術有限公司【合格證號:SCXK(京)2020-0029】。西羅莫司(美國Selleck公司,純度≥98%);檢測谷丙轉氨酶(ALT)、谷草轉氨酶(AST)、腫瘤壞死因子α(TNF-α)、白細胞介素6(IL-6)試劑盒(南京建成生物工程研究所);兔抗小鼠TLR4抗體(Santa Cruz公司);兔抗小鼠P65、抗p-P65、抗微管相關蛋白1輕鏈3-Ⅱ(LC3B-Ⅱ)、抗GAPDH抗體和HRP標記的羊抗兔二抗(美國CST公司);兔抗小鼠P62抗體(Eptomics公司);全自動酶標免疫分析儀(Biotex公司);全自動生化分析儀(日本Hitachi公司);蛋白電泳和轉膜儀(美國Bio-Rad公司);透射電子顯微鏡(荷蘭FEI公司)。
1.2 動物模型的制備 將40只小鼠適應性喂養后,隨機分為對照組、模型組、小劑量(1 mg.kg-1)和大劑量西羅莫司干預組(3 mg.kg-1),每組10只。在西羅莫司干預組,分別于術前2 d開始腹腔注射給藥,連續2 d,在對照組和模型組,則給予等量的生理鹽水腹腔注射。手術當日,給予小鼠戊巴比妥60 mg.kg-1深度麻醉,仰臥位固定。消毒腹壁皮膚并于小鼠下腹部行T型切口,小心分離皮膚、剪開腹膜,充分暴露腹腔、解剖小葉韌帶后,以微血管夾阻斷Glison鞘的左支和中支,可見小鼠肝臟中葉和左外葉呈暗紅色或灰白色改變,而右葉顏色鮮紅不變。在60 min后,移除微血管夾,待缺血肝葉恢復血色后,縫合腹腔[5];在對照組采用同樣的手術方式,但術中不使用微血管夾阻斷血供。恢復再灌注6 h后,每組取6只小鼠經眼眶取血后處死,取肝組織,用生理鹽水充分沖洗并吸取表面水分,一部分置于10%福爾馬林中固定24 h,常規石蠟包埋、切片,進行HE染色;另一部分使用2.5%戊二醛固定,制作電鏡切片,將其余肝組織置于-80℃冰箱保存。
1.3 血清指標檢測 使用全自動血生化分析儀及相應的試劑盒檢測血清ALT和AST活力;采用ELISA法檢測血清TNF-α和IL-6。
1.4 肝組織蛋白表達檢測 取各組小鼠肝組織,加入組織裂解液,勻漿,提取蛋白,采用BCA法定量蛋白質。取50 μg樣品蛋白,經聚丙烯酰胺凝膠電泳,轉印至硝酸纖維素膜,使用5%脫脂牛奶室溫封閉2 h,以GAPDH為內參,分別加入抗TLR4、抗P65、抗p-P65、抗LCB-Ⅱ和抗P62抗體,4℃孵育過夜,TBST洗膜3次。最后,加二抗室溫下孵育2 h,采用ECL法顯色,應用Image J軟件分析蛋白條帶灰度值,計算各蛋白相對表達量。
1.5 肝組織自噬小體檢測 取約1mm3肝組織,使用2.5%戊二醛固定。超薄切片,用醋酸鈾和檸檬酸鉛雙重染色。使用Tecnai G2透射電子顯微鏡獲取圖像,隨機取每個肝臟樣本10張顯微照片,計數自噬小體總量。
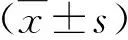
2 結果
2.1 各組小鼠血清AST和ALT水平比較 與對照組比,模型組小鼠血清AST和ALT水平均顯著升高(P<0.05);與模型組比,小劑量和大劑量西羅莫司干預組小鼠血清AST和ALT水平均顯著降低(P<0.05,表1)。

表1 各組小鼠血清AST和ALT水平比較
2.2 各組小鼠肝組織病理學表現 對照組小鼠肝組織結構正常,肝小葉結構完整,肝細胞呈條索狀排列,未見變性、壞死細胞;模型組可見肝小葉結構不清,網狀纖維支架塌陷,細胞排列紊亂,胞質疏松,細胞呈空泡樣變,可見大片狀肝細胞壞死,且炎性細胞浸潤明顯;在小劑量和大劑量西羅莫司干預組肝細胞空泡樣變和壞死程度有不同程度的減輕,炎性細胞浸潤均明顯減少(圖1)。

圖1 各組小鼠肝組織病理學表現(HE,200×) A:對照組;B:模型組;C:小劑量干預組;D大劑量干預組
2.3 各組小鼠血清細胞因子水平比較 與對照組比,模型組小鼠血清TNF-α和IL-6水平均顯著升高(P<0.05);與模型組比,小劑量和大劑量西羅莫司干預組小鼠血清細胞因子水平均顯著降低(P<0.05,表2)。
表2 各組小鼠血清細胞因子水平比較
2.4 各組小鼠肝組織TLR4/NF-κB信號通路相關蛋白表達情況 與對照組比,模型組小鼠肝組織TLR4蛋白表達和p-p65/p65比值均顯著升高(P<0.05);與模型組比,小劑量和大劑量西羅莫司干預組小鼠肝組織TLR4和p-p65/p65比值均顯著降低(P<0.05,圖2)。

圖2 各組小鼠肝組織TLR4/NF-κB信號通路相關蛋白表達情況 與對照組比,*P<0.05;與模型組比,#P<0.05
2.5 各組小鼠肝組織自噬相關蛋白表達和自噬小體數量比較 與對照組比,模型組小鼠肝組織LC3B-Ⅱ和P62蛋白表達及自噬小體數量差異均無統計學意義(P>0.05);與模型組比,小劑量和大劑量西羅莫司干預組小鼠肝組織LC3B-Ⅱ和P62蛋白表達水平及自噬小體數量均顯著增加(P<0.05,圖3)。

圖3 各組小鼠肝組織自噬相關蛋白表達和自噬小體數量比較 A:各組小鼠肝組織LC3B-Ⅱ和P62蛋白表達(Western blot);B:各組小鼠肝組織LC3B-Ⅱ和P62蛋白相對表達水平;C:各組小鼠肝組織自噬小體數量(透射電鏡,6000×);D:各組小鼠肝組織自噬小體數量比較與對照組比,*P<0.05;與模型組比,#P<0.05
3 討論
本研究采用手術夾閉小鼠Glison鞘左支和中支構建部分肝臟熱I/R模型,模型制備獲得成功。肝組織學檢查顯示,模型組出現細胞排列紊亂,小葉結構不清,細胞空泡樣變,炎性細胞浸潤等明顯異常表現,符合肝臟熱I/R損傷的病理學表現。另外,血清學檢測發現與對照組相比,模型組血清ALT和AST大幅升高,結合上述幾點可見本研究小鼠部分肝臟熱I/R損傷模型構建成功。本研究在小劑量和大劑量西羅莫司預處理均可以有效降低小鼠血清ALT和AST活性,肝細胞變性和炎性浸潤明顯改善,提示該藥能明顯改善肝I/R病程學損傷。
肝臟I/R損傷是一種先天免疫系統主導的局部炎癥反應,在肝臟I/R期間,損傷或壞死的細胞釋放損傷相關分子模式分子,進一步激活模式識別受體,從而誘導強烈的炎癥反應和組織損傷[5-7]。TLR4作為一種重要的模式識別受體,研究[8]表明在肝臟I/R損傷中,炎癥和免疫反應主要取決于TLR4的活化程度。另有研究[9]發現,在肝臟熱I/R損傷模型小鼠,TLR4信號通過招募下游MyD88蛋白介導了NF-κB的活化,擴大肝臟炎癥反應并進一步引起肝細胞凋亡。NF-κB作為一種重要的細胞轉錄因子,NF-κB磷酸化是其活化進入胞核與靶序列結合,促進靶基因表達的關鍵標志[10,11]。本研究在小劑量和大劑量西羅莫司干預組均可以明顯下調TLR4表達并抑制NF-κB(p65)的磷酸化水平,因此推測西羅莫司可能通過抑制TLR4/NF-κB信號通路激活,減輕小鼠肝臟I/R。西羅莫司還可以明顯下調血清TNF-α和IL-6水平,提示西羅莫司干預通過抑制NF-κB激活和隨后的炎癥反應減輕了小鼠肝臟I/R損傷。
越來越多的證據表明,自噬參與了多種肝臟疾病過程,包括毒素和藥物誘導的肝損傷、非酒精性脂肪性肝病、酒精性肝病、病毒性肝炎和肝細胞癌等[12,13]。自噬被證實在肝臟I/R損傷中具有保護作用[14,15],誘導自噬已成為I/R損傷后改善肝功能的潛在新策略。在肝臟I/R損傷過程中,自噬通過提供氨基酸和ATP等必要的生存物質,使肝臟細胞在經歷I/R時更容易適應缺血和缺氧,從而減輕組織損傷。自噬能力受損或自噬小體數量不足是導致肝臟I/R損傷的關鍵機制之一[16]。LC3B-Ⅱ存在于自噬小體膜上,其表達增多使吞噬泡膜伸長并誘導出現自噬小體。自噬小體進一步與溶酶體融合產生自噬性溶酶體,降解攝入的細胞內容物[17]。p62是一種泛素結合蛋白,能與自噬體膜蛋白結合,使得含有p62的蛋白聚集物能被結合至自噬小體上被分解[18,19]。本研究在恢復再灌注6 h時,西羅莫司干預組小鼠肝組織LC3B-Ⅱ和P62蛋白表達水平較模型組顯著升高。透射電鏡檢測自噬小體發現,西羅莫司預處理可誘導小鼠肝細胞自噬小體的產生。

