不同超濾率對糖尿病腎病患者維持性血液透析中低血壓及心血管死亡發生率影響
焦占峰, 張宜明, 馬小芬, 李 相, 張 晶, 李 洋, 王亞芬
濟寧醫學院附屬醫院1.腎內科;2.消化內科,山東 濟寧 272029
糖尿病腎病(diabetic nephropathy,DN)是由糖尿病微血管病變導致的以糖尿病性腎小球硬化癥為主要特點的腎病,隨著病情加重,腎功能持續惡化[1]。維持性血液透析(maintenance hemodialysis,MHD)是改善DN患者生活質量、延長存活時間的主要保守方案[2-3]。低血壓是MHD中的常見并發癥,不僅影響透析順利進行,還可能導致透析血流量減少,進而降低透析充分性[4-5]。超濾率(ultrafiltration rate,UFR)是指在透析過程中體內水分被移出體外的速率。有研究認為,不同UFR造成的血流動力學改變可能對心血管系統的安全性產生影響[6]。本研究旨在探討不同UFR對DN患者MHD中低血壓及心血管死亡發生率的影響。現報道如下。
1 資料與方法
1.1 一般資料 選取濟寧醫學院附屬醫院自2018年1月至2020年1月收治的接受MHD治療的228例DN患者為研究對象。納入標準:符合DN診斷標準[7];透析時間>3個月;年齡≥18歲;透析開始前3個月內無外科手術史;規律接受治療及檢查。排除標準:既往明確心臟病史;合并嚴重肝肺疾病;合并急慢性感染、惡性腫瘤;無法按照醫囑完成透析;妊娠或哺乳期女性。在透析開始后第91~120天計算患者UFR,公式:UFR=每次實際脫水量(ml)/[干體質量(kg)×每次透析時間(h)]。根據UFR三分位數法將患者分入低UFR組[UFR<7.82 ml/(kg·h),n=73]、中UFR組[7.82 ml/(kg·h)≤UFR<10.96 ml/(kg·h),n=77]、高UFR組[UFR≥10.96 ml/(kg·h),n=78]。低UFR組中,男性40例,女性33例,年齡43~78歲;中UFR組中,男性41例,女性36例,年齡41~78歲;高UFR組中,男性39例,女性39例,年齡38~76歲。3組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。患者及其家屬均簽署知情同意書。本研究經醫院倫理委員會批準。
1.2 MHD方法 患者均采用每周3次、單次3~4 h的透析方案。參數如下:透析血流量200~300 ml/min,透析液流量500 ml/min(碳酸氫鹽透析液),透析液溫度36~37℃,透析液鉀離子2.0 mmol/L、鈣離子1.5 mmol/L、鈉離子140.0 mmol/L。
1.3 隨訪及觀察指標 記錄患者的臨床資料,包括性別、年齡、體質量指數、透析時間、透析前血壓、透析前實驗室指標(全段甲狀旁腺激素、白蛋白、超敏C反應蛋白)等。收集患者入組后持續3個月MHD中低血壓發生情況。低血壓是指血液透析過程中動脈收縮壓下降≥20 mmHg(1 mmHg=0.133 kPa),或動脈收縮壓下降至90 mmHg及以下,患者可伴或不伴有低血壓癥狀。隨訪從患者透析第121天開始,截止至2021年1月1日或該日期前患者死亡當日。患者死亡原因以病例死亡診斷判定,死因為心肌梗死、惡性心律失常、充血性心力衰竭、死亡歸于心血管死亡組,其余歸于非心血管死亡組。
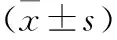
2 結果
2.1 低、中、高UFR組低血壓和心血管死亡發生率比較 228例患者中,發生低血壓83例(36.4%)。低、中、高UFR組低血壓發生率分別為23.3%(17/73)、24.7%(19/77)、60.3%(47/78),低、中UFR組的低血壓發生率均低于高UFR組,差異有統計學意義(P<0.05)。隨訪期間共死亡40例,死因依次為心血管疾病20例、營養不良12例、感染5例、其他3例,即20例死因為心血管疾病的患者為心血管死亡組,其余208例患者為非心血管死亡組。低、中、高UFR組心血管死亡發生率分別為4.1%(3/73)、6.5%(5/77)、15.4%(12/78),低、中UFR組的心血管死亡發生率均低于高UFR組,差異有統計學意義(P<0.05)。
2.2 低、中、高UFR組生存情況比較 低、中UFR組總存活率高于高UFR組,差異有統計學意義(P<0.05)。見圖1。

圖1 低、中、高UFR組生存情況比較
2.3 心血管死亡單因素分析 心血管死亡組和非心血管死亡組透析時間、超敏C反應蛋白水平、透析中低血壓發生率、UFR分布比較,差異有統計學意義(P<0.05)。見表1。

表1 心血管死亡單因素分析/例(百分率/%)
2.4 心血管死亡多因素分析 透析時間長、高超敏C反應蛋白水平、低血壓、高UFR是接受MHD的DN患者心血管死亡的獨立危險因素(P<0.05)。見表2。

表2 心血管死亡多因素分析
3 討論
UFR升高會增加MHD患者的病死率,這可能與過快的超濾會增加各個臟器負荷并導致其功能損傷相關[8-9]。心血管死亡是MHD最嚴重的并發癥之一,也是MHD的首要死因,其機制為MHD中因血流動力學改變而引起心臟組織缺血及后續低血壓、心律失常、心臟重塑等嚴重結局出現[10-11]。UFR是導致MHD患者血流動力學變化的主要因素。本研究結果顯示:低、中、高UFR組低血壓發生率分別為23.3%(17/73)、24.7%(19/77)、60.3%(47/78),低、中UFR組的低血壓發生率均低于高UFR組,差異有統計學意義(P<0.05)。低血壓可導致MHD患者殘余腎功能進一步減退,是各種心血管并發癥的促發因素。多項研究表明,持續MHD中頻繁出現低血壓的患者透析效果較差,遠期死亡風險高于未出現低血壓的患者[12-13]。有效血容量減少也是低血壓發生的常見原因,而高UFR狀態會使人體血液短時間內進入外循環,減少有效循環容量,導致低血壓出現。
本研究結果還顯示:低、中、高UFR組心血管死亡發生率分別為4.1%(3/73)、6.5%(5/77)、15.4%(12/78),低、中UFR組的心血管死亡發生率均低于高UFR組,差異有統計學意義(P<0.05);低、中UFR組總存活率高于高UFR組,差異有統計學意義(P<0.05)。這提示,高UFR可對MHD患者的生存狀況產生負面影響。其可能機制為高UFR引起血流動力學波動增加,低血壓等的出現會導致患者心肌缺血,并最終誘發心臟重塑,破壞心臟循環功能,為心血管死亡事件發生奠定基礎[14-15]。本研究中,Cox回歸模型分析發現,低血壓、高UFR是接受MHD的DN患者心血管死亡的獨立危險因素(P<0.05)。高UFR雖可短時間內迅速清除體內代謝廢物,但由于循環體液迅速增加和減少,會導致患者血壓波動大,心肌缺血風險上升,長此以往,患者嚴重心臟并發癥死亡風險也上升。透析時間長、高超敏C反應蛋白水平也是接受MHD的DN患者心血管死亡的獨立危險因素(P<0.05)。張楠等[16]研究認為,MHD患者處于不同程度的全身炎癥狀態,隨著透析時間延長,炎癥反應逐步加劇,超敏C反應蛋白等炎癥指標對患者心血管并發癥的發生具有監測作用。
綜上所述,高UFR會增加DN患者MHD中低血壓的發生風險,高UFR、低血壓是接受MHD的DN患者發生心血管死亡事件的獨立危險因素。在MHD開展過程中,臨床醫師應增加對UFR選擇合理性的關注,監測低血壓的出現,積極降低心血管死亡發生率。

