損傷控制性復(fù)蘇對低溫環(huán)境下失血性休克豬凝血功能影響
曹惠鵑, 孫 佳, 張鐵錚, 刁玉剛, 葉 敏, 杜 薇
北部戰(zhàn)區(qū)總醫(yī)院 麻醉科,遼寧 沈陽 110016
嚴(yán)重創(chuàng)傷合并失血性休克(hemorrhagic shock,HS)救治的難點(diǎn)問題為“死亡三角”,即凝血異常、代謝性酸中毒、低體溫[1],三者相互影響,形成惡性循環(huán),為創(chuàng)傷合并HS患者的首要死因[2]。低溫環(huán)境下出現(xiàn)的HS患者早期就已經(jīng)處于低體溫狀態(tài),會進(jìn)一步加重代謝性酸中毒與凝血機(jī)制異常。損傷控制性復(fù)蘇(damage control resuscitation,DCR)是以大出血創(chuàng)傷患者為治療靶點(diǎn)的復(fù)蘇新策略,可顯著降低創(chuàng)傷合并休克患者的出血、酸中毒、凝血障礙,并提高患者的存活率[3-4]。DCR這一復(fù)蘇新策略對低溫HS豬凝血功能的影響尚不清楚。本研究通過建立低溫豬容量控制性HS模型,使用血栓彈力圖(thromboelastography,TEG)測試不同時間點(diǎn)的凝血參數(shù),旨在探討DCR對低溫HS豬凝血功能的影響。現(xiàn)報道如下。
1 材料與方法
1.1 實(shí)驗(yàn)動物分組 雄性清潔級巴馬小型豬18頭,體質(zhì)量 20~24 kg,3~5個月齡。采用隨機(jī)數(shù)字表法將其分為HS組、低溫醋酸鈉林格氏液(acetated Ringer′s solution,AR)組(AR組)、DCR組,每組各6頭。
1.2 實(shí)驗(yàn)準(zhǔn)備及麻醉 實(shí)驗(yàn)前12 h,禁食、不禁水,皮膚清潔處理,術(shù)區(qū)備皮。取仰臥位四肢固定,耳緣靜脈穿刺,滴注0.9%生理鹽水。每頭豬緩慢靜脈注射丙泊酚 3.0 mg/kg。待實(shí)驗(yàn)動物呼吸減慢,肢體活動逐漸消失,角膜反射逐漸消失時,迅速進(jìn)行氣管內(nèi)插管。氣管插管后行機(jī)械通氣,呼吸頻率 14~16 次/min,潮氣量 8~10 ml/kg,吸呼比1∶2,吸入氧濃度60%,呼氣末二氧化碳維持在 35~45 mmHg(1 mmHg=0.133 kPa)。持續(xù)吸入2%異氟烷維持麻醉,根據(jù)手術(shù)需要追加維庫溴銨0.04 mg/kg。無菌條件下,0.5%利多卡因浸潤麻醉分離左側(cè)股動脈并置管,用于監(jiān)測有創(chuàng)動脈血壓。右側(cè)股動脈穿刺置管,用于放血。左側(cè)股靜脈穿刺置管,用于采集血樣。右側(cè)股靜脈穿刺置管,用于復(fù)蘇時液體輸注。右側(cè)頸靜脈置肺動脈漂浮導(dǎo)管,用于監(jiān)測肺動脈溫度。穿刺結(jié)束后固定、縫合皮膚切口。
1.3 HS模型的建立 動靜脈穿刺完成穩(wěn)定1 h后,3組均以改良容量控制法制備HS模型[5],放出的血液經(jīng)抗凝后收集,待容量復(fù)蘇時回輸。造模成功后,分別輸入醋酸林格氏液和自體全血,維持收縮壓在90 mmHg(平均動脈壓50 mmHg)左右,脈壓≥30 mmHg,尿量≥0.5 ml/(kg·h)。將穿刺成功的巴馬小型豬置于-5℃~0℃冰柜中,在冰柜中穩(wěn)定45 min后開始實(shí)驗(yàn),直至實(shí)驗(yàn)結(jié)束移出冰柜。
1.4 樣本采集 分別于放血前(T0)、休克后1 h(T1)及復(fù)蘇后1 h(T2),采集3組股靜脈血檢測各時間點(diǎn)TEG指標(biāo),包括R值、K值、α角、血栓最大幅度(maximum amplitude,MA)值、凝血綜合指數(shù)(clotting index,CI)值、半小時纖溶率(lysis at 30 minutes,LY30)。
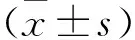
2 結(jié)果
2.1 3組一般資料比較 3組體質(zhì)量、身長、放血量、體表面積比較,差異均無統(tǒng)計學(xué)意義(P>0.05)。AR組、DCR組輸液量均多于HS組,AR組輸液量多于DCR組,差異均有統(tǒng)計學(xué)意義(P<0.05)。見表1。
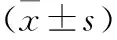
表1 各組一般資料比較
2.2 3組不同時間點(diǎn)R值比較 3組T1時的R值均高于T0時,差異均有統(tǒng)計學(xué)意義(P<0.05)。與HS組比較,AR組T2時的R值升高,DCR組T2時的R值降低,差異均有統(tǒng)計學(xué)意義(P<0.05)。DCR組T2時的R值低于AR組,差異有統(tǒng)計學(xué)意義(P<0.05)。見表2。

表2 3組不同時間點(diǎn)R值比較
2.3 3組不同時間點(diǎn)K值比較 3組T1時的K值均高于T0時,差異均有統(tǒng)計學(xué)意義(P<0.05)。與HS組比較,AR組T2時的K值升高,DCR組T2時的K值降低,差異均有統(tǒng)計學(xué)意義(P<0.05)。DCR組T2時的K值低于AR組,差異有統(tǒng)計學(xué)意義(P<0.05)。見表3。

表3 3組不同時間點(diǎn)K值比較
2.4 3組不同時間點(diǎn)α角比較 3組T1時的α角均小于T0時,差異均有統(tǒng)計學(xué)意義(P<0.05)。與HS組比較,AR組、DCR組T2時的α角均變大,差異均有統(tǒng)計學(xué)意義(P<0.05)。DCR組T2時的α角大于AR組,差異有統(tǒng)計學(xué)意義(P<0.05)。見表4。

表4 3組不同時間點(diǎn)α角比較角度/°)
2.5 3組不同時間點(diǎn)MA值比較 3組T1時的MA值均低于T0時,差異均有統(tǒng)計學(xué)意義(P<0.05)。與HS組比較,AR組、DCR組T2時的MA值均升高,差異均有統(tǒng)計學(xué)意義(P<0.05)。DCR組于T2時的MA值高于AR組,差異有統(tǒng)計學(xué)意義(P<0.05)。見表5。

表5 3組不同時間點(diǎn)MA值比較
2.6 3組不同時間點(diǎn)CI值比較 3組T1時的CI值均低于T0時,差異均有統(tǒng)計學(xué)意義(P<0.05)。與HS組比較,AR組、DCR組T2時的CI值均升高,差異均有統(tǒng)計學(xué)意義(P<0.05)。DCR組于T2時的CI值高于AR組,差異有統(tǒng)計學(xué)意義(P<0.05)。見表6。
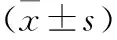
表6 3組不同時間點(diǎn)CI值比較
2.7 3組不同時間點(diǎn)LY30比較 3組T1時的LY30略低于T0時,但差異無統(tǒng)計學(xué)意義(P>0.05);3組T2時的LY30值高于T0時,差異有統(tǒng)計學(xué)意義(P<0.05)。與HS組比較,AR組、DCR組T2時的LY30值均降低,差異均有統(tǒng)計學(xué)意義(P<0.05)。DCR組于T2時的LY30值低于AR組,差異有統(tǒng)計學(xué)意義(P<0.05)。見表7。
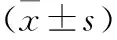
表7 3組不同時間點(diǎn)LY30比較
3 討論
低溫會抑制凝血因子,減少血小板的數(shù)量,抑制血小板功能,激活纖溶系統(tǒng),加重患者的凝血功能紊亂,導(dǎo)致止血困難,病死率顯著升高[6-7]。TEG動態(tài)分析血塊形成到纖維蛋白溶解的全過程,是以細(xì)胞學(xué)為基礎(chǔ)的凝血檢測模式,用微量全血監(jiān)測包括凝血因子綜合作用(R值)、凝血酶和纖維蛋白的形成速度(K值、α角)、纖維蛋白溶解的狀態(tài)(LY30)、所形成血凝塊的堅(jiān)固性即纖維蛋白原和血小板功能(MA),以及總的凝血情況(CI)等指標(biāo)反映機(jī)體的凝血功能[8-9]。
本研究結(jié)果顯示,低溫環(huán)境下,巴馬小型豬TEG中的R值、K值升高,α角、MA值、CI值降低,LY30早期變化不大,然后升高。由此可見,低溫環(huán)境下HS豬凝血功能的變化特征為凝血因子缺乏、凝血酶活性減弱、纖維蛋白原消耗增加、血小板功能減弱、纖溶功能增強(qiáng)。實(shí)施DCR有助于改善凝血功能和纖溶功能,對血小板功能具有改善作用,與Watts等[10]研究結(jié)果一致。在一定溫度范圍內(nèi),低溫和凝血功能之間存在劑量反應(yīng)關(guān)系,溫度越低,對凝血功能的影響越大。這說明,溫度對嚴(yán)重創(chuàng)傷患者凝血功能具有很大影響。因此,在臨床上監(jiān)測嚴(yán)重創(chuàng)傷患者的凝血功能時,必須考慮體溫因素的影響。臨床上對已經(jīng)出現(xiàn)凝血功能障礙的嚴(yán)重創(chuàng)傷患者,尤其需要更積極地給予保暖/復(fù)溫措施,從而改善患者的凝血功能。
綜上所述,低溫環(huán)境下HS豬凝血功能的變化特征為凝血因子缺乏、凝血酶活性減弱、纖維蛋白原消耗增加、血小板功能減弱、纖溶功能增強(qiáng)。低溫環(huán)境下HS實(shí)施DCR對凝血功能影響的特征是主要改善凝血因子活性和纖維蛋白原功能,對血小板功能具有改善作用。本研究還存在一定的局限性:豬的凝血系統(tǒng)比人易激活,這可能會影響本研究結(jié)果在人低溫HS的具體救治中的應(yīng)用;本研究的HS模型通過放血建成,與臨床上不受控制的出血不完全相同。

