UPLC-MS/MS同時測定特殊醫學用途配方食品中8種真菌毒素
李莉,李碩
(中國食品藥品檢定研究院,北京100050)
0 引言
特殊醫學用途配方食品由于食用人群的特殊性[1],質量安全問題一直受到消費者的高度關注。黃曲霉毒素、赭曲霉毒素和雜色曲霉素等真菌毒素,對人體具有潛在的致癌性[2],如果產品原料質量和生產環節把控不嚴格,就有可能造成終產品被真菌毒素污染。目前食品中真菌毒素的檢測方法主要有酶聯免疫吸附法[3-6]、高效液相色譜法[7-10]、液質譜聯用法[11-15]。液質聯用和快速樣品前處理技術的聯合應用[16-19],具有高靈敏度和優異的選擇性,應用優勢日益突出。本文建立了直接通過式固相萃取結合UPLC-MS/MS技術檢測特殊醫學用途配方食品中8種真菌毒素的方法,該方法簡便快速,可操作性強,可以實現特殊醫學用途配方食品中多種黃曲霉毒素的同時快速篩查。
1 材料與方法
1.1 儀器與試劑
LCMS-8060型超高效液相色譜-三重四級桿串聯質譜儀,日本島津公司;AL 204型分析天平,瑞士梅特勒-托利多公司;超聲波清洗器,江蘇昆山市超聲儀器有限公司;渦旋混勻器,美國Scientific Industries公司;CF 16RXII離心機,日本日立公司;MG-2200氮吹儀,日本東京理化公司;超純水純化系統,德國賽多利斯公司。黃曲霉毒素B1(aflatoxin B1,AFB1)、黃曲霉毒素B2(aflatoxin B2,AFB2)、黃曲霉毒素G1(aflatoxin G1,AFG1)、黃曲霉毒素G2(aflatoxin G2,AFG2)、黃曲霉毒素M1(aflatoxin M1,AFM 1)、黃曲霉毒素M2(aflatoxin M2,AFM 2)混合標準溶液(10μg/mL),青島普瑞邦公司;雜色曲霉素(Sterigmatocystin,ST)標準溶液(50μg/mL),青島普瑞邦公司;赭曲霉毒素A(Ochratoxin A,OTA)標準溶液(10μg/mL),青島普瑞邦公司;乙腈(色譜純),德國默克公司;甲酸(質譜級),Fisher Scientific公司;Captiva EMR-Lipid萃取管(3 mL),Agilent公司;ISOLUTE Myco固相萃取柱(3 mL),Biotage公司;MPFC-QuEChERS超濾型凈化柱(高脂類),北京綠綿科技有限公司;實驗用水均為超純水;特殊醫學用途配方食品,市售。
1.2 標準溶液配制
分別準確移取AFB1、AFB2、AFG1、AFG2、AFM 1、AFM 2混合標準溶液2 mL,ST標準溶液0.2 m L,OTA標準溶液1 mL置于10 mL棕色容量瓶中,用乙腈定容至刻度,配制成AFB1、AFB2、AFG1、AFG2、AFM 1、AFM 2質量濃度為2μg/mL、OTA和ST質量濃度為1μg/mL的混合標準儲備溶液,-20℃避光保存。臨用時以空白基質提取液將上述標準溶液稀釋為系列混合標準工作液。
1.3 樣品前處理
1.3.1 樣品的提取
精密稱取2.5 g(精確至0.001 g)樣品于50 mL具塞離心管中(對于加標樣品,加入所需體積的標準溶液),加入20 mL乙腈-水(80∶20,v/v)提取溶液,旋渦混勻30 s,室溫下超聲提取30 min,隨后經8000 r/min離心5 min,取上清液待凈化。
1.3.2 樣品的凈化
移取上清液2 mL至Captiva EMR-Lipid萃取管,保持每秒1滴的流速,收集全部流出液,氮氣吹干。用0.5 mL乙腈-水溶液(50∶50,v/v)復溶,渦旋混合1 min,過0.22μm聚四氟乙烯微孔濾膜,作為待測溶液。
1.4 儀器條件
1.4.1 色譜條件
色譜柱:Aglient Infinity Poroshell 120 SB-C18(100 mm×2.1 mm,2.7μm);流動相A:A為含有0.1%甲酸的水溶液,B為含有0.1%甲酸的乙腈溶液,梯度洗脫,流速為0.3 mL/min,柱溫:40℃,洗脫程序:0~1 min,10%~20%B;1~9 min,20%~40%B;9~10 min,40%~95%B;10~14 min,95%B;14~16 min,10%B。進樣量為5μL。
1.4.2 質譜條件
離子源:電噴霧離子源(ESI);掃描模式:正離子模式;檢測方式:多反應監測(MRM)模式;霧化氣流量3 L/min,干燥氣流量10 L/min,加熱氣流量10 L/min,DL管溫度250℃,加熱塊溫度400℃,接口溫度300℃,接口電壓4.0 k V。其他質譜參數如表1所示。

表1 各化合物質譜參數
2 結果與討論
2.1 質譜條件優化
使用各化合物質量濃度為100 ng/mL標準儲備液,在ESI離子源條件下采用直接進樣的方式分別進行正負離子掃描。實驗結果表明8種化合物均在正離子模式下有更好的響應,因此選擇ESI+模式。根據目標化合物的[M+H]+母離子,在多反應監測條件下進一步優化質譜條件,選擇響應最強的2個子離子,得到使子離子響應最優的三重四級桿Q 1和Q 2的電壓以及碰撞能。最終確定的質譜多反應監測條件參數如表1所示。
2.2 色譜條件優化
由于8種真菌毒素是極性或者弱極性化合物,常用選用C18色譜柱,水與乙腈或甲醇混合作為流動相進行色譜分離。流動相中添加甲酸可提高目標化合物的離子化效率,提高質譜檢測的靈敏度。本研究對比了Aglient Poroshell 120 SB-C18柱(2.1 mm×100 mm,2.7μm)、Waters BEH C18柱(2.1 mm×100 mm,1.7μm)、Waters HSS T 3(2.1 mm×100 mm,1.8μm)柱在以0.1%甲酸水溶液和0.1%甲酸乙腈為流動相時的分離效果,發現Aglient Poroshell 120 SB-C18柱更適合8種真菌毒素的快速分析,該柱填充2.7μm實心C18填料,其中實心內核為1.7μm,多孔外層為0.5μm,多孔外層和實心內核限制了擴散,提高了分離速度,而窄粒徑分布則提高了柱效和分離度,從而得到更好的分離效果和色譜峰峰型。8種真菌毒素總離子流色譜如圖1所示。

圖1 8種真菌毒素總離子流色譜
2.3 提取溶劑的選擇
根據文獻報道,黃曲霉毒素、雜色曲霉素和赭曲霉毒素常用的提取溶劑為乙腈或甲醇,在乙腈或甲醇中加入適量的水能夠促進溶劑滲透到基質內部,提高真菌毒素的提取效率。此外,乙腈比甲醇具有較強的蛋白沉淀能力,當樣品基質中蛋白質含量較多時,選取乙腈-水的混合溶液作為提取溶劑效果更好。因此,本研究以特殊醫學用途嬰兒配方食品為樣品,通過空白基質加標的方式,考察60%乙腈水溶液、70%乙腈水溶液、80%乙腈水溶液和90%乙腈水溶液作為提取溶劑對于待測化合物回收率的影響,結果如圖2所示。由圖2可以看出,使用80%乙腈水溶液作為提取劑時8種真菌毒素的加標的回收率結果在64%~89%之間,可以滿足實驗要求。
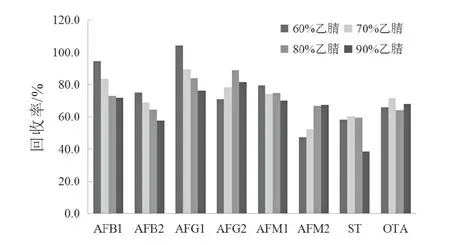
圖2 不同提取溶液對8種真菌毒素回收率的影響
2.4 樣品凈化方法的選擇
特殊醫學用途配方食品中蛋白質、脂類和糖類等物質含量較高,是影響質譜測定靈敏度的主要干擾基質,因此必須通過適當的凈化方法加以去除。目前常用的復雜樣品中真菌毒素的凈化方法有免疫親和柱法、SPE、QuEChERS技術等,其中免疫親和柱價格昂貴,且只適用于單一或特定的化合物類別或樣品類型,不適合多種毒素的同時測定。本實驗對常規SPE凈化柱(ISOLUTE Myco)、直接通過式凈化柱(EMR-Lipid萃取管)和QuEChERS凈化技術(MPFC-QuEChERS)3種不同凈化方法的凈化效果進行了評價,實驗結果見圖3。分析實驗結果可以發現,QuEChERS方法能夠高效、快速的萃取多類別的化合物,但同時也會萃取出大量基質(尤其是脂質),從而導致雜色曲霉素和赭曲霉毒素A基質效應明顯、回收率偏低。常規的SPE凈化方法對于黃曲霉毒素類化合物的凈化效果要優于直接通過式凈化柱和QuECh-ERS方法,但是操作上需經過活化、上樣洗脫和淋洗等多個步驟,操作繁瑣,且個別目標物的加標回收率過低,不適用復雜樣品的快速分析。EMR-Lipid萃取管雖然對于黃曲霉毒素類物質的加標回收率不如其他兩種凈化方法,但是對于雜色曲霉素和赭曲霉毒素A的加標回收率要優于其他兩種凈化方法,綜合考慮8種目標化合物的結果,EMR-Lipid萃取管凈化方法的加標回收率均>60%,滿足實驗要求[19]。此外直接通過式凈化柱無需活化、洗脫和淋洗,可大大縮短凈化時間,因此選擇EMR-Lipid萃取管作為樣品前處理的凈化方法。

圖3 不同凈化方法對8種真菌毒素回收率的影響
2.5 方法研究及結果分析
2.5.1 線性范圍、回歸方程和檢出限
在質譜分析中,基質效應會嚴重影響痕量水平目標化合物定量分析的準確性[20]。為了補償基質效應對檢測結果帶來的影響,本研究采用基質匹配標準曲線進行目標化合物定量分析。將不含待測物的空白樣品按照1.3步驟進行處理得到空白基質溶液,用空白基質溶液稀釋混合標準儲備液得到系列濃度的基質加標溶液,上機測定。以8種真菌毒素的質量濃度(ng/mL)為橫坐標,定量離子峰面積為縱坐標,繪制標準曲線。計算目標化合物信號響應和噪聲的比值S/N,得到方法檢出限(limit of detections,LOD,S/N=3)和定量限(limit of quantifications,LOQ,S/N=10),結果如表2所示。6種黃曲霉毒素在0.5~20 ng/mL質量濃度范圍內、雜色曲霉素和赭曲霉素A在0.25~10 ng/mL質量濃度范圍內呈線性關系,線性相關系數r>0.992,8種真菌毒素的檢出限為0.06~2.1μg/kg,定量限為0.2~2.9μg/kg。
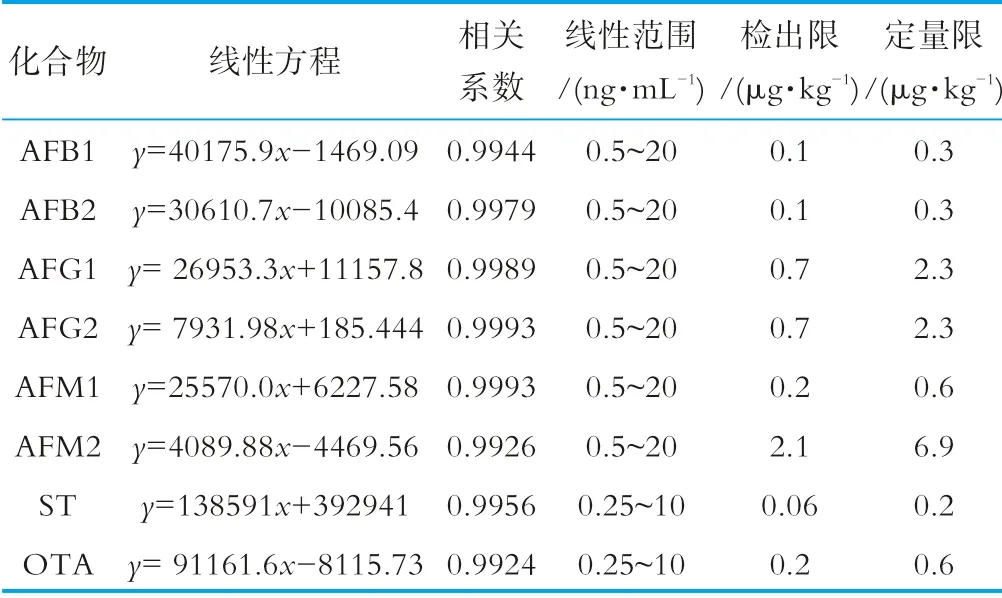
表2 8種真菌毒素的線性范圍、相關系數、檢出限和定量限
2.5.2 方法的回收率及精密度
向空白樣品添加低、中、高3個濃度水平的標準溶液進行加標回收試驗,按照方法給出的步驟進行樣品提取、凈化及上機檢測,計算目標化合物的加標回收率。每個加標濃度平行測定6份,用測定結果的相對標準偏差評價精密度(relative standard deviation,RSD)。回收率和精密度結果如表3所示。由表3可以看出,8種真菌毒素的平均回收率為92.2%~108.9%,RSD小于15%。
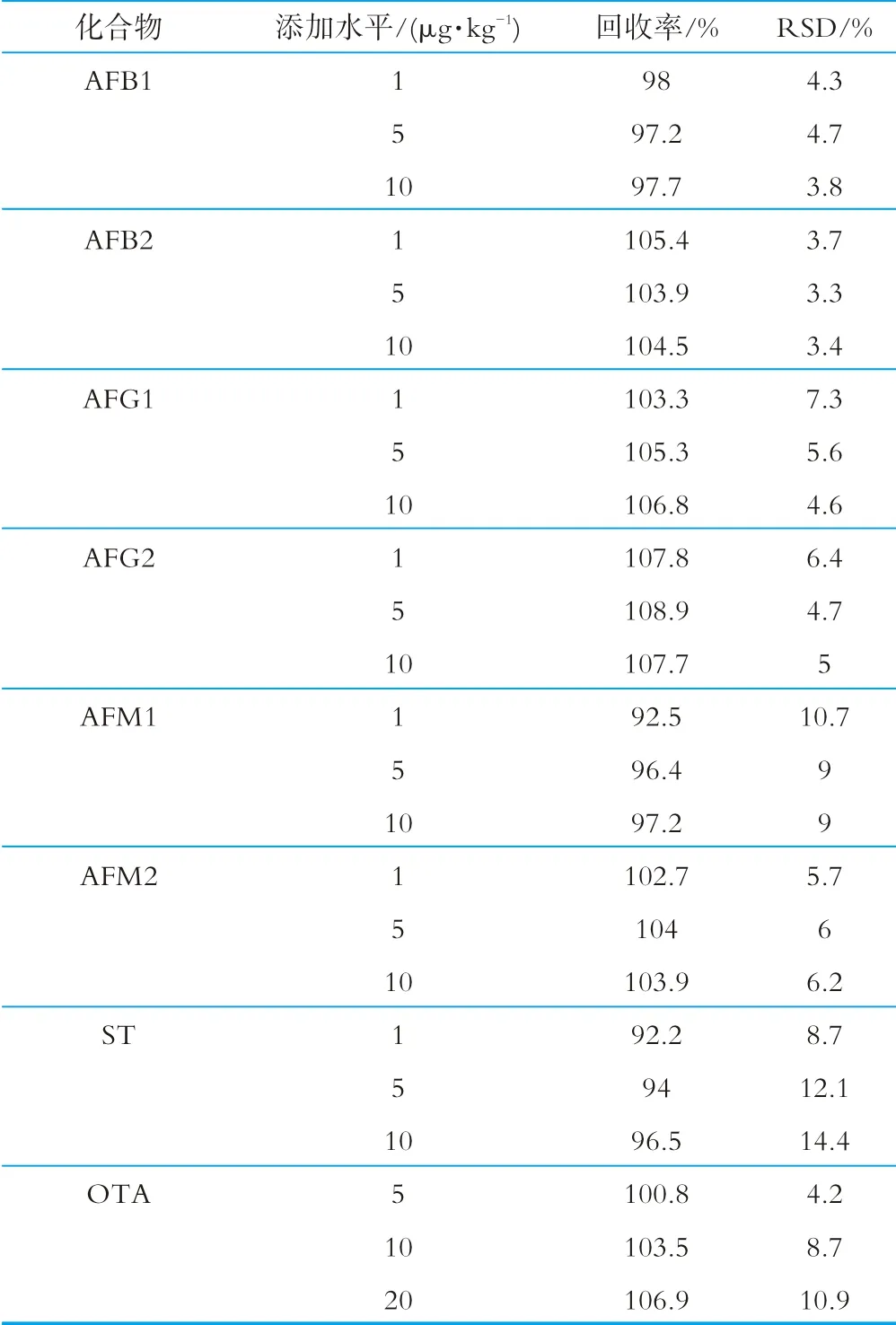
表3 回收率和精密度實驗結果(n=6)
2.5.3 實際樣品檢測
按照本實驗建立的方法對購自不同產地和廠家的15份特殊醫學用途配方食品進行檢測,15批樣品中均未檢出8種真菌毒素。
3 結 論
本研究建立了采用新型固相萃取前處理方法結合液相色譜質譜聯用檢測技術同時測定特殊醫學用途配方食品中多種類真菌毒素的快速篩查方法。直接通過式EMR-Lipid萃取管省去了常規萃取柱活化、洗脫和淋洗的步驟,可大大縮短凈化時間,提高檢測的效率,可以實現批量樣品的快速檢測。該方法簡化了分析步驟,操作簡便快捷,同時具有良好的準確度和精密度,能滿足特殊醫學用途配方食品中真菌毒素污染水平的監測和產品質量控制工作的需要。

