Erastin誘導人非小細胞肺癌細胞系A549凋亡
姜學東,李文雅
(1.中國人民武裝警察部隊遼寧省總隊醫院 胸外科,遼寧 沈陽 110034;2.中國醫科大學附屬第一醫院 胸外科,遼寧 沈陽 110001)
肺癌(lung cancer)在全球范圍內是常見的惡性腫瘤之一,其中約85%患者為非小細胞肺癌(non-small cell lung cancer, NSCLC)[1]。人體正常生理功能受機體細胞程序性死亡調節,細胞死亡是維持機體內穩態,預防細胞癌變的重要過程。近來,新的研究發現一種非凋亡性細胞死亡——鐵死亡(ferroptosis),其特征是脂質過氧化物積累至致死水平而引起的膜損傷,是一種不同于凋亡、壞死及自噬的另外一種程序性細胞死亡形式[2-3];肺癌組織普遍有著更高的活性氧和脂質氧化標志物活性氧集團(reactive oxygen species, ROS)水平,提示ROS和鐵死亡在肺癌中發揮著關鍵作用[4-6]。眾多研究證實,鐵死亡與腫瘤[7]、心腦血管疾病[8]等疾病密切相關。
愛拉斯汀(erastin/sorafenib)是一種常用的鐵死亡誘導劑,通過抑制谷氨酸/胱氨酸反向轉運體xCT的活性,使細胞中半胱氨酸(cysteine,Cys)和谷胱甘肽(glutathione, GS-H)缺乏,進而破壞細胞氧化還原穩態, ROS堆積,進而導致鐵死亡的發生[9]。研究證實,小分子erastin介導細胞內ROS累積,誘導NSCLC細胞系N5CP鐵死亡,能有效抑制N5CP生長,提示erastin誘導的鐵死亡對NSCLC的化療有積極作用[6]。現已明確ROS可以通過引起細胞損傷,但erastin引起的ROS堆積除了誘導鐵死亡外,是否還可調節細胞凋亡尚不明確。本研究就erastin引發肺癌細胞A549的損傷和凋亡機制進行探討,確定erastin的抑癌作用,以期為肺癌的治療尋找新的思路。
1 材料與方法
1.1 材料
人非小細胞肺癌細胞系A549(成都飛鷗爾生物科技有限公司);細胞培養基RPMI1640和凋亡抑制劑(Z-VAD-FMK)(Life Technologies, Thermo Fisher Scientific公司);Erastin、staurasporine、N -乙酰基-L-半胱氨酸(N-acetyl-L-cysteine, NAC)、CCK-8試劑盒、annexin V-FITC/PI雙染試劑盒和CFSE/PI雙染試劑盒(Sigma-Aldrich, Merck公司);鐵(Fe)含量檢測試劑盒(Biovision公司);ROS活性氧檢測試劑盒(北京百奧萊博科技有限公司)。
1.2 方法
1.2.1細胞的分組及處理:培養A549細胞,制備A549細胞懸浮液,調節濃度至1×106細胞/mL,分為對照組(mock組)和處理組(erastin處理/erastin+Z-VAD-FMK/erastin+NAC)。
1.2.2 CCK-8法分析細胞活力:將細胞濃度調節至1×106細胞/mL。將細胞按5 000個/孔接種于96孔平板中,貼壁過夜。在每孔中加入不同濃度的erastin (0.1、1、2、4、6、8、10 μmol/L)。處理24 h后,加入CCK-8反應液,避光37 ℃下培養4 h。用分光光度計讀取A450 nm的吸光度值。
1.2.3 鐵(Fe)含量檢測試劑盒檢測鐵含量:用不含EDTA的胰蛋白酶重懸細胞,收集1×108個細胞,調整細胞濃度至1×107個/mL,加入0.2 μL Calcein-Am熒光探針,并將細胞放在37 ℃培養箱中繼續孵育7 min。孵育結束后,用Hank’s平衡緩沖液沖洗細胞3次,并往體系中加入錐蟲藍(trypan blue)(0.25%終濃度),室溫孵育1 min以確定細胞存活率。最后,在488 nm的激發波長和517 nm 的發射波長下測量染色熒光信號。
1.2.4 活性氧檢測試劑盒定量分析過氧化物ROS:細胞與羧基-H2DCFDA共培養30 min,去掉培養基,用預冷磷酸鹽緩沖液(PBS)清洗2次。用X71(U-RFL-T)熒光顯微鏡拍攝綠色熒光信號,并用Image J軟件進行定量分析。
1.2.5 流式細胞測量術分析細胞凋亡:用annexin V-FITC/PI雙重染色法對1×106個細胞進行染色,避光孵育20 min。然后,用預冷PBS清洗細胞3次,加入終濃度1%多聚甲醛PBS并在冰上放置10 min。應用3種激光導航流式細胞儀(Beckman Coulter)定量分析壞死(propidine iodide, PI 陽性)、非凋亡(雙陰性)、早期凋亡(annexin V-FITC陽性和PI陰性)和晚期凋亡細胞(雙陽性)。
1.2.6 免疫印跡(Western blot)檢測相關剪切蛋白:用10%十二烷基硫酸鈉-聚丙烯酰胺凝膠(SDS-PAGE)對20 μg總蛋白進行分離,并將免疫印跡轉移到硝酸纖維素(PVDF)上,用含5%牛血清白蛋白的PBS (BSA, Sigma-Aldrich, Merck)封閉。將抗體按1∶1 000比例稀釋,加入到PVDF膜上室溫孵育1 h。用預冷的T-PBS清洗PVDF膜,然后用1∶5 000稀釋的辣根過氧化物酶(horse radish peroxidase, HRP)偶聯抗兔二抗與PVDF膜室溫孵育30 min。經過3次T-PBS清洗后,用X線片曝光。
1.2.7 CFSE/PI雙染色檢測細胞凋亡:在erastin處理A549細胞的同時加入ROS清除劑NAC,共同處理后用CFSE/PI雙染檢測,檢測過程為:將1×106個細胞接種于6個孔板中,并貼壁過夜。加入100 μL CFSE熒光染料, 在37 ℃下培養15 min。去除上清液,用無菌培養基清洗細胞去除殘留的CFSE。Erastin處理細胞后,加入5 μg/mL的PI室溫孵育10 min,去除上清液,用無菌培養基清洗細胞去除殘留的PI。最后,用X71熒光顯微鏡拍攝熒光照片。
1.3 統計學分析
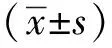
2 結果
2.1 Erastin誘導A549細胞損傷
隨著erastin濃度增加,A549細胞活力降低(圖1A)(P<0.05);10 μmol/L erastin處理A549細胞24 h后引起了鐵凋亡的典型表型:鐵離子含量大量升高(圖1B)(P<0.05),并產生大量過氧化物(圖1C)(P<0.05);PI染色陽性細胞(死亡細胞)比率顯著升高(圖1D)(P<0.05)。
2.2 Erastin誘導A549細胞凋亡
凋亡抑制劑Z-VAD-FMK以不可逆的形式與活化的半胱氨酸蛋白酶caspases結合,從而阻斷細胞凋亡。加入Z-VAD-FMK后,erastin引起的A549細胞凋亡減少(圖2A);活化型半胱氨酸天冬氨酸蛋白酶-3(cleaved-caspase-3)和cleaved-caspase-9表達量減少(圖2B)。
2.3 Erastin引起ROS增加誘導細胞凋亡
Annexin V-FITC/PI雙染顯示,erastin組A549細胞凋亡率增加,而erastin/NAC組A549凋亡率降低(圖3)。

A.CCK-8 kit was used to detect the inhibitory rate of A549 cells treated with different concentrations of erastin; B.A549 cells were treated with 10 μmol/L erastin for different time (0, 12 and 24 hours) to detect the content of iron, *P<0.05 compared with 0 hour; C.ROS content was analyzed after A549 cells were treated with 10 μmol/L erastin for different time (0, 12 and 24 hours),*P<0.05 compared with 0 hour, #P<0.05 compared with 0 hour; D.the ratio of dead cells was detected by PI staining after A549 cells were treated with 10 μmol/L erastin or 10 μmol/L staurosporine for different time (0 and 12 hours), *P<0.05 compared with mock group; #P<0.05 compared with mock group
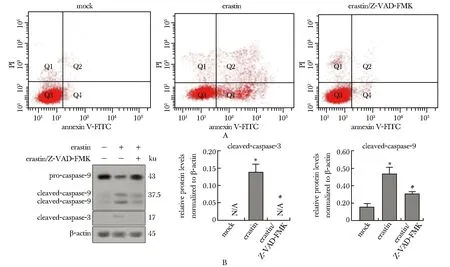
N/A.not applicable; A.A549 cells were treated with Z-VAD-FMK and erastin, and cells apoptosis were detected by annexin V-FITC/PI staining; B.Western blot was used to detect the splicing of caspase-9 related proteins in A549 cells after the addition of V-ZAD-FMK and erastin; *P<0.05 compared with mock group; #P<0.05 compared with erastin/Z-VAD-FMK group
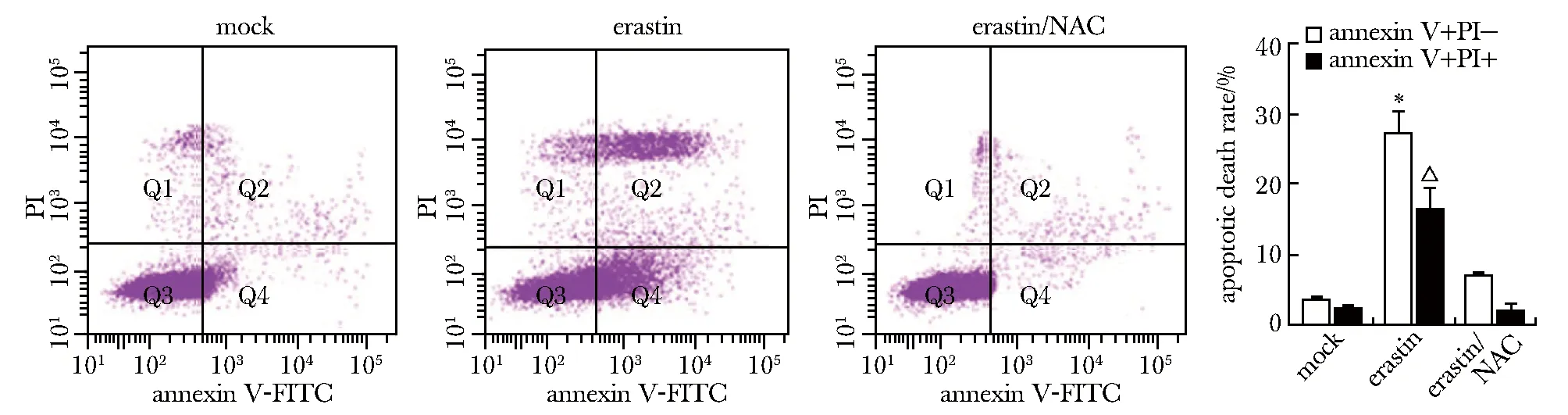
A549 cells were treated with NAC and erastin, and cells apoptosis were detected by annexin V-FITC/PI double staining; *P<0.05,△P<0.05 represent comparisons to mock groups, respectively
3 討論
細胞的凋亡與細胞內caspase激活和過度氧化有關[10]。Erastin是典型的鐵死亡誘導劑,通過引起ROS堆積而引起鐵死亡;同時,ROS通過細胞氧化應激反應誘導細胞凋亡,產生細胞毒性作用[11]。ROS、鐵死亡和細胞凋亡與肺癌的發病密切相關,但erastin引起肺癌細胞死亡的機制尚未明確。先前的研究表明,用erastin治療抗輻射細胞A549-R,通過誘導谷胱甘肽過氧化物酶4 (glutathion peroxidase 4, GPX4)介導的鐵蛋白作用,增強了A549-R的輻射敏感性,該研究證實erastin對非小細胞肺癌細胞A549具有輔助治療作用[12]。本研究通過檢測erastin處理A549細胞后細胞活力、鐵離子和ROC含量,證實erastin可誘導A549細胞損傷和凋亡。隨后,課題組通過研究凋亡抑制劑Z-VAD-FMK的干預,在erastin處理A549細胞后加入Z-VAD-FMK,發現細胞凋亡和活化型caspase-9和caspase-3蛋白含量均減少,證實erastin可誘導A549細胞凋亡;為了進一步論證erastin引起A549細胞凋亡的機制,本實驗又加入ROS清除劑N -乙酰基-L-半胱氨酸(N-acetyl-L-cysteine, NAC),證實erastin可使細胞內ROS產生增加從而誘導A549細胞凋亡。已有研究表明erastin引起ROS積累增加和p53激活,從而誘導非小細胞肺癌細胞系A549鐵死亡和細胞凋亡[13]。本研究結果先論證了erastin對非小細胞肺癌細胞系A549的正向殺傷和誘導凋亡的作用,然后論證其抑制A549作用的機制是通過增加細胞內ROS產生所致,這一結果與最新的國內外研究結果一致。
綜上所述,本研究證實erastin通過誘導非小細胞肺癌細胞內ROS產生,引起細胞凋亡,說明erastin對A549的細胞毒性作用同時來源于介導了鐵死亡和凋亡過程,并最終達到抗腫瘤作用。本研究實驗設計簡潔、嚴謹,為肺癌的發生機制的闡述提供了新的視角,為肺癌的治療尋找了潛在的靶點。

