二甲雙胍對阿爾茨海默病大鼠的療效及機制研究
王健蓉, 許 毅, 劉 斌, 劉奕杉
阿爾茨海默病(Alzheimer’s disease,AD)是老年人最為常見的神經(jīng)退行性疾病,因其明顯的大腦葡萄糖和能量代謝損傷,亦被稱為“3型糖尿病”[1]。而二甲雙胍是一種廣泛應用于2型糖尿病的治療藥物。由此我們推測,二甲雙胍在AD患者的治療中可能具有很大的潛力,而目前尚缺乏相關研究報道。
AD的典型病理特征是細胞外β淀粉樣蛋白(Amyloid β peptide,Aβ)沉積和神經(jīng)元胞漿中tau蛋白過度磷酸化導致的神經(jīng)元纖維纏結(jié)(Neurofibrillary Tangles,NFTs)[2]。 tau蛋白的磷酸化主要由糖原合成激酶3β(glycogen synthase kinase 3β,GSK3β)參與調(diào)控[3]。而GSK3β的活性又受磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B(Protein kinase B,PKB/AKT)的影響[4]。
本研究擬采用二甲雙胍對AD模型大鼠進行干預,通過Morris水迷宮和Western blot等方法,觀察該藥物對AD模型大鼠學習記憶能力的治療效果,并基于“PI3K-AKT-GSK3β-tau磷酸化”信號通路,探討二甲雙胍可能的作用機制,以期為AD患者尋找更為安全有效的臨床治療藥物。
1 材料與方法
1.1 實驗動物及分組 50只健康成年雄性SD大鼠(體質(zhì)量約240~280 g),均由成都達碩實驗動物有限公司提供,生產(chǎn)許可證號:SCXK(川)2020-030。全部大鼠飼養(yǎng)于自然光照的SPF級飼養(yǎng)室(溫度25 ℃,濕度60%~70%),自由進食、飲水。通過Morris水迷宮實驗測試,剔除掉可能天生癡呆及不會游泳的大鼠后(詳見1.3 動物模型制備),按照隨機數(shù)字表法將全部大鼠隨機分為正常組、假手術組、模型組和治療組,每組各12只。所有操作均遵循《關于善待實驗動物的指導性意見》的相關規(guī)定。
1.2 主要儀器與試劑 Morris水迷宮(RWD公司);酶標儀、低溫離心機(Thermo公司);電泳儀、電泳槽、凝膠成像儀(Bio-Rad公司);切片機、光學顯微鏡(Leica公司);Cell Sens Standard圖像采集系統(tǒng)(Olympus公司)。Aβ25-35(sigma公司);鹽酸二甲雙胍、Tween80(生工生物工程有限公司);蘇木素溶液、伊紅染色液(北京索萊寶科技有限公司);PI3K(P110α)、AKT、tau(phospho S202)以及tau5單克隆抗體(abcam公司);GSK3β、P-GSK3β(Ser9)、P-AKT(Ser473)單克隆抗體(CST公司);β-actin單克隆抗體(Bioworld Technology);山羊抗兔二抗、山羊抗鼠二抗(Earthox Life Science);蛋白酶抑制劑、RIPA裂解液、BCA蛋白濃度測定試劑盒(上海碧云天生物科技有限公司)。
1.3 動物模型制備 用生理鹽水稀釋Aβ25-35至2 g/L濃度,37 ℃水浴箱中孵育1 w后分裝為10 μl/管,于-20℃冰箱中保存。3%戊巴比妥鈉(30 mg/kg)腹腔注射深度麻醉大鼠后,按照腦立體定位圖譜對雙側(cè)海馬進行定位(前囟后4.1 mm,左右各旁開3 mm,深度4 mm)并鉆小孔,隨后用微量注射器給每側(cè)海馬緩慢注射5 μl Aβ25-35。術后3 d予以碘伏消毒傷口,并肌注青霉素G(10萬U)預防感染。參照先前研究[5]使用Morris水迷宮實驗對各造模后大鼠進行模型評價,其中平均逃避潛伏期及搜索路徑較正常組和假手術組明顯延長且空間探索實驗中跨越平臺次數(shù)明顯減少者,視為模型制備成功。假手術組:雙側(cè)海馬注射等量生理鹽水。
1.4 藥物制備及干預措施 藥物制備:將鹽酸二甲雙胍粉末用1% Tween 80溶解,4 ℃保存待用[6]。治療組大鼠造模成功后第2天,按照100 mg/(kg·d)給予二甲雙胍灌胃治療,連續(xù)給藥2 w。以上實驗操作,均由固定人員在固定時間內(nèi)進行。
1.5 實驗方法
1.5.1 Morris水迷宮實驗 二甲雙胍干預結(jié)束后次日,采用Morris水迷宮對各組大鼠學習和記憶能力進行評定。水迷宮直徑2 m,深度0.6 m,均分為4個象限,水中溫度保持在25 ℃。上方安置攝像機,與電腦圖像采集系統(tǒng)相連。(1)可視平臺實驗:第1~2天,平臺位于第Ⅲ象限中央水面上約0.5 cm,將各組大鼠按照編號從4個象限依次放入水中,每輪實驗間隔30 min。記錄1 min內(nèi)它們找到平臺的時間(逃避潛伏期)及搜索路徑。若超過1 min仍未找到平臺,其逃避潛伏期則記錄為1 min。(2)隱蔽平臺實驗:第3~6天,平臺位于第Ⅲ象限中央水面下約0.5 cm。其余與可視平臺實驗相同。(3)空間探索實驗:第7天,撤除平臺,同樣依次放入各組大鼠,記錄1 min內(nèi)各組大鼠穿越原平臺位置的次數(shù)。
1.5.2 標本采集 水迷宮實驗結(jié)束后,大鼠腹腔注射過量3%戊巴比妥鈉麻醉后,心尖灌注預冷的生理鹽水,完整剝離腦組織。一側(cè)放入4%多聚甲醛(4 g/100 ml)溶液中固定24 h~48 h;另一側(cè)剝離海馬組織后,稱重,用于提取蛋白。
1.5.3 蘇木素伊紅染色 將固定好后的組織塊梯度乙醇脫水,用石蠟包埋并作連續(xù)冠狀切片,厚度4 μm,常溫保存。二甲苯常規(guī)脫蠟,乙醇水化后,蘇木素常溫染核10 min,再用伊紅染色2 min,自來水沖洗反藍,隨后70%、80%、95%、100%梯度乙醇脫水,各3 min。二甲苯透明后中性樹膠封片,使用光鏡觀察并拍照分析。
1.5.4 Western blot 取50 μg總蛋白上樣,常規(guī)電泳電轉(zhuǎn)。并將轉(zhuǎn)印好的PVDF膜置于WB封閉液中37 ℃封閉2 h,隨后分別放入β-actin(1∶5000)、PI3K(1∶1000)、AKT(1∶10000)、P-AKT(1∶1000)、GSK3β(1∶1000)、P-GSK3β(1∶1000)、tau[pS202](1∶1000)、tau5(1∶1000) 等一抗孵育液中,4 ℃過夜。次日洗滌條帶后,用1∶10000稀釋的二抗于37 ℃孵育1 h后,再次洗滌,超敏ECL顯影液發(fā)光,凝膠成像系統(tǒng)進行采圖。使用Quantity one測量各條帶灰度值,并將目標蛋白灰度值與內(nèi)參灰度值的比值記為目標蛋白的相對表達量。
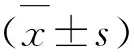
2 結(jié) 果
2.1 Morris水迷宮實驗 結(jié)果示意圖(見圖1A)。(1)可視平臺實驗:各組間平均逃避潛伏期和搜索路徑無明顯差異(P>0.05)(見圖1B、C)。(2)隱蔽平臺實驗:模型組大鼠平均逃避潛伏期和搜索路徑均明顯高于正常組和假手術組(正常組和假手術組間無明顯差異),二甲雙胍治療后上述指標明顯降低,差異有統(tǒng)計學意義(P<0.05)(見圖1E、F)。(3)空間探索實驗:模型組大鼠穿越平臺次數(shù)明顯低于其余各組,差異有統(tǒng)計學意義(P<0.05)(見圖1D)。

與正常組比較*P<0.05;與假手術組比較@P<0.05;與模型組比較#P<0.05
2.2 蘇木素伊紅染色 各組大鼠海馬區(qū)域形態(tài)結(jié)構(gòu)完整,細胞形態(tài)規(guī)則,沒有明顯差異(見圖2)。

圖2 各組大鼠海馬區(qū)蘇木素伊紅染色結(jié)果只鼠/組)
2.3 Western Blot 首先,tau[pS202]/tau5在模型組大鼠海馬組織中明顯高于正常組和假手術組,差異有統(tǒng)計學意義(P<0.05),經(jīng)二甲雙胍干預后,tau[pS202]/tau5顯著下降(P<0.05)(見圖3A、B)。同時,模型組大鼠海馬組織中PI3K的相對表達量及P-AKT(Ser473)/AKT和P-GSK3β(Ser9)/GSK3β明顯低于正常組和假手術組;而與模型組相比,治療組大鼠上述指標明顯上調(diào),差異亦具有統(tǒng)計學意義(P<0.05)(見圖3A、圖C~E)。

與正常組比較*P<0.05;與假手術組比較@P<0.05;與模型組比較#P<0.05
3 討 論
隨著人口老齡化的日益加重,AD的發(fā)病率呈逐年增加的趨勢。因此,AD的預防和治療已然成為全球關注的焦點。據(jù)統(tǒng)計,2015年,全球用于AD患者的防治費用達9575.6億美元,預計2050年,這一數(shù)字將達到9.12萬億美元[7]。目前批準臨床用于AD患者治療的藥物均只能改善臨床癥狀,幾乎所有逆轉(zhuǎn)或阻止AD疾病進展的臨床試驗都以失敗告終[8]。因此,尋找更為安全有效的治療方法則顯得尤為重要。AD被稱為是“大腦中的糖尿病性疾病”[9]。那么用于糖尿病治療的臨床一線藥物“二甲雙胍”是否能夠有效提高AD模型動物的學習記憶能力?其潛在的機制又是什么呢?本研究進行了初步的探討。
眾所周知,近年來tau蛋白過度磷酸化所形成的NFTs是AD發(fā)病機制研究的重點之一,蛋白激酶和磷酸酶的失衡是引起tau蛋白異常磷酸化的主要原因[10],其中GSK3β備受關注[11]。大量證據(jù)表明,GSK3β是PI3K/AKT的下游靶標。PI3K同時具有絲氨酸/蘇氨酸激酶和磷脂酰肌醇激酶的活性;當PI3K被激活時,3,4,5-三磷酸磷脂酰肌醇 (phosphatidylinositol 3,4,5-triphosphate,PIP3)會作為第二信使在細胞膜上產(chǎn)生;隨后作用于AKT蛋白使其磷酸化并激活[12,13]。活化后的AKT與GSK3β結(jié)合,誘導GSK3β進入細胞膜,磷酸化其N端Ser9非活性位點[14],使GSK3β失活,進而影響GSK3β的下游底物如tau蛋白和胰島素受體等[15]。
本實驗結(jié)果與上述研究內(nèi)容基本一致,二甲雙胍發(fā)揮著激活PI3K/AKT,降低GSK3β活性并減少tau蛋白過度磷酸化,從而改善AD模型大鼠認知的作用。SD大鼠雙側(cè)海馬注射Aβ25-35后水迷宮各項數(shù)據(jù)明顯增高,提示模型制備成功,AD模型大鼠學習記憶能力顯著下降。經(jīng)過二甲雙胍為期2 w的干預,AD模型鼠認知障礙有所改善。另外,雖然蘇木素伊紅染色結(jié)果表明各組大鼠海馬區(qū)細胞基本形態(tài)結(jié)構(gòu)無明顯差異,但Western blot 結(jié)果顯示,AD模型大鼠海馬組織中PI3K、P-AKT/AKT、P-GSK3β/GSK3β的表達顯著減少,而tau[pS202]/tau5則明顯上調(diào)。通過二甲雙胍藥物治療后,上述指標均大致恢復至正常組大鼠海馬組織中的表達水平。綜上,我們首次通過行為學,形態(tài)學和分子學實驗證明,二甲雙胍在神經(jīng)退行性疾病的治療方面可能發(fā)揮著特殊的作用,而其潛在分子機制可能與“PI3K-AKT-GSK3β-tau蛋白磷酸化”信號通路密切相關。
這一結(jié)果引發(fā)了作者更多的思考,GSK3β是否能夠作為糖尿病和AD的潛在聯(lián)系點呢?我們能否以此為切入點,為糖尿病和AD共病患者的治療提供一些新的思路呢?通過查閱文獻,我們發(fā)現(xiàn),糖尿病患者的AD風險是正常人的兩倍以上[16]。胰島素抵抗(insulin resistance,IR)是2型糖尿病最主要的特征,近年來大量研究表明,其可能間接導致GSK3β活性增加從而加劇AD的發(fā)病進程[17,18]。目前,一些GSK3β抑制劑已作為AD的治療藥物進入二期臨床試驗[19]。基礎研究也發(fā)現(xiàn),GSK3β抑制劑(如:靛玉紅)能使高脂飲食誘導的認知障礙大鼠學習和記憶能力得到提高[20]。結(jié)合我們的實驗結(jié)果,二甲雙胍雖然并非GSK3β的特異性抑制劑,但在AD的治療方面卻發(fā)揮著相類似的作用。而且,二甲雙胍作為糖尿病的臨床一線治療藥物,具有安全、有效、經(jīng)濟且方便購買等優(yōu)勢。這一發(fā)現(xiàn)對AD患者尤其是合并糖尿病的AD患者將可能是巨大的福音,但其具體機制及臨床研究尚待進一步開展。

