姜黃素制劑研究進展*
李 麗,陳 鶴,匡艷青,周旖璇,張純剛
(遼寧中醫藥大學藥學院,遼寧 大連 116620)
姜黃素是從姜科植物的根莖中提取出的二酮類化合物,呈鮮艷的黃色,可作為香料、色素添加劑等用于食品領域[1]。姜黃素具有抗腫瘤、抗氧化、抗炎、抗菌、降血糖等藥理作用,且由于毒性低,被美國列為第三代癌癥預防藥[2-3]。但姜黃素水溶性低、穩定性差[4],生物利用度低[5],這很大程度上限制了姜黃素在臨床上的應用。科研人員通過將姜黃素制成各種劑型來期解決這些問題[6]。本文著重介紹了固體分散體、脂質體、納米粒、膠束、微球、環糊精包合物等姜黃素劑型,為姜黃素的新劑型開發奠定基礎。
1 固體分散體
固體分散體是指藥物高度分散于惰性載體或基質中形成的固體制劑[7]。固體分散體能夠有效的降低藥物粒徑,增加藥物孔隙率,使藥物從結晶狀態轉變為無定型狀態,從而提高藥物的溶解度和溶出速率。
固體分散體主要的制備方法有溶劑法、熔融法、冷凍干燥法等,其優缺點見表1。

表1 固體分散體的不同制備方法比較Table 1 Comparison of different preparation methods of solid dispersion
Shuxin Wan等[8]以醋酸纖維素為載體通過溶劑法制備了姜黃素固體分散體,在體外釋放試驗發現姜黃素固體分散體有良好的緩釋效果,可達12小時的持續釋放。藥物動力學結果表明,與姜黃素原料藥相比,固體分散體的Cmax、Tmax、AUC分別增加了2倍、3倍、7倍。
韓剛等[9]分別以PEG、PVP作為載體通過熔融法制備了姜黃素固體分散體。大鼠體內藥物動力學結果表明,與姜黃素片劑相比,固體分散體的AUC0-∞、T1/2顯著增大。PEG固體分散體生物利用度提高554%,PVP固體分散體生物利用度提高690%。
2 脂質體
脂質體是磷脂、膽固醇在水中自動結合而成的同心脂質雙層結構的囊泡,其脂質雙層可以結合親脂藥物和雙親性藥物,而極性核心可包封親水性藥物[10-11]。脂質體類似生物膜的囊泡結構使其有較好的組織相容性,能夠通過胞吞進入細胞中,當達到相變溫度時膜流動性增加,包載的藥物快速釋放,從而提高藥物在細胞中的濃度,增加藥物的吸收。
脂質體常用的制備方法有薄膜蒸發法、乙醇注入法、冷凍干燥法、逆向蒸發法等,其優缺點見圖1。
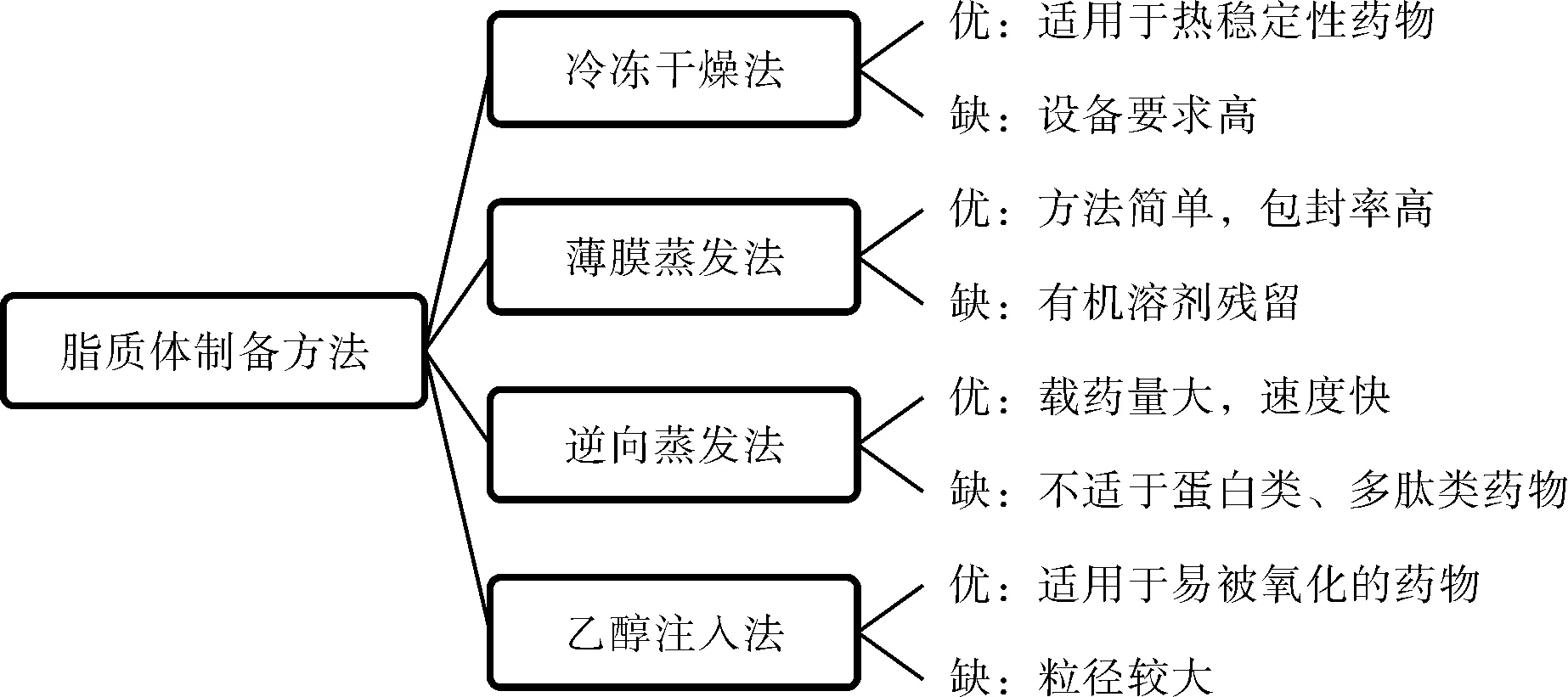
圖1 脂質體制備方法比較Fig.1 Comparison of preparation methods of liposomes
尤佳等[12]以乙醇注入法制備了含有PEG2000-DSPE的長循環姜黃素脂質體。該脂質體包封率高,藥物分布均勻。藥物動力學研究表明該脂質體的T1/2是普通姜黃素脂質體的1.8倍,是游離姜黃素的10倍。該方法制備的長循環姜黃素脂質體能夠有效地降低藥物體內清除率,增長作用時間,從而提高藥物生物利用度。
為了提高藥物的生物利用度,顧吉晉等[13]通過孵化法對姜黃素脂質體進行卡波姆包衣。藥物動力學參數顯示,在相同條件下,脂質體的入血速度較姜黃素混懸液明顯加快,Cmax和AUC0-∞均表現為包衣脂質體>普通脂質體>混懸液,包衣脂質體的相對生物利用度為281%,是普通姜黃素脂質體的2.22倍。
3 納米粒
納米粒是通過人工技術制備的直徑在1~100 nm的顆粒。由于納米粒粒徑較小,使其可以以胞飲的方式進入細胞直接發揮作用以提高藥物生物利用度,同時能有效增大藥物比表面積,增加難溶性藥物的溶解度。
納米粒常用的制備方法有乳化-溶劑蒸發法、雙乳化劑蒸發法、微乳法、電噴霧法、高壓均質法,其優缺點見圖2。

圖2 納米粒制備方法比較Fig.2 Comparison of preparation methods of nanoparticles
J.Shaikh等[14]以乳化-溶劑蒸發法制備了姜黃素負載PLGA納米粒,動態光散射結果表明納米粒平均粒徑為(264±2)nm,PDI為0.31±0.05。納米粒的載藥量為15%。大鼠體內藥物動力學結果顯示,姜黃素PLGA納米粒比姜黃素混懸液的AUC0-∞提高了十倍有余,Tmax和Cmax也顯著增加,大大提高了姜黃素口服生物利用度。
鄭毅等[15]為觀察姜黃素納米粒提高生物利用度的效果,通過雙乳化劑蒸發法制備了姜黃素納米粒。通過掃描電鏡發現納米粒呈球形規則結構,粒徑在200 nm左右。同時藥動實驗結果表明姜黃素納米粒的Cmax和Tmax都遠大于姜黃素混懸液,姜黃素-PLGA 納米粒組的AUC為(110.86±10.45) μg·mL-1·min-1遠遠大于姜黃素混懸液組的AUC為(21.32±3.56)μg·mL-1·min-1。
4 膠 束
當表面活性劑在超過臨界膠束濃度的水介質中自組裝成有組織的疏水核-親水性殼結構的締合物稱為膠束[16]。常用制備方法有溶劑蒸發法、乳化法、透析法等,其優缺點見圖3。
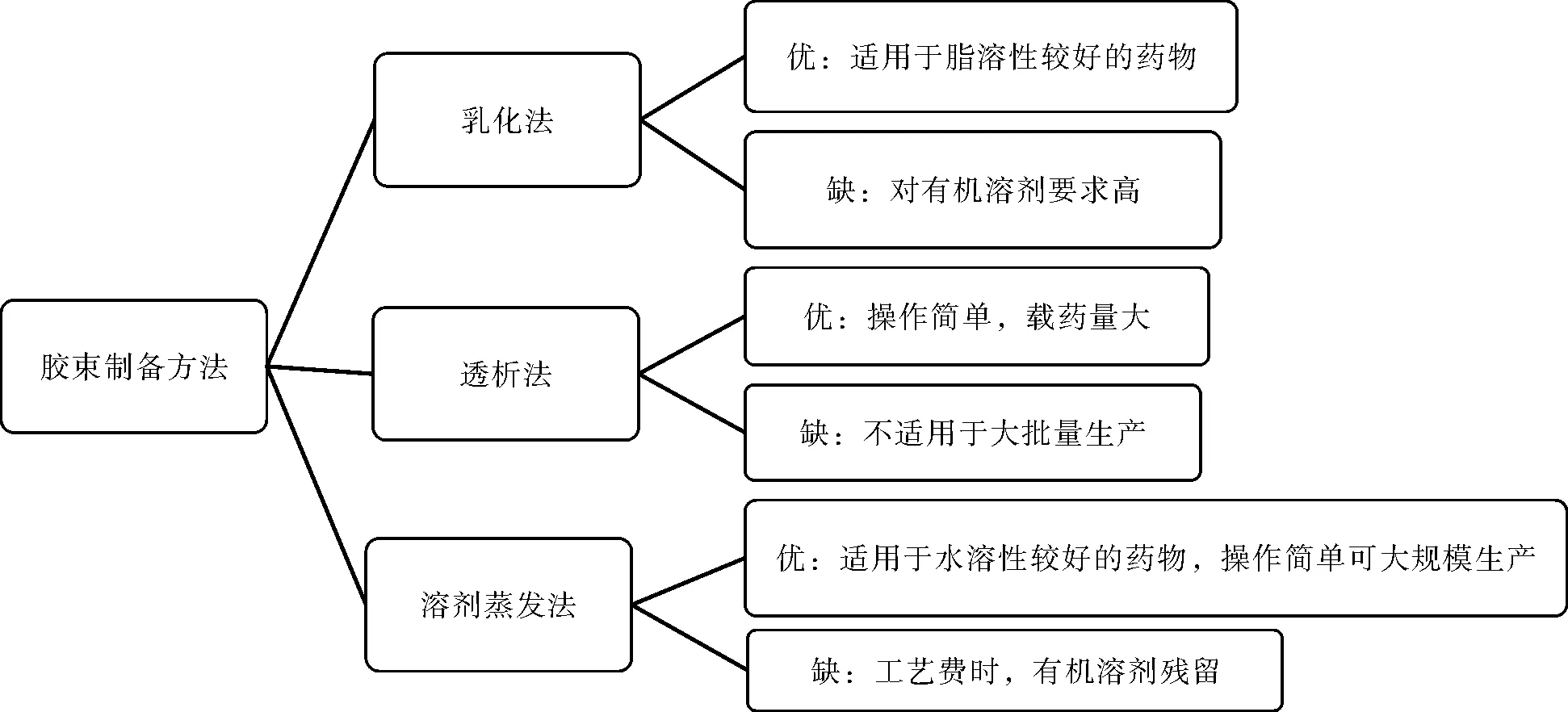
圖3 膠束制備方法比較Fig.3 Comparison of preparation methods of micelles
李晨晨等[17]以mPEG-PCL-PHE(BOC)作為載體通過溶劑蒸發法制備了姜黃素膠束。其在大鼠體內藥物動力學參數表明,與姜黃素原料藥相比,膠束制劑的AUC0-∞提高6.7倍,T1/2顯著延長,清除率降低。
Cihui Tian等[18]用透析法制備了氧化還原敏感透明質酸-β-姜黃素膠束,又加入吐溫80進行修飾來實現藥物的遞送。給藥5 min后發現姜黃素膠束的血藥濃度是游離姜黃素的8.8倍。將姜黃素制成膠束顯著增加了其AUC0-∞并降低了清除率,有效提高了藥物生物利用度。同時體外釋放試驗表明在10 mmol谷胱甘肽存在的條件下藥物釋放率明顯增加,膠質瘤細胞的凋亡數量顯著增加。
5 微 球
微球是指藥物溶解分散于高分子載體材料中形成的骨架型微球分散體,粒徑范圍在1~200 μm,一般做注射或口服使用。微球中藥物的釋放依賴于微球的降解,故采用高分子材料作為載體制成微球使藥物緩慢釋放,達到長效的目的,從而提高生物利用度。
微球常用制備方法有乳化-加熱固化法、噴霧干燥法、液中干燥法、乳化-交聯法等,其優缺點見圖4。
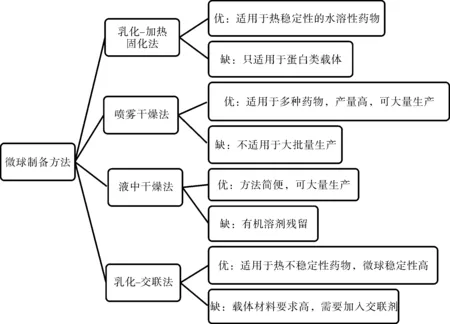
圖4 微球制備方法比較Fig.4 Comparison of preparation methods of microspheres
由于姜黃素在堿性條件下極易降解,Preeti G. Karade等[19]在姜黃素微球上負載抗壞血酸,發現當姜黃素和抗壞血酸比例為1:1時,在堿性條件下姜黃素幾乎不降解,穩定性顯著增加。大鼠體內藥物動力學結果表明,與姜黃素混懸液相比,姜黃素微球的血藥濃度增加了7.33倍,生物利用度增加了7倍。結果可見負載抗壞血酸的姜黃素微球穩定性更好,生物利用度也明顯增加,有利于其結腸靶向給藥。
林媚等[20]以乳化法制得的微球表面光滑,大小均一。通過UV-VIS 分光光譜儀觀察發現,隨著聚己內酯分子量增大,藥物載藥率和包封率增高。當分子量達到80000時,藥物釋放時間最長,可達250小時。結果表明聚已內酯姜黃素微球能明顯延長姜黃素的釋放時間。
6 環糊精包合物
環糊精包合物是通過將藥物全部或部分包圍在中心環糊精空腔中而形成。環糊精是具有親水外表面和親脂中心空腔的環狀寡糖,在水溶液中有較好的溶解度和包合能力,其親脂性空腔能夠包合親脂性藥物,使其隨著環糊精的溶解而分散于溶液中。
環糊精包合物常用制備方法有飽和溶劑法、研磨法、冷凍干燥法等。其優缺點見圖5。
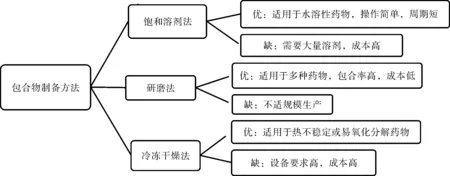
圖5 包合物制備方法比較Fig.5 Comparison of preparation methods of inclusion compound
高振坤等[21]選用羥丙基-β-環糊精制備了姜黃素-羥丙基-β-環糊精包合物,藥物包封率達到97%,包合物在水中的溶解度為35 μg/mL,觀察50 h后包合物中姜黃素剩余量為95%,綜上表明姜黃素的水溶性及穩定性都明顯提高,具有很好的臨床應用前景。
李藝等[22]測得姜黃素包合物的溶解度為1.76 mg/mL,在大鼠體內Cmax,Tmax和T1/2分別為95.05 mg/L,10 min 和21.67 min,相比于姜黃素原料藥明顯提高。李寧[23]通過冷凍干燥法制備姜黃素羥丙基β環糊精包合物。藥物動力學結果表明,與姜黃素相比,姜黃素包合物的Tmax略有減少,AUC0-t是姜黃素的2.77倍,證明了包合物能夠顯著提高姜黃素的口服生物利用度。
7 結 語
姜黃素作為一種天然藥物,在治療乳腺癌、腸道癌和炎癥性疾病等方面都有很好的療效。學者們通過對姜黃素劑型的研究,提高了姜黃素的溶解度和生物利用度,增加其藥物作用。但還存在一些缺陷,如藥物包封率低,生物代謝快,給藥途徑少等,因此還需要進一步的研究。

