2型糖尿病患者IRAK-M變化對胰島β細胞功能的影響
陳勝利, 張曉娟,白桂榮,強 丹,謝曉敏
糖尿病是遺傳、免疫等多機制共同作用,以糖脂代謝紊亂為基調的一種慢性進展性疾病。Toll樣受體(TLR)是機體固有免疫的重要組成部分,是白細胞介素1受體相關激酶(IRAKs)家族負向調控TLR/白介素(IL)-1信號通路功能因子,可以減弱免疫炎性損害,可感知內外源性模式相關分子刺激性損害,繼而活化下游一系列慢性炎癥信號途徑,導致胰島素抵抗的發生發展[1]。研究發現白介素-1受體相關激酶-M(IRAK-M)與糖脂代謝異常相關[2-3]。本文對2型糖尿病及糖尿病前期患者進行研究,探討IRAK-M水平變化的臨床意義,現報告如下。
1 資料與方法
1.1 一般資料:選取2019年11月-2020年12月于寧夏醫科大學第二附屬醫院體檢的18~75歲人群315例為研究對象。2型糖尿病組(DM組)77例,其中男性52例,女性25例,年齡(50.06±11.43)歲;糖尿病前期(6.1 mmol/L≤FBG<7.0 mmol/L)80例為P2組,其中男性54例,女性26例,年齡(50.13±11.62)歲;糖尿病前期(5.6 mmol/L≤FBG<6.1 mmol/L)79例為P1組,其中男性54例,女性25例,年齡(49.97±12.12)歲。正常對照組79例為(NC組),其中男性54例,女性25例,年齡(49.71±11.51)歲。4組患者間年齡、性別等因素差異無統計學意義。2型糖尿病及糖尿病前期診斷標準符合美國ADA診斷標準。納入標準:所有入組對象均未接受降糖干預;非1型糖尿病患者;神志正常且無精神或心理疾患;無貧血及嚴重心、腦血管疾病或腫瘤病史;近期生活規律無主觀飲食故意;近期無獻血及接受血液制品輸注事件;無急慢性感染或其他急性疾病史;無吸食毒品或其他欣快藥品病史;女性未處妊娠或哺乳期等。
1.2 方法
1.2.1 基本資料:收集體檢者年齡、性別、血壓、身高、體重、腰圍、臀圍,計算體質量指數(BMI)、腰臀比(WHR)。
1.2.2 生化指標測定:禁食10~12 h,于次日晨抽取肘靜脈血檢測空腹血糖(FPG)、甘油三酯(TG)、膽固醇(TC)、低密度脂蛋白(LDL-C)、高密度脂蛋白(HDL-C)等。
1.2.3 IRAK-M及糖代謝相關指標測定:取置于-80 ℃冰箱備用的2 mL血漿標本,采用酶聯免疫吸附(ELISA)法檢測IRAK-M、FINS、HbA1C水平,根據胰島素抵抗指數(HOMA-IR)=FPG×FIns/22.5、胰島素分泌指數(HOMA-β)=20×FIns/(FPG-3.5),分別計算HOMA-IR、HOMA-β。
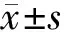
2 結果
2.1 4組患者臨床資料比較:4組年齡、臀圍、TG、TC、HDL-C比較,差異無統計學意義(P>0.05);4組收縮壓、舒張壓、BMI、WHR、LDL-C、FPG比較,差異有統計學意義(P<0.05);DM組分別與P2組、P1組、NC組相比,年齡、舒張壓、腰圍、TC的差異無統計學意義(P>0.05);與NC組相比,DM組收縮壓、BMI、WHR、TG、LDL-C和FPG顯著升高,HDL-C顯著降低(P<0.05);與P1組相比,DM組FPG顯著升高,HDL-C顯著降低(P<0.05);與P2組相比,DM組FPG顯著升高(P<0.05),見表1。
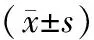
表1 4組患者一般資料及相關指標比較
2.2 4組患者間HbA1C、FINS、HOMA-IR、HOMA-β、IRAK-M比較:4組FINS、HbA1C、HOMA-IR、HOMA-β及IRAK-M比較,差異有統計學意義(P<0.05);DM組分別與P2組、P1組、NC組相比,FINS、HbA1C、HOMA-IR、HOMA-β及IRAK-M的差異有統計學意義(P<0.05);P2組、P1組及NC組兩兩比較,差異有統計學意義(P<0.05),見表1。
2.3 IRAK-M與相關指標的相關性:IRAK-M與FINS、HOMA-IR、HbA1C水平呈負相關性(r=-0.463、-0.577、-0.493,P<0.05),與 HOMA-β呈正相關性(r=0.567、0.535,P<0.05)。
3 討論
胰島素抵抗是2型糖尿病早期發展的關鍵因素之一,多種類靶組織對胰島素敏感度低下,特征性表現是胰島素分泌增加、葡萄糖轉運和代謝減少。胰島素抵抗的潛在機制包括多領域交叉炎癥、內質網應激、氧化應激和線粒體功能障礙[4]。對2型糖尿病人的研究表明,胰島素受體-1/PI3K/Akt信號通路的激活受損,這是調節葡萄糖轉運的關鍵步驟[5]。胰島素信號通路的缺陷導致異常的葡萄糖體內平衡和隨之而來的胰島素抵抗[6]。Toll樣受體(TLRs)在哺乳動物體內分布廣泛,其被激活后可產生促炎因子和炎癥趨化因子,參與固有免疫反應并可進一步喚醒適應性免疫,但調節異常常會導致疾病發生。病原體或宿主來源的模式相關刺激因子過度激活TLRs與多種炎癥相關疾病密切相關,如膿毒性休克、急性肺損傷、哮喘、慢性阻塞性肺病、氣道上皮炎癥、肝衰竭、腸道慢性炎癥、過敏等[7]。在這種情況下,調節TLRs表達可能是治療炎癥相關性疾病的一種有效方法。
炎癥早被認定為幾種疾病狀態(如敗血癥、癌癥和糖尿病)中的關鍵問題。鑒于LTRs廣泛存在于內皮細胞中,因此它們可能涉及這些細胞某些炎癥的發展過程和結果。越來越多的研究表明,TLRs與炎癥和胰島素信號通路關系密切[8]。TLR2和TLR4是胰島炎癥強化的關鍵存在,導致巨噬細胞活化和之后的胰島內分泌細胞功能障礙[9]。TLR3對維持免疫細胞、胰腺β細胞和葡萄糖穩態具有重要作用。有研究報道,肥胖小鼠TLR3功能缺乏后可改善糖耐量和肝臟脂肪變[10],這可能是炎癥反應對胰島素受體有封閉作用,從而降低了組織對葡萄糖的敏感度有關,IRAK-M通過抑制IRAK-l功能途徑減弱炎性反應[11]。因此,當 IRAK-M缺陷時,胰島炎發生頻率和自身抗胰島素抗體顯著增加,有更強糖尿病易感傾向。本研究顯示,2型糖尿病患者IRAK-M水平顯著低于健康人群,且與ISI呈正相關性,與HOMA-IR呈負相關性關系,提示隨著IRAK-M表達水平上調,外周組織胰島素敏感度和葡萄糖利用率可能會逐漸增加。研究表明,胰島β細胞可在功能和數量上遭受糖脂代謝毒性的雙重打擊。本研究DM組患者BMI、WHR、TG、LDL-C、FPG、HbA1C水平均顯著高于其他3組,HDL-C顯著降低,有效說明了胰島β細胞的分泌功能顯著受到血糖、血脂的毒性作用影響。胰島素β細胞功能受損是2型糖尿病發病過程中另一關鍵因素。本資料結果顯示,研究對象血糖調節能力程度隨著IRAK-M表達下調顯著受損,DM組IRAK-M水平顯著低于NC組,且相關性分析顯示IRAK-M水平與HOMA-β呈正相關性,進一步證實IRAK-M缺乏時可能會增加胰島素β細胞功能異常的風險。
總之,IRAK-M可能會通過負向調控TLR信號抑制炎癥反應,從而在對抗胰島素抵抗,在2型糖尿病發生、進展中起著重要作用。

