TLR2在幽門螺旋桿菌感染模型中的表達
申玲玲 , 趙文萱 , 任林廣 , 劉 依 , 趙福廣
(1.吉林農(nóng)業(yè)大學生命科學學院 , 吉林 長春 130118 ; 2.貴州中醫(yī)藥大學藥學院 , 貴州 貴陽 550000; 3.吉林省腫瘤防治研究所 , 吉林 長春 130021)
胃潰瘍(Gastric ulcer,GU)是世界上發(fā)病率和患病率不斷上升的主要胃腸疾病之一,被認為是一個全球性的健康問題,但其具體發(fā)病機制尚不完全清楚。幽門螺旋桿菌(Helicobacterpylori,HP)是一種螺旋狀致病菌,是構(gòu)成胃炎的主要原因[1]。這種炎癥可發(fā)展為GU和胃癌(Gastric cancer,GC)[2]。與未感染人相比,HP感染的個體患GC的風險高出6倍[3]。雖然HP已被確定為GU的危險因素,但其發(fā)病機制涉及宿主遺傳和環(huán)境因素的聯(lián)合作用[4]。研究發(fā)現(xiàn),除HP感染外,遺傳多態(tài)性已成為癌癥易感性的關(guān)鍵因素[5]。
Toll樣受體(Toll-like receptor,TLR)是模式識別受體家族成員,由胞膜外區(qū)、胞質(zhì)區(qū)和跨膜區(qū)組成[6],在胃上皮細胞[7]及各類免疫細胞[8]中均有分布,通過激活核因子激酶(Nuclear factor kappa-B,NF-κB)來引起機體對病原體產(chǎn)生強烈的炎癥—免疫應答,在抵抗疾病感染過程中發(fā)揮重要作用。TLR2在細菌識別后與適配分子MyD88(Myeloid differentiation factor 88)協(xié)同激活,觸發(fā)絲裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信號通路[9]。
近年來,對于TLR與HP致病關(guān)系的研究也取得了一定進展,但它在導致胃病變的進展中的作用尚未確定。本試驗利用qRT-PCR、免疫組化和Western Blot檢測正常、乙酸和HP感染胃黏膜組織中TLR2在基因和蛋白水平的表達情況,為深入探究TLR2與HP感染引起的GU之間的相互關(guān)系與治療胃部疾病提供數(shù)據(jù)支持。
1 材料與方法
1.1 菌株 HP菌株是本試驗室從GU患者的胃組織中分離鑒定并保存。
1.2 試驗試劑 超純RNA提取試劑盒、HiFiScript cDNA Synthesis Kit(由康為世紀生物科技有限公司提供);qRT-PCR試劑盒(由TaKaRa生物技術(shù)有限公司提供);H.E.染色試劑盒(由索萊寶科技有限公司提供);超敏化學發(fā)光試劑ECL、Goat anti-rabbit IgG (H+L) HRP、TLR2多克隆抗體、Actin抗體(由Affinity抗體公司提供)。
1.3 試驗動物分組 SPF級健康成年雄性大鼠30只, 體重180~220 g,購自長春市寬城區(qū)宏達動物養(yǎng)殖場。將大鼠隨機分成3組,每組5只。第1組為正 常組,第2組為乙酸組,用20%乙酸造模,0.05 mL/只, 3 d成模,造模方法參照文獻[10],第3組 為HP(分離自GU患者的病變部位)感染組,給予新鮮HP菌液灌胃法進行造模,1 mL/只,每天1次, 分別連續(xù)7、14、21 d和30 d,造模方法參照文獻[11]。Giemsa染色用于在鏡下觀察HP感染密度及其定植數(shù)量,計分標準參照文獻[12]。H.E.染色用于觀察細胞形態(tài)及判斷胃黏膜的炎癥程度,評分標準參照文獻[13]。
1.4 HP培養(yǎng)及鑒定 分別將正常組、乙酸組、HP感染組胃黏膜組織置于0.9%生理鹽水中研磨,取菌液100 μL接種于哥倫比亞瓊脂培養(yǎng)基平板中,置于37 ℃微需氧環(huán)境(5%O2,10%CO2,85%N2)、濕度90%以上培養(yǎng)7 d,并使用尿素酶顯色法對單菌落進行HP陽性鑒定。
1.5 RNA提取及反轉(zhuǎn)錄 取正常組、乙酸組和HP感染組(7、14、21 d和30 d)的胃黏膜組織,按照超純RNA提取試劑盒說明書操作步驟提取RNA,并使用HiFiScript cDNA Synthesis Kit合成cDNA。
1.6 qRT-PCR檢測TLR2基因的表達 設計Actin及TLR2基因引物,序列信息及反應條件見表1。PCR反應體系(25 μL):2×qPCR Mix 12.5 μL,基因引物2.0 μL,cDNA 2.5 μL,ddH2O 8.0 μL。PCR反應條件:95 ℃預變性10 min,95 ℃變性15 s,60 ℃ 退火60 s,72 ℃延伸60 s,40次循環(huán)。采用2-ΔΔCt法分析TLR2基因在各組的相對表達量,ΔΔCt=(Ct目的基因-Ct內(nèi)參基因)試驗組-(Ct目的基因-Ct內(nèi)參基因)對照組。最后,將PCR產(chǎn)物進行凝膠電泳和成像分析。

表1 qRT-PCR引物序列Table 1 Sequences of primers used in qRT-PCR
1.7 H.E.、Giemsa及免疫組化染色
1.7.1 H.E.及Giemsa染色 根據(jù)H.E.染色及Giemsa試劑盒說明書對各組切片進行染色,于鏡下觀察各處理組的炎癥程度及HP定植情況。
1.7.2 免疫組化法檢測TLR2蛋白的分布 石蠟切片經(jīng)過脫蠟、脫水處理后進行抗原修復;將切片放入3%雙氧水溶液避光孵育10 min;置于PBS(pH 7.4)中洗滌2次,每次5 min,滴加10%正常山羊血清均勻覆蓋組織,封閉10 min;甩掉封閉液,滴加一抗(稀釋度1∶100),平放于濕盒內(nèi)4 ℃孵育過夜,PBS沖洗3次,每次5 min,滴加適量辣根過氧化物酶(HRP)標記二抗(稀釋度1∶500),37 ℃孵育30 min, 滴加二氨基聯(lián)苯胺(DAB)顯色15 min,用自來水沖洗、蘇木素復染、常規(guī)脫水、透明、封片。最后,用Olmpus LX51倒置顯微照相系統(tǒng)觀察并成像。每張切片隨機選取5個不重復的視野(400×),用Image J測定出TLR2蛋白陽性表達的平均光密度值。
1.8 Western Blot檢測TLR2蛋白的表達 取正常組、乙酸組和HP感染組(7、14、21 d和30 d)的胃黏膜組織,研磨至粉末,加入RIPA裂解液充分裂解。蛋白變性后進行SDS-PAGE凝膠電泳,轉(zhuǎn)膜時維持穩(wěn)流300 mA轉(zhuǎn)2 h至聚偏二氟乙烯膜,室溫下封閉2 h, 滴加一抗(稀釋度1∶1 000),4 ℃孵育過夜,磷酸鹽緩沖液(PBST)清洗3遍,再滴加HRP標記的二抗(稀釋度1∶5 000),常溫孵育0.5 h,用PBST清洗3遍,最后用超敏化學發(fā)光試劑ECL進行顯色曝光,記錄試驗結(jié)果,重復3次。對目的條帶用Image J軟件測定TLR2蛋白的相對密度值。
1.9 試驗數(shù)據(jù)分析 利用Graph Pad Prism 5.0軟件對試驗數(shù)據(jù)進行單因素方差分析。
2 結(jié)果
2.1 HP鑒定 HP陽性鑒定結(jié)果發(fā)現(xiàn),陰性對照孔(未加單菌落)藥液呈黃色。加入正常組和乙酸組單菌落的孔藥液顏色依舊呈黃色,說明該菌落為HP陰性。加入HP感染組(7、14、21 d和30 d)菌落的孔藥液顏色由黃色變成玫瑰紅,說明該菌落為HP陽性,見中插彩版圖1。

圖1 各組胃黏膜組織中HP鑒定結(jié)果Fig.1 Identification of Helicobacter pylori in gastric mucosa of each group1:尿素酶鑒定陰性對照; 2:正常組胃黏膜組織培養(yǎng)所得菌落尿素酶鑒定結(jié)果;3:乙酸組胃黏膜組織培養(yǎng)所得菌落尿素酶鑒定結(jié)果; 4~7:依次為HP感染組(7、14、21 d和30 d)胃黏膜組織培養(yǎng)所得菌落尿素酶鑒定結(jié)果1:Negative control of urease chromogenic test; 2:Identification results of colony urease obtaine from gastric mucosal tissue culture of normal group;3:Identification results of colony urease obtaine from gastric mucosa tissue culture of acetic acid group; 4-7:Sequential identification results of colony urease from gastric mucosal tissue culture of HP infection group (7,14,21 days and 30 days)
2.2 PCR產(chǎn)物質(zhì)量分析 熒光定量PCR儀對Actin和TLR2基因進行40個循環(huán)擴增,結(jié)果發(fā)現(xiàn),各組樣品的熔解曲線也出現(xiàn)單峰(中插彩版圖2),分別在79.42 ℃和80.46 ℃。對PCR產(chǎn)物進行1.0%瓊脂糖凝膠電泳,發(fā)現(xiàn)Actin和TLR2基因均在預期位置出現(xiàn)條帶(圖3)。
圖2 Actin和TLR 2基因熒光定量熔解曲線Fig.2 Fluorescence quantitative dissolution curve of Actin and TLR2 genes

圖3 TLR2和Actin基因PCR結(jié)果Fig.3 PCR results of TLR2 and Actin genesM:DL-2 000 DNA marker;1: TLR2; 2: Actin
2.3 大鼠胃黏膜組織中TLR2基因的表達量 熒光定量PCR檢測結(jié)果顯示,TLR2 mRNA的相對表達量在大鼠感染HP后的胃黏膜組織中發(fā)生了明顯的變化,HP感染30 d組的TLR2 mRNA的相對表達量最高,均顯著高于HP感染7、14、21 d組、正常組及乙酸組(P<0.001,圖4)。
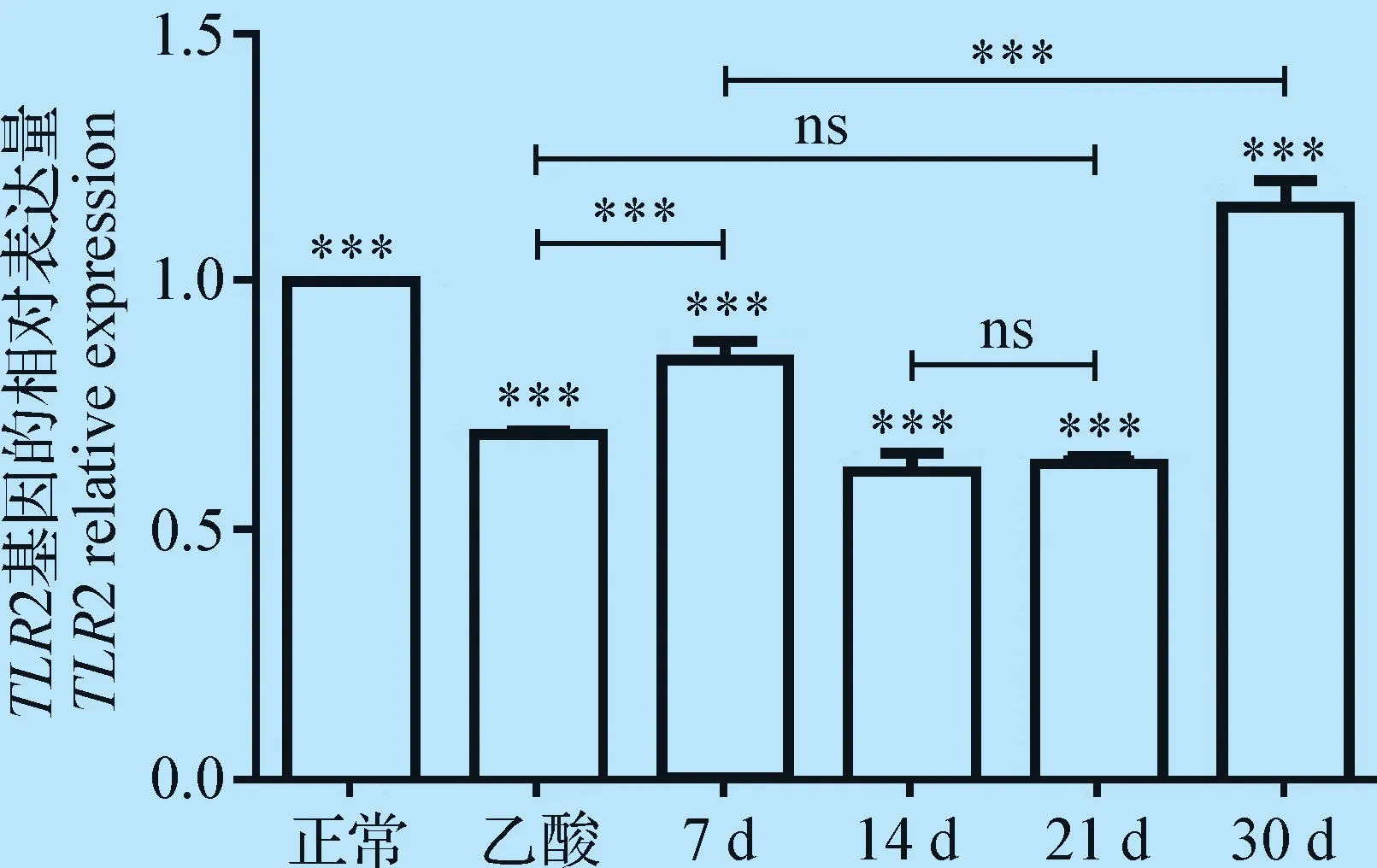
圖4 胃黏膜組織中TLR 2基因的相對表達量Fig.4 The relative expression of TLR 2 gene in gastric mucosa注:*:差異顯著(P<0.05), **:差異極顯著(P<0.01),***:差異極其顯著(P<0.001);下圖同Note: *: Significant difference (P<0.05), **: Highly significant difference (P<0.01), ***: Extremely significant difference (P<0.001). The same as below
2.4 大鼠胃黏膜組織H.E.染色 H.E.染色結(jié)果顯示,正常組于鏡下觀察細胞形態(tài)規(guī)整,無潰瘍現(xiàn)象;乙酸組胃黏膜潰瘍現(xiàn)象明顯,細胞形態(tài)呈不規(guī)則分布,出現(xiàn)大量炎性細胞;HP感染組均出現(xiàn)不同程度的潰瘍現(xiàn)象,潰瘍程度隨灌菌天數(shù)的遞增而加深(中插彩版圖5)。
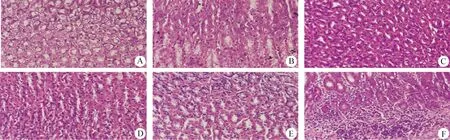
圖5 H.E.染色檢測胃黏膜炎癥程度(400×)Fig.5 Detection of inflammation degree of gastric mucosa by H.E. staining (400×)A:正常組; B:乙酸組; C:HP感染7 d組; D:HP感染14 d組; E:HP感染21 d組; F:HP感染30 d組A:Normal group; B:Acetic acid group; C:HP infection 7 d group; D:HP infection 14 d group; E:HP infection 21 d group; F:HP infection 30 d group
2.5 大鼠胃黏膜組織Giemsa染色 Giemsa染色用來檢測各組胃黏膜組織中HP定植情況,切片于鏡下觀察為深藍色,即為該組織中存在HP,背景呈淺藍色則沒有HP定植。結(jié)果發(fā)現(xiàn),正常組和乙酸組在鏡下背景呈淺藍色,說明其組織內(nèi)沒有HP定植;而HP感染7、14、21、30 d組在鏡下呈深藍色,說明胃黏膜組織中存在HP菌體(中插彩版圖6)。
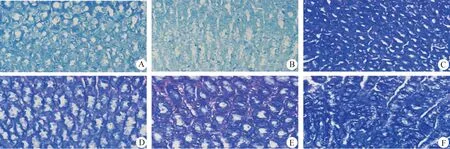
圖6 Giemsa染色檢測胃黏膜組織中HP定植情況(400×)Fig.6 Detection of HP colonization in gastric mucosa tissue by Giemsa staining (400×)A:正常組; B:乙酸組; C:HP感染7 d組; D:HP感染14 d組; E:HP感染21 d組; F:HP感染30 d組A:Normal group; B:Acetic acid group; C:HP infection 7 d group; D:HP infection 14 d group; E:HP infection 21 d group; F:HP infection 30 d group
2.6 大鼠胃黏膜組織中TLR2蛋白的分布情況 免疫組化染色的陽性產(chǎn)物為棕褐色,表明有該蛋白分布。TLR2蛋白集中分布于胃黏膜上皮細胞,在正常組、乙酸組和HP感染組的胃黏膜組織中均呈陽性表達。與正常組相比,HP感染30 d組的胃黏膜組織中TLR2陽性表達最強烈。最后,用圖像分析軟件Image J分析測定出TLR2蛋白的平均光密度值,結(jié)果見中插彩版圖7、表2。
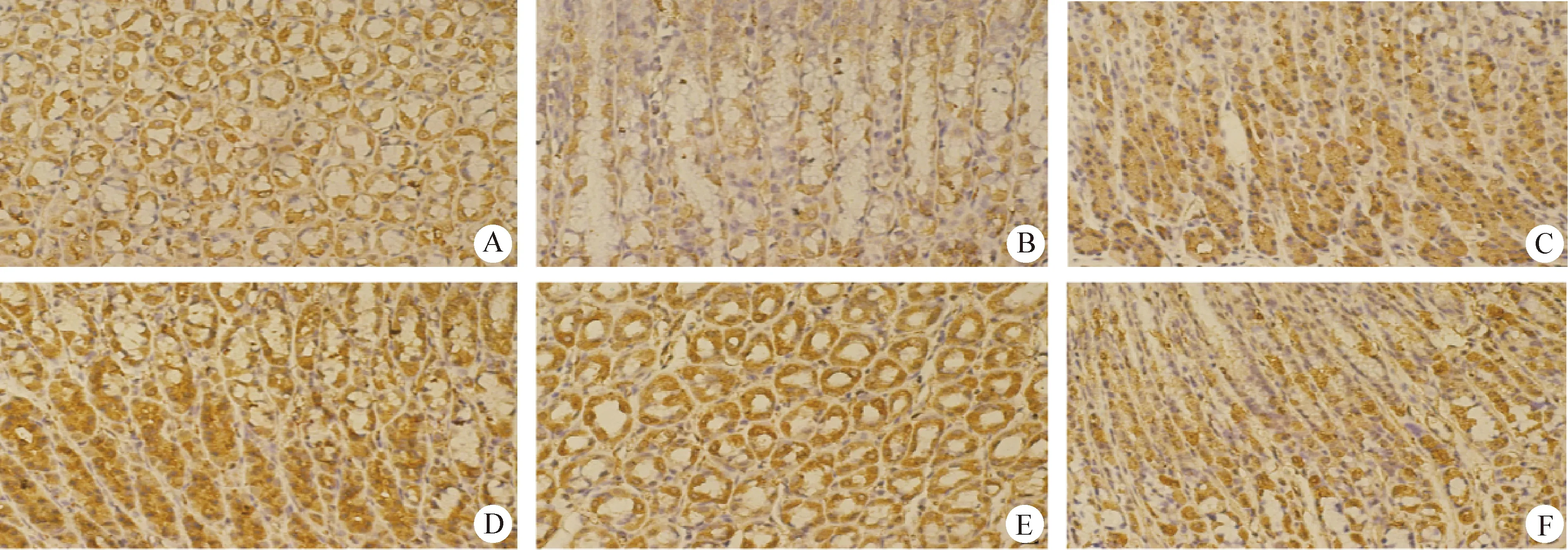
圖7 免疫組化檢測胃黏膜組織中TLR2的表達 (400×)Fig.7 Detection the expression of TLR2 in gastric mucosa by immunohistochemistry(400×)A:正常組; B:乙酸組; C:HP感染7 d組; D:HP感染14 d組; E:HP感染21 d組; F:HP感染30 d組A:Normal group; B:Acetic acid group; C:HP infection 7 d group; D:HP infection 14 d group; E:HP infection 21 d group; F:HP infection 30 d group
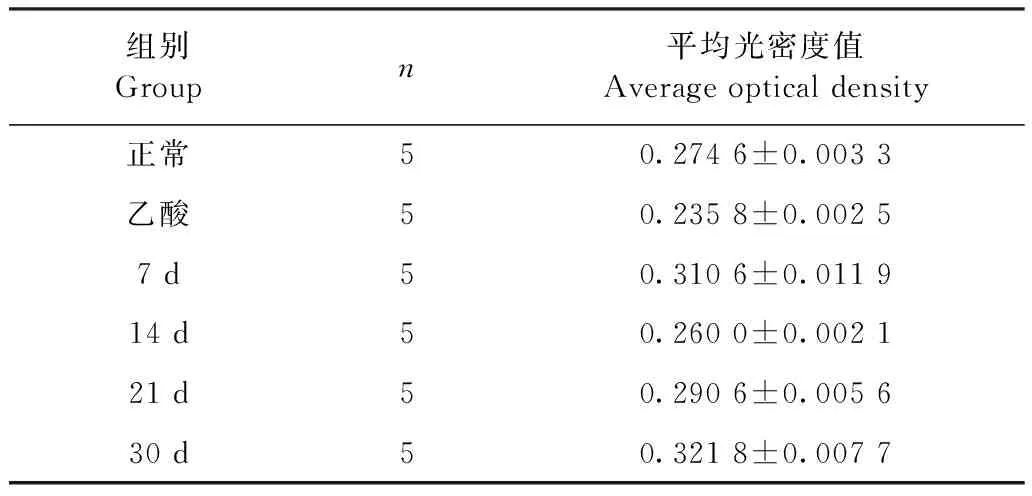
表2 胃黏膜組織中TLR2陽性反應的平均光密度Table 2 Average optical density of TLR2 positive reaction in gastric mucosa
2.7 大鼠胃黏膜組織中TLR2蛋白表達的Western Blot檢測 Western Blot結(jié)果顯示,TLR2蛋白在正常組、乙酸組及HP感染組的胃黏膜組織中均有不同程度的表達,其中,TLR2蛋白在HP感染30 d組的表達量最高,除了HP感染14 d組的表達量略微低于正常組之外,其他HP感染組均顯著高于正常和乙酸組的表達量(P<0.001,圖8、圖9)。
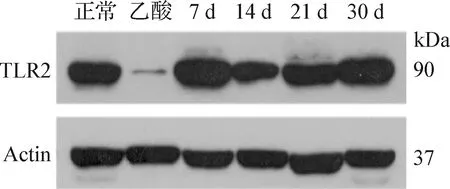
圖8 胃黏膜組織中TLR2和Actin蛋白表達Fig.8 The expression of TLR2 and Actin protein in gastric mucosa
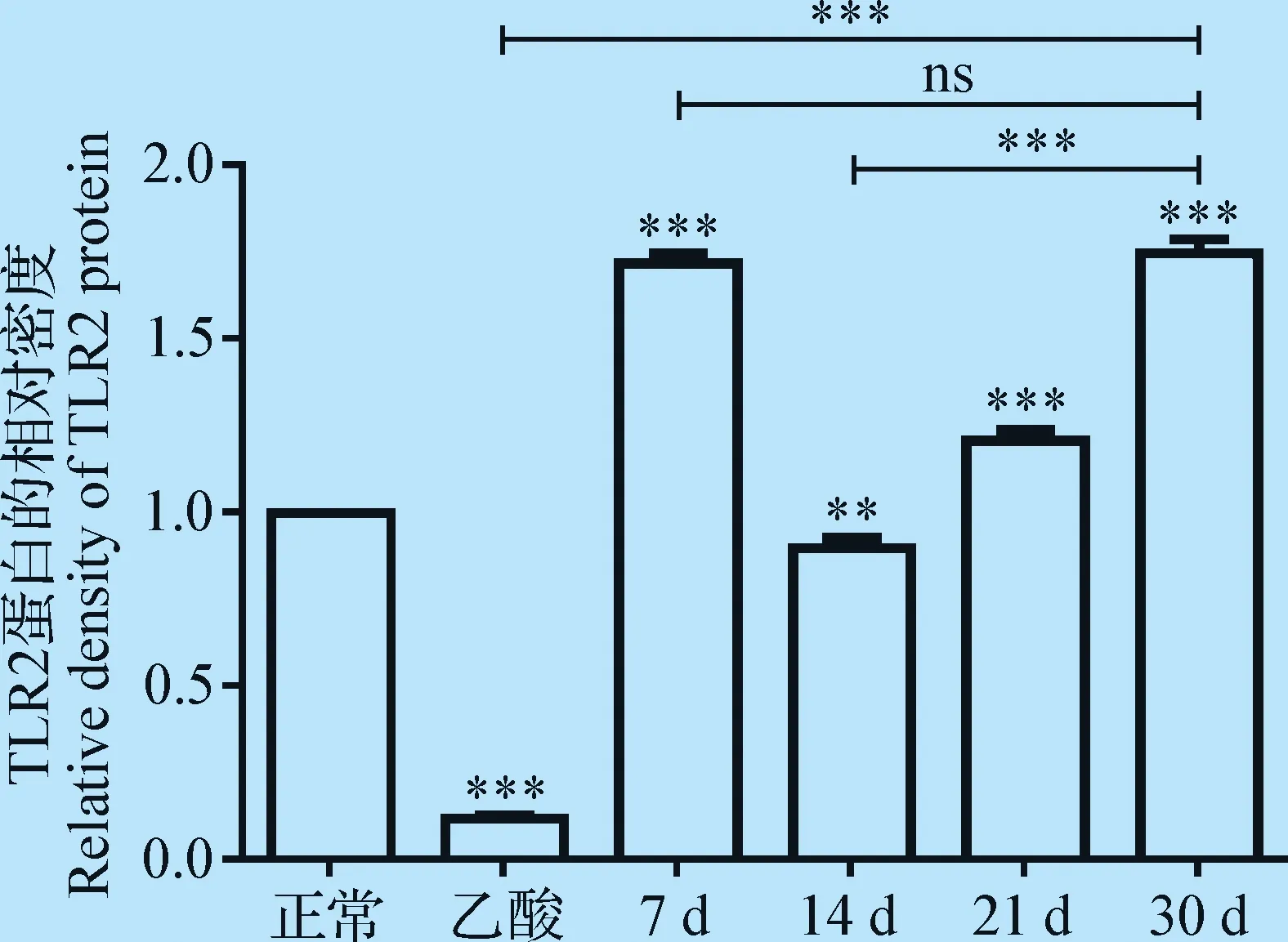
圖9 胃黏膜組織中TLR2蛋白的相對表達量Fig.9 The relative expression of TLR2 protein in gastric mucosa
3 討論
近年來,TLR是各國學者研究的熱點,在病原體成分的識別中起著至關(guān)重要的作用[14]。革蘭陰性菌的LPS是通過TLR2激活信號通路來識別的,最終導致炎癥反應[15]。通過對轉(zhuǎn)染TLR的T24和CHO細胞的多項觀察,已證實TLR2是HP-LPS受體[16]。TLT2主要通過MyD88途徑與HP-LPS信號結(jié)合,激活NF-κB,進而誘導促炎細胞因子表達[17]。已有研究表明,HP能刺激TLR2的表達,并引發(fā)炎癥因子表達量升高[18]。盡管已有研究表明了HP和TLR之間的相互作用,但尚未確定TLR在這種相互作用中的具體機制。
本試驗以HP感染大鼠引發(fā)的GU組織為試驗材料,通過qRT-PCR和Westrn Blot檢測結(jié)果顯示,感染HP的胃黏膜組織中TLR2 mRNA和蛋白的表達量發(fā)生了一定程度的改變,免疫組化的結(jié)果也證實了這一點。與正常陰性和乙酸陽性對照組相比,HP感染30 d組的胃黏膜組織中TLR2基因和蛋白相對表達量最高。HP感染7 d組TLR2基因和蛋白相對表達量高于HP感染14 d組和21 d組,可能是由于7 d時胃對HP沒有產(chǎn)生外界刺激反應,此時未形成潰瘍;14 d時胃對外來的HP產(chǎn)生了刺激反應,可能是機體對其產(chǎn)生了一定的抵抗作用,TLR2基因和蛋白的表達量逐漸的降低;21 d時胃黏膜逐漸發(fā)生病變,此時是潰瘍形成初期,而機體對HP產(chǎn)生的抵抗力并沒有HP外因刺激產(chǎn)生病變的程度強,TLR2基因和蛋白的表達量又逐漸的上升;30 d時胃黏膜形成潰瘍,TLR2基因和蛋白的表達量最高。
上述結(jié)果表明,HP能刺激TLR2基因和蛋白的高表達,初步推測TLR2在HP感染引起的GU的發(fā)病過程發(fā)揮了一定的作用。已有研究顯示,TLR2的表達隨HP感染在胃體區(qū)域中的表達而上調(diào)[19],與本試驗結(jié)果相符。有學者對不同種族的胃活檢樣本進行研究,結(jié)果發(fā)現(xiàn),TLR2與GC風險增加有關(guān)[20]。免疫組化研究表明,TLR2在HP感染患者的頂端區(qū)域表達顯著增加[21]。Mirkamandar等[22]探討HP感染與消化性潰瘍(Peptic ulcer,PU)之間的關(guān)系,發(fā)現(xiàn)TLR2基因中的rs3804099與HP感染和PU存在相關(guān)性。Lagunes-Servin等[23]證實了HP具有在兒童感染早期通過胃上皮細胞增加TLR的體內(nèi)表達的能力。以上結(jié)果表明,HP能刺激TLR2基因和蛋白的高表達。
綜上,TLR2 mRNA和蛋白表達量在正常組及乙酸組中明顯低于HP感染30 d組,說明TLR2參與了HP致GU的發(fā)病過程并發(fā)揮了一定的作用,但在HP致GU、GC發(fā)病中的確切作用,還需進一步的研究。

