豬多病原混合感染的實驗室診斷
崔曉純 , 魏婧潔 , 張啟龍 , 張永紅 , 胡 格, 楊佐君
(1.北京農學院動物科學技術學院 , 北京 昌平 102206 ; 2.北京市動物疫病預防控制中心 , 北京 大興 102629)
豬繁殖與呼吸綜合征(Porcine reproductive and respiratory syndrome,PRRS)是危害我國養豬業的頭號豬病,自1995年底于我國華北地區暴發以來,給我國養豬業帶來巨大的經濟損失,現已成為豬場“常在性”疫病。豬瘟(Classical swine fever,CSF)俗稱“爛腸瘟”,是由黃病毒科豬瘟病毒屬的豬瘟病毒引起的一種急性、發熱、接觸性傳染病,近年來的防控效果總體較好[1-4]。2017年,我國PRRS的發生情況總體平穩,但仍不穩定,有數據表明,我國豬場疫苗免疫或豬繁殖與呼吸綜合征病毒(PRRSV)感染仍然十分普遍,該病依舊是嚴重影響養豬生產的首要疫病 ; CSF在臨床上則以散發病例和非典型豬瘟為主,在散養、中小型豬場多見[2]。
北京市平谷區某養殖戶所養的保育豬,于2017年11月左右開始發病,2018年年初養殖戶決定對所養仔豬進行診治。本試驗通過常規PCR、熒光定量PCR檢測、細菌分離培養及鑒定、藥敏試驗,結合流行病學、臨診癥狀及病理變化等方法,對病豬進行了診斷。據所送檢的發病豬的確診結果,對該養殖戶提出針對性防治措施以減少損失。
1 材料與方法
1.1 背景資料及發病情況 北京市平谷區某養殖戶所養的保育豬2017年9月共產仔豬60多頭,截止到2018年1月8日,只存活10多頭,死亡率約83%。在保育階段的后期(60 d左右),仔豬體重15~20 kg時表現出臨床癥狀。發病豬臨床表現為消瘦,關節腫大,皮膚發紅、潰爛,有的皮膚有黑痂,咳喘,打噴嚏,流鼻液,腹瀉,步態不穩,昏睡等。曾用中草藥治療,但用藥后未見好轉。養殖戶每年2次給母豬免疫碩騰公司生產的高致病性豬繁殖與呼吸綜合征、豬瘟二聯活疫苗和豬偽狂犬病活疫苗,仔豬在出生20多天后免疫豬偽狂犬病活疫苗。
1.2 病理剖檢與病料采集 對送檢的1頭發病保育豬進行病理剖檢,剖檢過程中采集病變明顯的肝臟、脾臟、肺臟、腸系膜淋巴結、腹股溝淋巴結等組織并記錄病理變化。
1.3 主要試劑 TGuide S32磁珠法病毒DNA/RNA提取試劑盒,購自天根生化科技(北京)有限公司;豬瘟病毒核酸檢測試劑盒(PCR-熒光探針法)、豬繁殖與呼吸綜合征(藍耳病)病毒變異株核酸檢測試劑盒(PCR-熒光探針法),均購自廣州達安基因生物科技有限公司;VITEK革蘭陰性菌鑒定卡(GN),購自生物梅里埃公司;PCR Master Mix,購自Promega 公司;100 bp DNA Ladder (Dye Plus),購自TaKaRa公司;PCR引物由生工生物工程(上海)股份有限公司合成;藥敏紙片,購自北京天壇藥物生物技術開發公司。
1.4 病毒病原學檢測
1.4.1 病料總RNA的提取 將脾臟、肺臟、淋巴結等組織剪碎,與生理鹽水按1 kg/L的比例放入離心管,加入幾顆研磨鋼珠后放入全自動樣品快速研磨儀,70 Hz,60 s,研磨5~6次后,12 000 r/min離心1 min, 取上清后按照TGuide S32磁珠法病毒DNA/RNA提取試劑盒說明書進行操作。
1.4.2 CSFV和HP-PRRSV的熒光定量RT-PCR檢測 參照豬瘟病毒核酸檢測試劑盒(PCR-熒光探針法)和豬繁殖與呼吸綜合征(藍耳病)病毒變異株核酸檢測試劑盒(PCR-熒光探針法)的說明書進行PCR試劑準備和加樣,將熒光PCR儀按說明書設定好程序后對上述2種病毒進行熒光定量RT-PCR檢測。
1.5 細菌分離培養、鑒定及藥敏試驗
1.5.1 細菌分離和培養 無菌取病豬病變明顯的肝臟、脾臟、腸系膜淋巴結、肺臟等組織,接種于TSA培養基,37 ℃培養24 h后選擇有菌落生長的培養基,挑取菌落于TSA培養基進行劃線分離,37 ℃培養,24 h后觀察結果。再挑取單菌落,在三糖鐵培養基中穿刺劃線培養,在麥康凱培養基、SS培養基上進行鑒別培養,條件均為37 ℃培養24 h。
1.5.2 細菌染色鏡檢 挑取TSA培養基上的單菌落進行革蘭染色鏡檢。
1.5.3 生化鑒定 根據革蘭染色鏡檢結果,選擇VITEK革蘭陰性菌鑒定卡(GN),按照全自動微生物鑒定與藥敏分析儀操作規程在濁度管內制出濁度為0.5~0.63的菌液后上機進行生化鑒定。
1.5.4 PCR鑒定 分別無菌挑取3個、5個菌落,分別加到含有200 μL ddH2O的離心管內,煮沸10 min后立即放入冰水混合物中,冰水浴3 min,12 000 r/min離心2 min,以上清液作為PCR反應的模板DNA混合液。沙門菌屬的特異性PCR引物序列:上游:5′-CGATCCGAAGACCCTCAA-3′,下游:5′-CAAT-AACGCATTCAAACCT-3′,擴增片段大小為463 bp[5]。PCR反應體系參照安輝等[6]的方法。待反應結束后,于2%瓊脂糖凝膠中進行電泳,使用凝膠成像儀觀察是否有目的條帶。
1.5.5 紙片法藥物敏感試驗 用棉簽取1個菌落,用“十”字形劃線法于營養瓊脂平板表面劃均勻。將β-內酰胺類的阿莫西林,頭孢類的頭孢噻肟,氨基糖苷類的慶大霉素、鏈霉素和新霉素,四環素類的四環素,喹諾酮類的環丙沙星和氧氟沙星,共8種藥物的藥敏片分別貼于營養瓊脂平板上,用無菌鑷子壓紙片使其與培養基表面貼牢。紙片與紙片中心距離大于24 mm。貼上紙片15 min內將平板倒放于37 ℃培養箱中培養24 h后觀察結果。
2 結果
2.1 病理剖檢 送檢病豬生前消瘦、腹瀉、精神沉郁、站立不穩。剖檢結果可見肝臟表面連成片狀的出血點,腸系膜淋巴結腫大,心包積液,心臟表面有淡黃色膠胨樣物質,肺肉質變,小腸黏膜潰瘍,盲腸黏膜潰瘍,如中插彩版圖1~7。
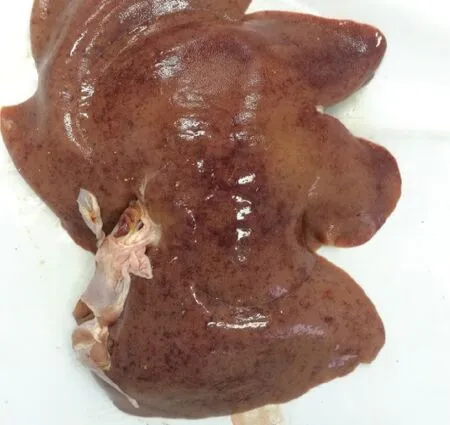
圖1 肝臟剖檢結果Fig.1 Results of liver autopsy
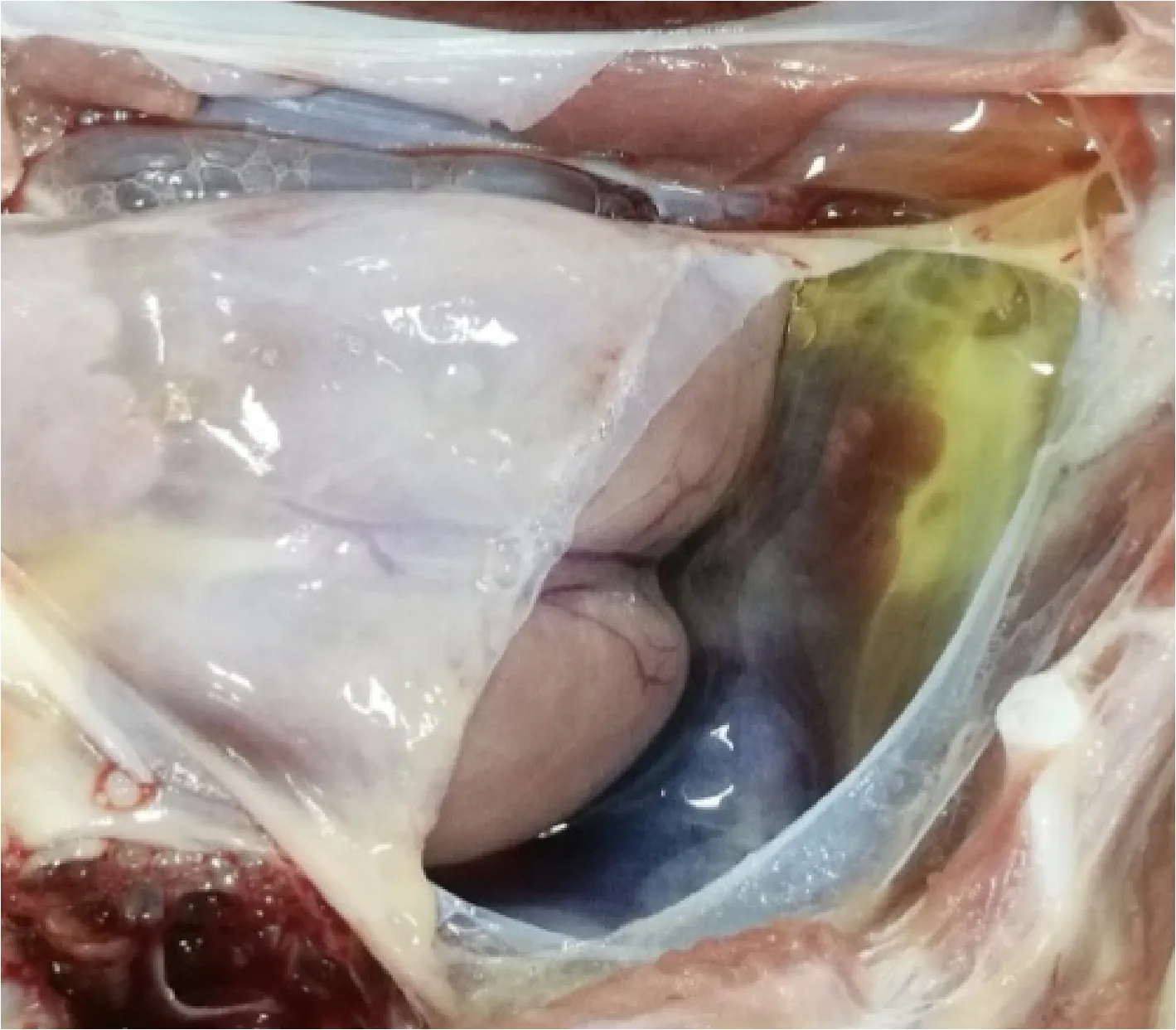
圖3 心包剖檢結果Fig.3 Results of pericardial autopsy
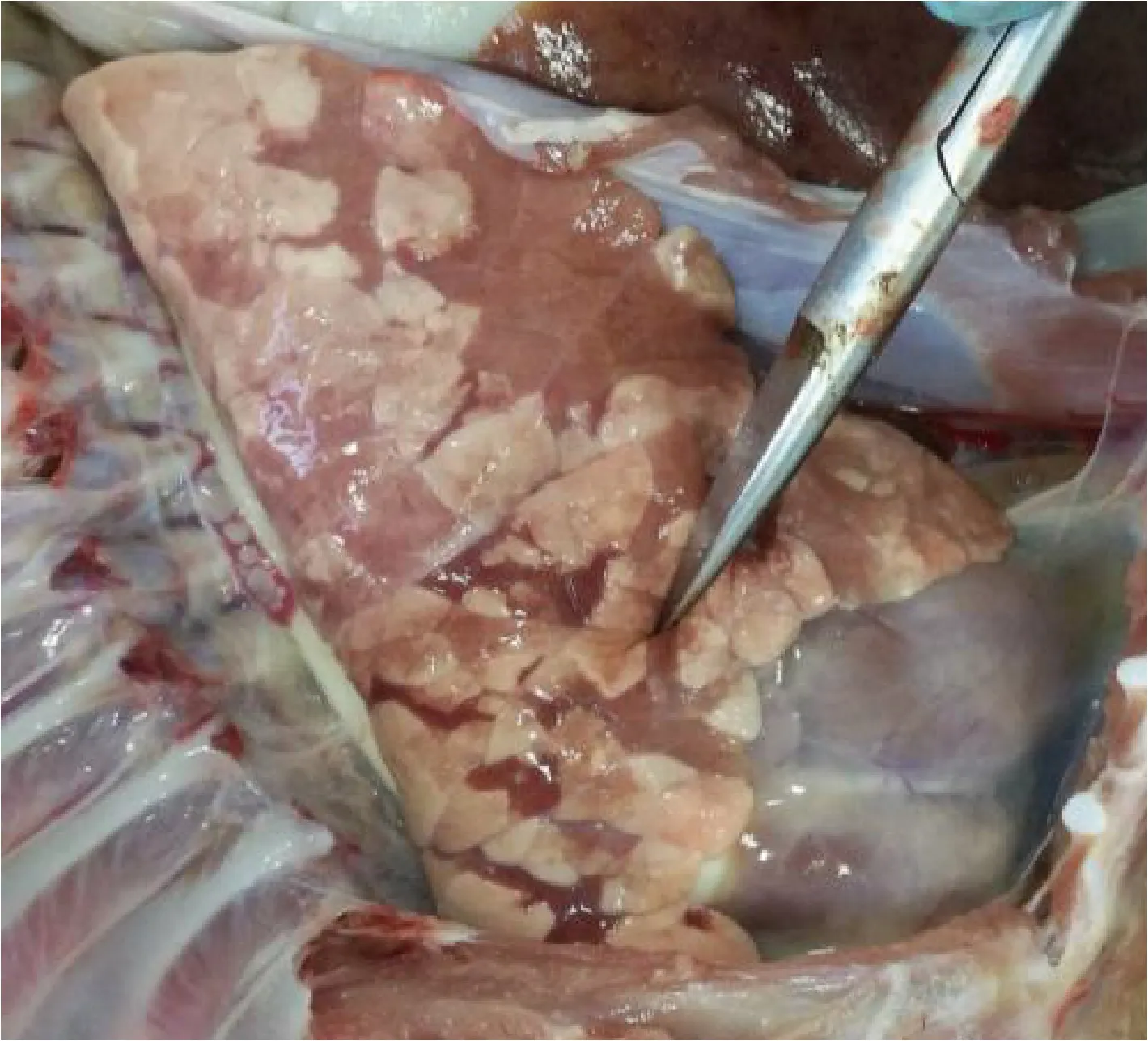
圖5 肺剖檢結果Fig.5 Results of lung autopsy
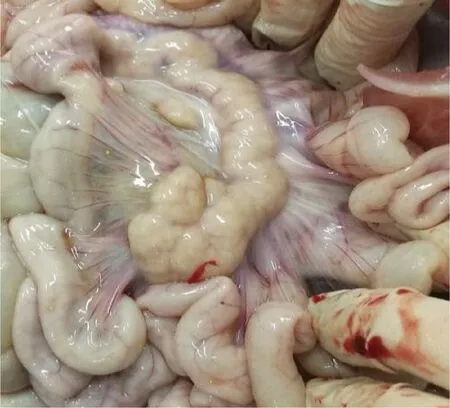
圖2 腸系膜剖檢結果Fig.2 Results of mesenteric autopsy
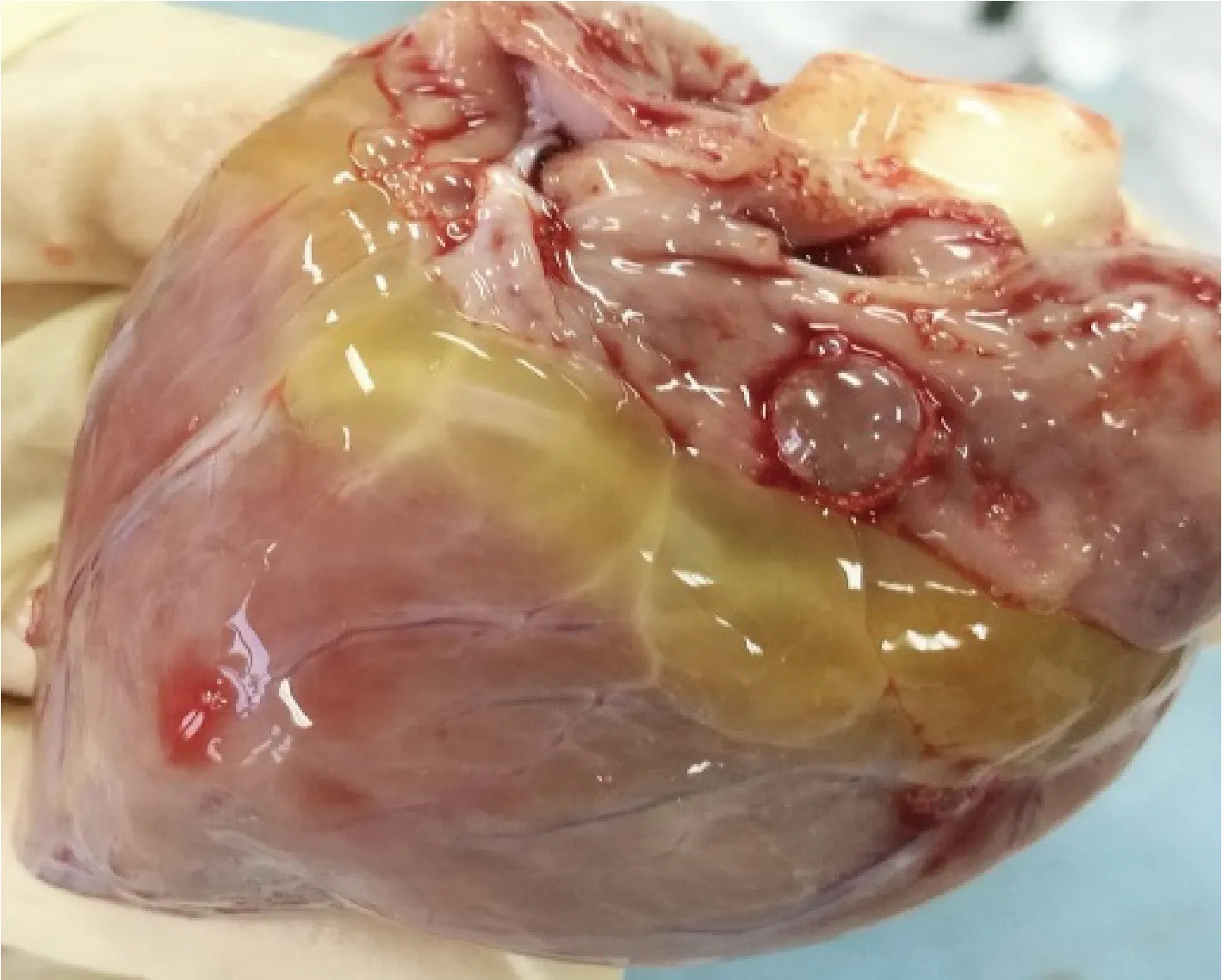
圖4 心臟剖檢結果Fig.4 Results of cardiac autopsy
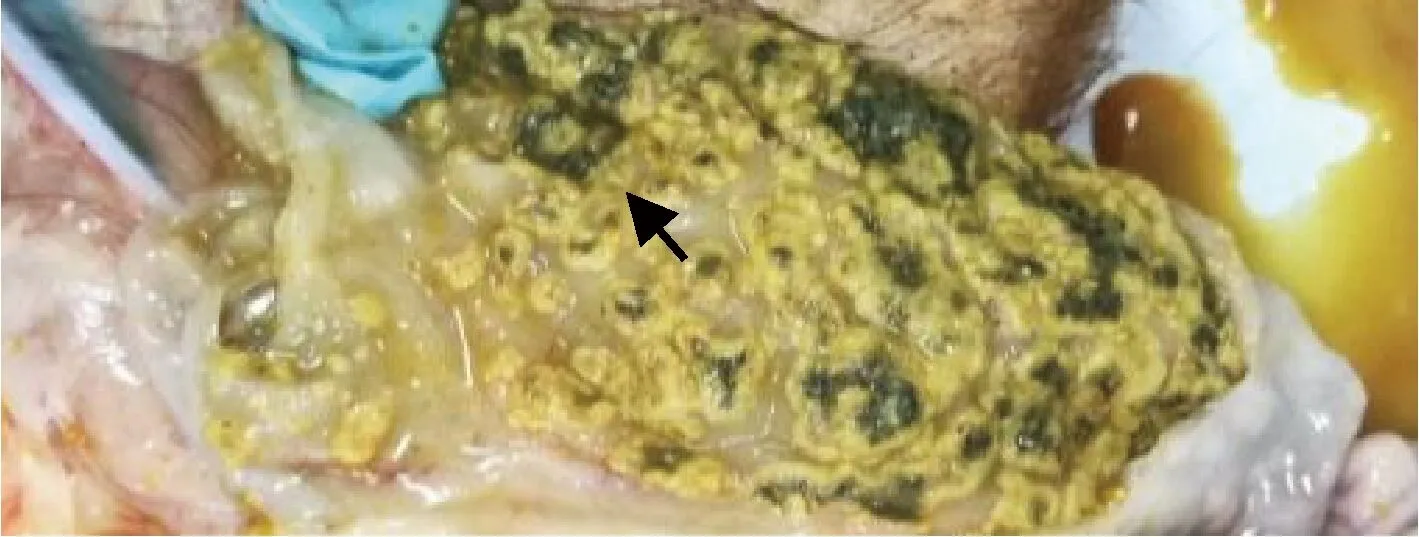
圖6 小腸黏膜剖檢結果Fig.6 Results of small intestinal mucosal autopsy
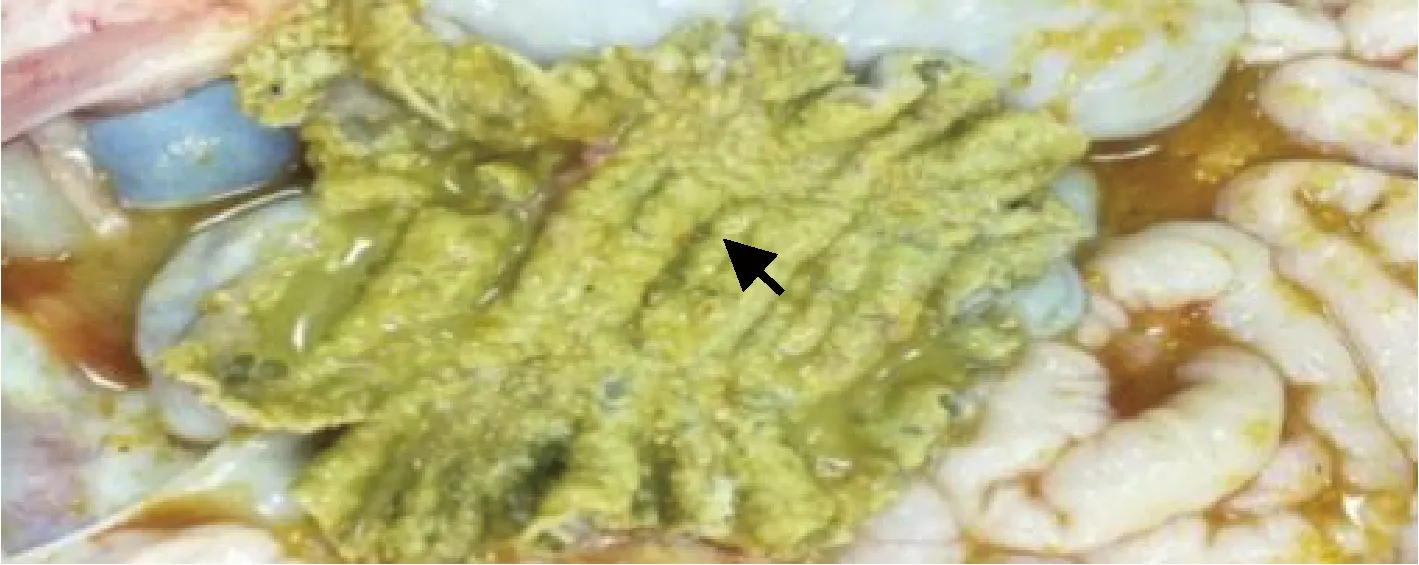
圖7 盲腸黏膜剖檢結果Fig.7 Results of cecal mucosal autopsy
2.2 病毒檢測 使用豬瘟病毒核酸檢測試劑盒(PCR-熒光探針法)和豬繁殖與呼吸綜合征(藍耳病)病毒變異株核酸檢測試劑盒對組織樣品進行熒光定量PCR檢測,結果顯示,陽性對照和組織樣品均有擴增,而陰性對照沒有擴增,見圖8。
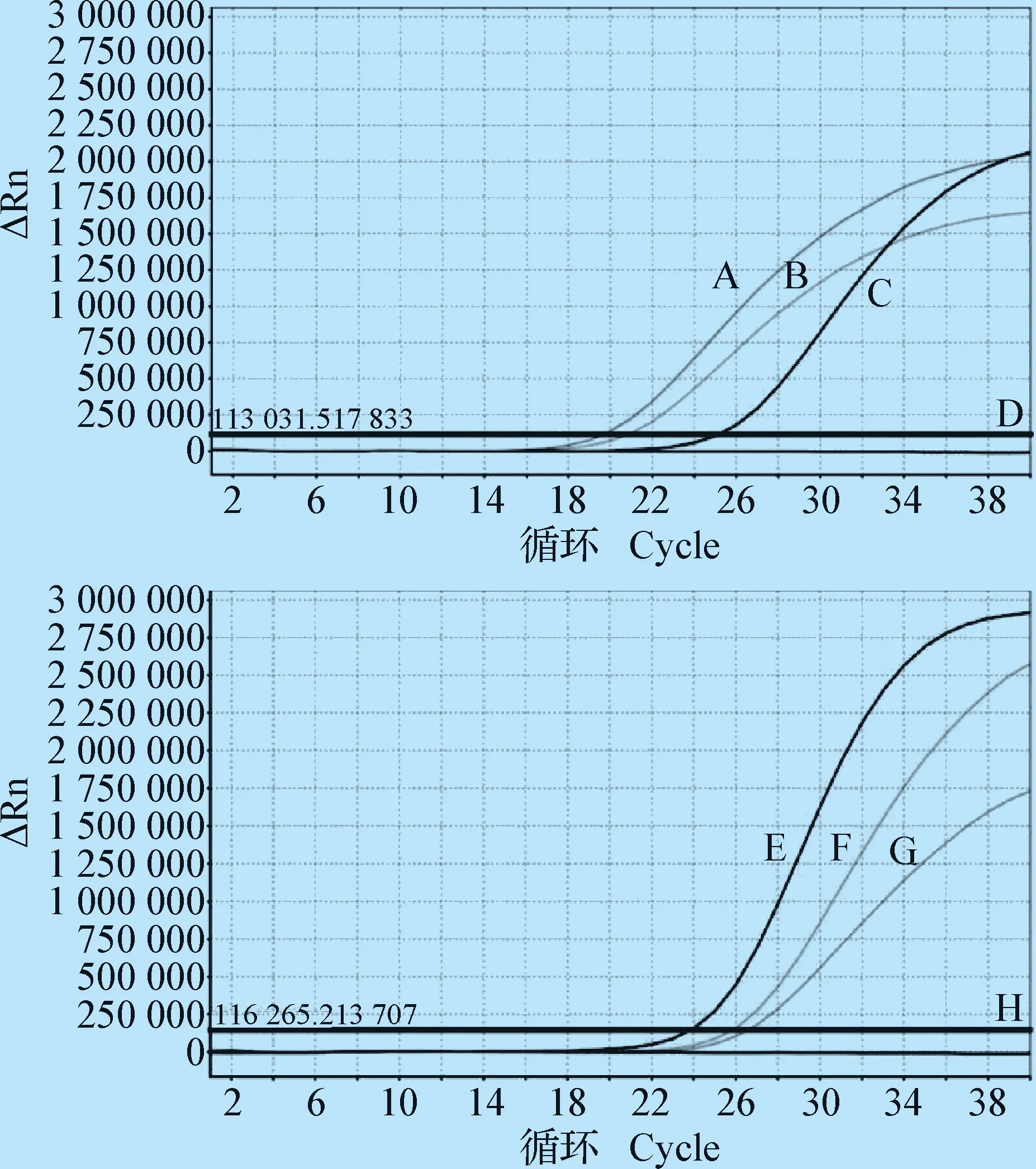
圖8 HP-PRRSV和CSFV熒光定量PCR結果Fig.8 Fluorescence quantitative PCR results of HP-PRRSV and CSFVA: CSFV陽性樣品①; B: CSFV陽性樣品②; C: CSFV陽性對照; D: CSFV陰性對照; E: HP-PRRSV陽性對照; F: HP-PRRSV陽性樣品①; G: HP-PRRSV陽性樣品②; H: CSFV陰性對照A: CSFV positive sample ①; B: CSFV positive sample ②; C: CSFV positive control; D: CSFV negative control; E: HP-PRRSV positive control; F: HP-PRRSV positive sample ①; G: HP-PRRSV positive sample ②; H: CSFV negative control
2.3 細菌分離培養及鑒定
2.3.1 細菌分離和培養 肝臟和腸系膜淋巴結組織所接種的TSA培養基上,形成了相似的菌落;其他組織接種的培養基上沒有菌落生長。TSA培養基上的菌落形態為細小的圓形、表面光滑、乳白色、邊緣整齊、濕潤的菌落。分別挑取來自肝臟和腸系膜淋巴結組織的菌落,穿刺劃線接種于三糖鐵培養基,并在麥康凱培養基和SS培養基上進行鑒別培養。2個組織來源的菌落,在各個培養基中培養結果表現一致,均為三糖鐵培養基斜面為紅色(產堿)、底層為黃色(產酸)、培養基部分變黑(產硫化氫)、不產氣;麥康凱培養基上形成細小的圓形、表面光滑、透明、邊緣整齊、濕潤的菌落;在SS培養基上形成細小的圓形、表面光滑、透明、邊緣整齊、濕潤且中心為黑色的菌落。
2.3.2 細菌染色鏡檢 分別挑取TSA培養基上來源于肝臟和腸系膜淋巴結組織的單個菌落進行革蘭染色并鏡檢,均見革蘭染色陰性、中等大小的直桿狀細菌,如中插彩版圖9。
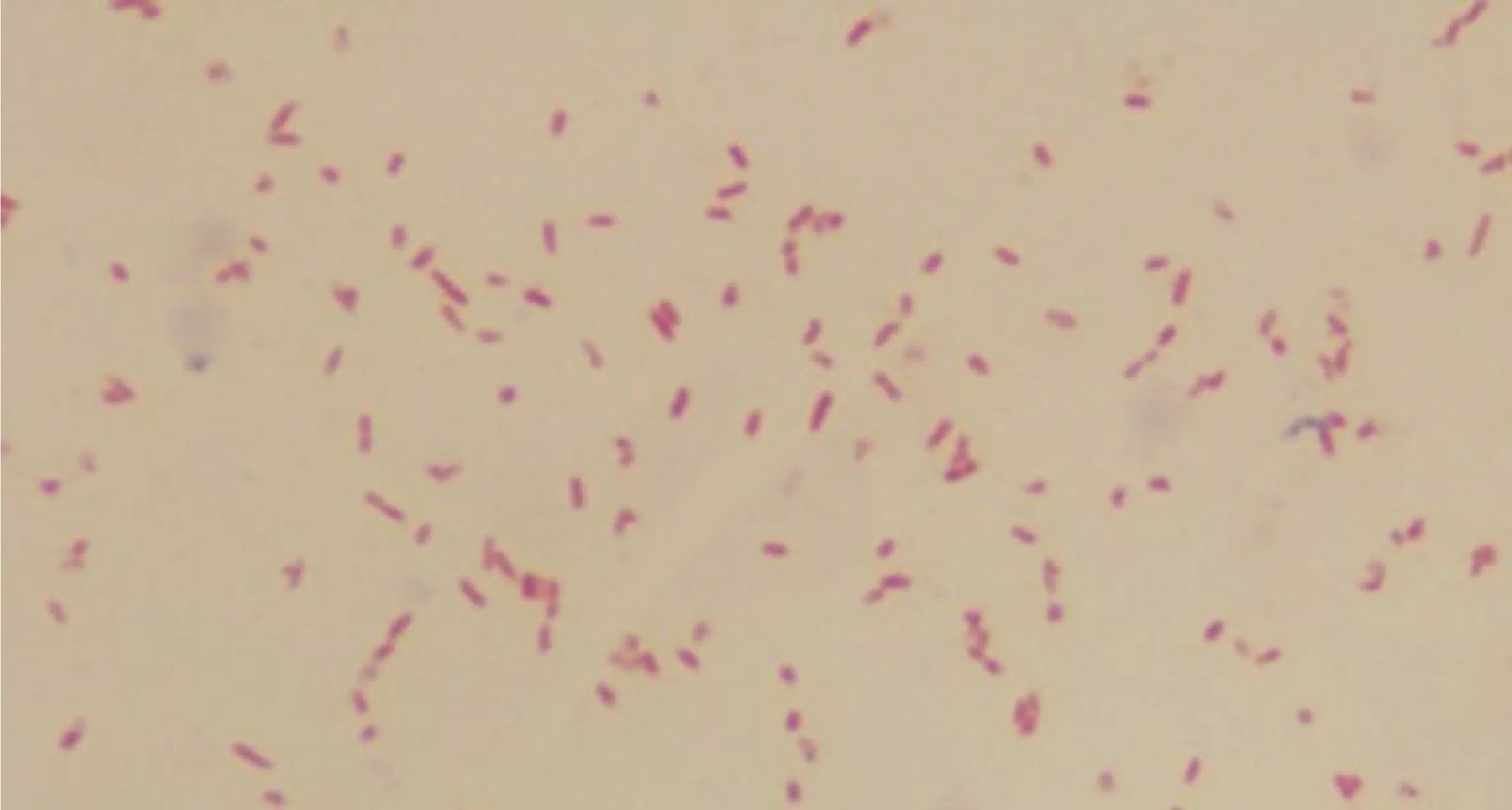
圖9 沙門菌革蘭染色結果 (100×)Fig.9 Gram staining results of Salmonella (100×)
2.3.3 生化試驗 來自肝臟和腸系膜淋巴結的分離純化菌落,經全自動微生物鑒定與藥敏分析儀鑒定,均為沙門菌,可信度為99%。
2.3.4 PCR鑒定 PCR擴增出約463 bp的特異性條帶,結果條帶與目的條帶片段大小一致,見圖10。
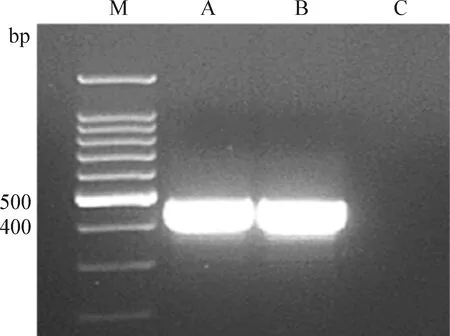
圖10 PCR產物瓊脂糖凝膠電泳結果Fig.10 Results of agarose gel electrophoresis of PCR productsM: 100 bp DNA lander; A、B:分離菌株; C:陰性對照M: 100 bp DNA lander; A、B: Isolated bacterial strain; C: Negative control
2.3.5 藥物敏感試驗 該菌對阿莫西林、慶大霉素、氧氟沙星敏感;對頭孢噻肟、鏈霉素、新霉素、環丙沙星中度敏感;對四環素耐藥。
3 討論
根據發病豬呼吸困難等臨床癥狀,肺肉樣變、肝臟表面出血點、腸黏膜潰瘍等病理剖檢表現和熒光定量RT-PCR檢測結果,確定病豬存在HP-PRRSV、CSFV 感染[7];分離到的細菌可在麥康凱、SS培養基上生長,確定感染細菌為腸道菌;根據其培養特性、形態及染色特性、生化鑒定以及PCR鑒定結果,確定分離得到的細菌為沙門菌[8],且對氧氟沙星、慶大霉素、阿奇霉素敏感。由此確診病豬為HP-PRRSV、CSFV 和沙門菌混合感染所致。
PRRSV和CSFV 感染豬后均可損壞其免疫系統,導致免疫抑制,2種病毒的共感染具有明顯的協同致病作用。HP-PRRSV 的出現及其與CSFV的共感染常伴隨其他病原微生物的混合感染或/和繼發感染,明顯提高了豬群的發病率和死亡率,給養豬業帶來巨大的威脅[9]。PRRS和CSF 都是豬易感的病毒性傳染病,2種疾病混合感染大大提高了檢測難度,且臨床中2種疾病引起的臨床表現極其相似,確診需借助實驗室檢測方法,PCR 檢測方法具有敏感性高、特異性好等優點,是目前疾病診斷最簡單、最準確可靠的檢測方法,在基層動物疾病檢測中得到了廣泛應用[10]。鑒于此,本試驗采用PCR 方法結合實驗室檢測法對病例進行了確診,為豬場后期及時采取預防和治療措施提供了保障。對于PRRSV和CSFV的防控都以疫苗免疫為主,在疫苗接種時要注意免疫途徑和免疫劑量,防止發生免疫失敗。同時在臨床治療時應選用敏感抗生素控制細菌的繼發感染。
無論是規模化養豬場,還是農村小規模養殖場和散養戶,對于疫病的防控均要貫徹“預防為主”的方針,加強飼養管理,搞好環境衛生。堅持自繁自養和全進全出的原則;同時保證豬群充足的營養,減少應激;豬舍保持良好的通風和適宜的溫度、濕度;定期消毒,交替使用消毒藥,防止耐藥菌株的產生。只有這樣才能最大限度地減少各類疫病的發生,最大限度地減少經濟損失[11]。

