PEG介導的假禾谷鐮孢菌GFP遺傳轉化體系的建立
閆佩瑤,張莉,王明玉,于海濤,于金鳳
(1.山東農業大學植物保護學院,山東 泰安 271018;2.濰坊市農業科學院小麥研究所,山東 濰坊 261041)
小麥莖基腐病(wheat crown rot)是一種典型的土傳性真菌病害,在小麥整個生育期均可發病,后期出現枯白穗等癥狀,分布范圍廣、危害嚴重[1,2]。小麥莖基腐病由多種鐮孢屬真菌(Fusariumspp.)引起,因不同地區種植條件差異,引起該病害的主要致病菌也不同[3]。Burgess等[4]調查表明,假禾谷鐮孢菌(F.pseudograminearum)為澳大利亞東部地區小麥莖基腐的主要致病菌。在意大利[5]、伊朗[6],其主要致病菌為黃色鐮孢菌(F.culmorum)。近幾年,我國也對小麥莖基腐病優勢病原菌進行了相關報道。張向向等[7]發現黃淮地區病原菌主要由亞洲鐮孢菌(F.asiaticum)和禾谷鐮孢菌(F.graminearum)組成,且以亞洲鐮孢菌種群為主。周海峰等[8]也對來自黃淮麥區多個省份的小麥莖基腐病株進行鑒定,發現禾谷鐮孢菌占比最大,假禾谷鐮孢菌次之。孟程程[9]采集山東小麥莖基腐病發病樣本,結果表明,假禾谷鐮孢菌占74.7%,是引起山東省小麥莖基腐病的主要致病菌。
熒光標記蛋白作為一類標記蛋白,被廣泛應用于研究植物與微生物的相互作用以及在不同環境條件下檢測微生物定殖情況等領域[10]。綠色熒光蛋白(green fluorescent protein,GFP)是一類在腔腸動物體內發現的生物發光蛋白[11]。Shimomura等[12]首先從水母(Aequoria victoria)中分離出GFP。此后,Prasher等[13]克隆了GFP基因的cDNA序列并對其構成進行了研究。之后Chalfie等[14]發現GFP能夠在多種真核和原核生物中表達。自從GFP首次在大腸桿菌和線蟲中被成功表達出來[13],又不斷在其他異源生物中被表達出來[14-16],該蛋白便成為現代生物化學研究中最重要的工具。通過熒光蛋白標記病原菌,能夠在熒光顯微鏡下清楚、直接地觀察到病原菌菌絲和孢子位置,為病原菌的檢測、侵染部位觀察以及抗性植株的篩選提供了有效手段,具有廣闊的應用前景[17]。基于此,本研究對假禾谷鐮孢菌進行原生質體制備,優化PEG介導的假禾谷鐮孢菌遺傳轉化方法,利用熒光顯微鏡進行假禾谷鐮孢菌侵染小麥莖部觀察,初步了解假禾谷鐮孢菌侵染小麥過程,以期為小麥莖基腐病的防控提供參考。
1 材料與方法
1.1 試驗材料
供試菌株:假禾谷鐮孢菌WHF104、大腸桿菌DH5α,均由本試驗室保存。
供試品種:濟麥22。
供試質粒:pBARGPE1。
GFP擴增引物:5′-CACCTTGATGCCGTTCTTCTG-3′,5′-GGCAGTAAGCGAAGGAGAATGT-3′。
1.2 培養基
試驗過程中所用培養基及配制方法如表1所示。

表1 試驗所用培養基配制方法
1.3 試驗試劑
CTAB抽提液:CTAB 4 g,0.5 mol/L EDTA(pH=8.0)8 mL,NaCl 16.36 g,ddH2O 200 mL,121℃高壓蒸汽滅菌25 min。
0.5mol/L Tris-HCl(pH=8.0):Tris 30.25 g,ddH2O 400 mL,濃鹽酸8 mL,冷卻至室溫,加濃鹽酸至pH=8.0,去離子水定容至500 mL,121℃高壓蒸汽滅菌25 min。
0.5mol/L Tris-HCl(pH=7.0):Tris 30.25 g,ddH2O 400 mL,濃鹽酸20 mL,冷卻至室溫,加濃鹽酸至pH=7.0,去離子水定容至500 mL,121℃高壓蒸汽滅菌25 min。
50×TAE電泳緩沖液:Tris 242 g,冰醋酸54.1 mL,0.5 mol/L EDTA(pH=8.0)100 mL,去離子水定容至1 000 mL。
5 mg/mL肝素鈉:肝素鈉0.1 g,加去離子水至200 mL,過濾除菌,分裝后-20℃保存。
50 mg/mL hyg B(hygromycin B):潮霉素B 2 g,加去離子水至10 mL,過濾除菌,-20℃保存。
40% SPTC:PEG-4000 40 g,STC溶液定容至100 mL,過濾除菌,-20℃保存。
原生質體酶解液:Driselase 250 mg,Lysing 50 mg,加0.7 mol/L的NaCl至10 mL,磁力攪拌器攪拌溶解,4 000 r/min離心6 min,吸取上清液,過濾除菌(現配現用)。
1.4 假禾谷鐮孢菌原生質體的制備與GFP轉化
1.4.1 假禾谷鐮孢菌原生質體的制備 取活化好的假禾谷鐮孢菌菌落邊緣菌塊于100 mL CMC培養基中,25℃、175 r/min培養5 d。用滅菌單層濾布過濾,收集濾液于離心管中,室溫3 700 r/min離心7 min。棄掉上層離心液,并加入100 mL YEPD培養基,25℃、175 r/min振蕩培養12 h。用滅菌三層擦鏡紙過濾,收集菌絲并用氯化鉀溶液清洗3次。用滅菌濾紙擠壓干水分,并稱取0.5 g加入滅菌的50 mL離心管中待用。加入酶解液,慢慢搖勻,30℃、100 r/min振蕩培養2 h。滅菌濾布過濾后用氯化鉀溶液洗凈,收集濾液,10℃、4 000 r/min離心10 min。棄上清留沉淀,用氯化鉀溶液重懸,4℃、4 000 r/min離心2 min。棄上清,加入1 mL STC溶液重懸,4℃、4 000 r/min離心2 min。棄上清,再用800μL STC溶液重懸,并緩慢加入120μL的40% SPTC溶液,冰上靜置。
1.4.2 PEG介導的假禾谷鐮孢菌原生質體轉化將5μL肝素鈉和75μL目的質粒溶液加入到上述產物中,冰上靜置20 min。加入1/3體積(200μL)的SPTC溶液,輕柔混勻,于室溫放置30 min。倒入50 mL無菌離心管中,并加入10 mL TB3培養液,室溫靜置2 h后,30℃、90 r/min揺培12 h。將其加入30 mL 45℃左右的Bottom Agar培養基中,并加入抗生素(Hyg B 50μg/mL,Amp 100μg/mL),倒板,25℃培養1 d后再在上面倒入Top Agar培養基,培養2~4 d后挑單菌落到含有潮霉素抗性的PDA平板上。
1.5 轉化菌株總DNA的提取
采取CTAB法提取菌株DNA[18],采用GFP基因特異性引物進行擴增,擴增體系:模板DNA 1μL,2×Phanta Max Buffer 12.5μL,引物(100 μmol/L)各1μL,ddH2O定容至25μL。擴增程序:95℃3 min;95℃30 s,56℃30 s,72℃40 s,35個循環;72℃10 min。擴增產物采用1%瓊脂糖凝膠電泳進行檢測。
1.6 轉化菌株遺傳穩定性分析
用滅菌牙簽挑取轉化菌株外圍菌絲至載玻片,并用移液槍吸取少量孢子至載玻片,加少量無菌水,熒光顯微鏡下觀察菌絲及孢子的熒光情況。將獲得的轉化菌株PDA平板連續培養5代,轉接到含有抗生素的平板上,熒光顯微鏡下觀察菌絲及孢子。
1.7 轉化菌株致病性測定
從轉化菌株中隨機挑選4個菌株接種到麥粒培養基上,25℃培養14 d后取出晾干。濟麥22于培養皿中催芽3 d后播種于花盆中(底部直徑15 cm),花盆中加入滅菌土,每盆播種10粒種子,每處理3次重復。在播種小麥種子周圍每盆撒施兩顆帶菌麥粒,以接種野生型菌株作為對照。接種3周后調查病情指數。
滅菌土的制備:將土樣雜質清除干凈,再將兩倍體積的土與一倍體積的基質混合均勻,分裝到滅菌袋中,高溫滅菌,冷卻后備用。
1.8 轉化菌株不同溫度下對小麥侵染試驗
將濟麥22催芽3 d后播種,每盆10粒,每處理重復3次。將熒光蛋白標記假禾谷鐮孢菌接種于麥粒培養基上培養。在播種小麥種子周圍每盆撒施兩顆帶菌麥粒,分別放入10、15、20℃的光照培養箱中,除溫度不同其他條件一致。對照不接種帶菌麥粒。培養10 d后將麥苗連根挖出,保持根系完整,并用清水洗凈。用體視熒光顯微鏡觀察不同溫度下假禾谷鐮孢菌對小麥莖部侵染情況。
1.9 轉化菌株不同天數下對不同包衣處理小麥侵染試驗
供試種衣劑為酷拉斯(苯醚甲環唑、咯菌晴、噻蟲嗪,三元復配,瑞士先正達作物保護有限公司)和奧拜瑞[戊唑醇、吡蟲啉,拜耳作物科學(中國)有限公司],每100 kg種子用量均為300 mL。
選取籽粒飽滿的濟麥22種子,在播前3 d按照不同種衣劑要求的包衣比例對麥種分別進行包衣。每盆播10粒,每處理重復3次。在播種小麥種子周圍每盆撒施兩顆帶菌麥粒,以無種衣劑包衣、接菌處理以及無種衣劑包衣、不接菌處理為對照。20℃光照培養,分別在7、14、21 d每處理取3株麥苗連根挖出,保持根系完整,并用清水洗凈。在體視熒光顯微鏡下觀察假禾谷鐮孢菌在不同溫度下對小麥莖部侵染情況。
2 結果與分析
2.1 假禾谷鐮孢菌GFP轉化菌株的驗證
熒光顯微鏡觀察結果(圖1)表明,轉化菌株的菌絲和孢子都能發出明亮的熒光,證明含GFP基因的載體成功轉入假禾谷鐮孢菌中,并可以正常表達(圖1B、D)。將轉化子在不含潮霉素B的PDA平板上連轉5代,菌株仍可正常生長并表達熒光(圖1F、H)。說明GFP基因的載體轉入假禾谷鐮孢菌后,能夠穩定遺傳表達。
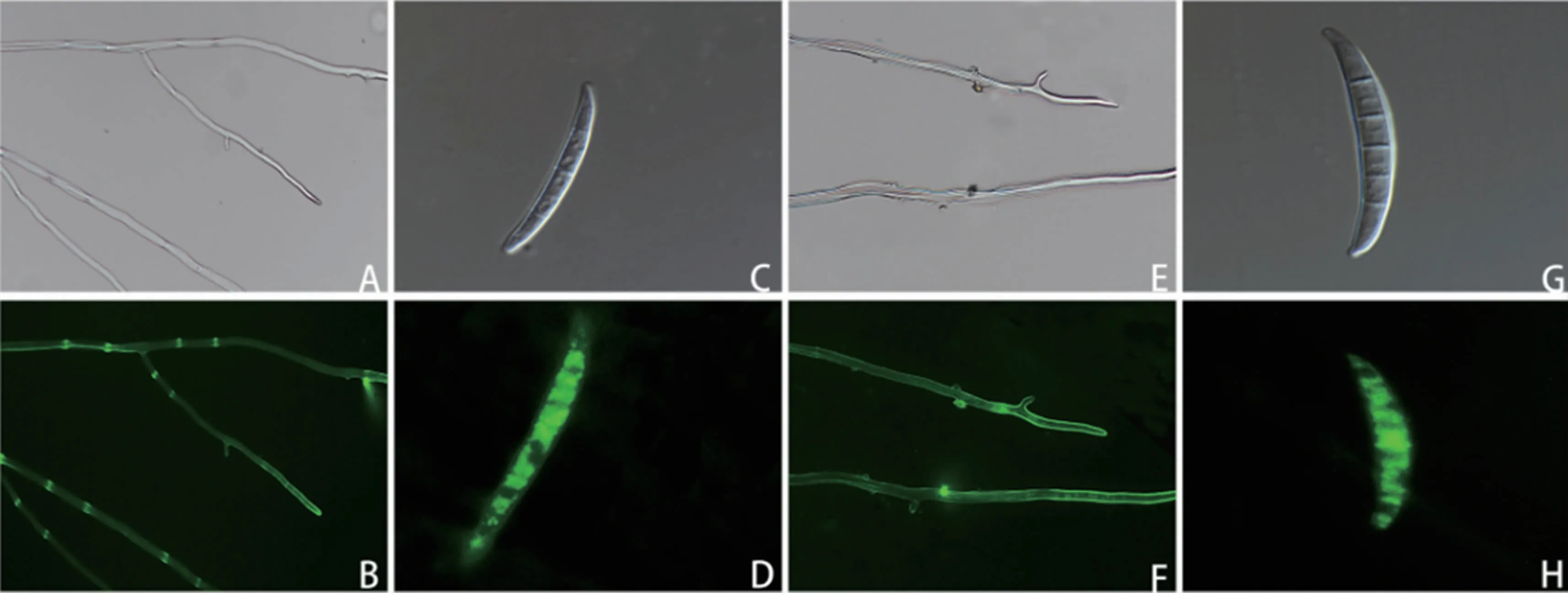
圖1 綠色熒光蛋白標記的轉化菌株菌絲及孢子的遺傳表達
PCR檢測結果(圖2)表明,隨機選取的5個轉化菌株,以GFP特異性引物進行PCR擴增,均能擴增到目的條帶(1 050 bp)。

圖2 假禾谷鐮孢菌轉化菌株的GFP基因PCR檢測
2.2 假禾谷鐮孢菌GFP轉化菌株致病性測定
隨機挑選4個菌株進行致病性測定,由圖3可以看出,轉化菌株致病力與原始菌株相比無顯著差異,小麥病情指數均大于50,說明含GFP基因的載體轉入假禾谷鐮孢菌基因組后,不影響菌株致病性。
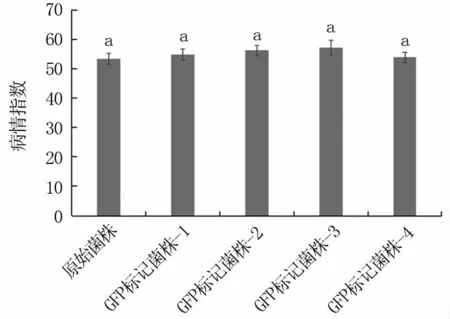
圖3 轉化菌株致病性測定
2.3 假禾谷鐮孢菌不同溫度下對小麥莖侵染的影響
由圖4可以看出,培養10 d后,假禾谷鐮孢菌在20℃光照培養條件下對小麥莖的侵染表達明亮熒光,在10℃和15℃光照培養條件下熒光微弱。表明溫度為20℃時,有利于假禾谷鐮孢菌的侵入,而在10℃和15℃則不利于病原菌的侵入。因此,可以適當推遲播期,從而降低小麥莖基腐病發病率。

圖4 假禾谷鐮孢菌不同溫度下對小麥莖的侵染
2.4 種衣劑處理對假禾谷鐮孢菌侵染小麥的影響
由圖5可以看出,前3周假禾谷鐮孢菌對酷拉斯、奧拜瑞種衣劑包衣處理小麥莖稈幾乎不侵染,莖稈只表達微弱的熒光,與無種衣劑、不接菌的小麥莖稈熒光類似。而無種衣劑、接菌處理的小麥莖稈第7 d便表現出明亮的熒光,21 d后熒光更強烈。表明種衣劑包衣處理能有效阻止假禾谷鐮孢菌在前期的侵入,從而降低小麥發病率。
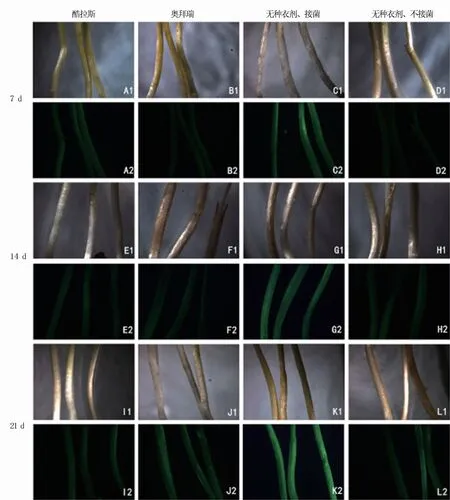
圖5 不同種衣劑處理轉化菌株在不同天數下對小麥莖的侵染
3 討論與結論
近年來,假禾谷鐮孢菌成為引起國內外小麥莖基腐病的重要致病菌[7]。缺乏抗病品種是小麥莖基腐病發生嚴重的重要原因[19]。當前對于假禾谷鐮孢菌侵染小麥的過程和致病機制等并不完全了解,建立PEG介導的假禾谷鐮孢菌遺傳轉化體系,為該病原菌致病相關基因的研究提供了一種高效便捷的方法,同時,探討其侵染小麥的過程,也為小麥莖基腐病的防治提供了新思路。
適當推遲播期能減少病原菌侵染機會,在不影響冬前形成壯苗的前提下適當晚播,可防止冬前麥苗長勢過旺、過早拔節從而遭受凍害導致小麥抗病能力下降,并在后期嚴重影響小麥的品質和產量。實際生產應從培育壯苗和防病增產兩方面綜合考慮,確定小麥播種時期[20]。本試驗采用PEG介導的原生質體轉化方法,對主要致病菌假禾谷鐮孢菌進行熒光蛋白標記,結果表明,20℃更有利于假禾谷鐮孢菌的侵入,而低溫(10℃和15℃)則不利于病原菌的侵入。
藥劑拌種不僅省時、省藥、成本低,還能有效防治小麥幼苗被侵染,保證出苗安全[21]。本研究中發現假禾谷鐮孢菌在前期很難侵入種衣劑包衣處理的小麥。表明播種前種衣劑包衣處理能夠降低小麥莖基腐病冬前發病率,減少病原菌基數和來年被侵染概率。

