急性腦梗死患者血清GLP-1 ICAM-1水平與神經損傷程度的相關性分析
張 翔, 陳薪旭, 李夏婷, 辛 宇, 范天倫
(海南醫學院第一附屬醫院神經內科一病區, 海南 海口 570102)
腦梗死又稱缺血性卒中,是因腦部血流供應障礙、缺血缺氧導致的局限性腦組織壞死,一般發生在一個月以內的腦梗死都可稱為急性腦梗死(acute cerebral infarction,ACI)。近年來,隨著人口老齡化現象加重,ACI發病率明顯上升,并具有較高的致殘率和病死率,嚴重威脅患者身心健康。研究發現,血管內皮細胞受損可能與ACI發生機制有關[1]。血清胰高血糖素樣肽-1(glucagon like peptide-1,GLP-1)具有心臟和神經保護作用,可減少炎癥和細胞凋亡[2,3]。既往研究發現[4],GLP-1預處理可降低鏈脲佐菌素誘導的腦缺血再灌注損傷的糖尿病大鼠血糖水平,改善神經評分,減小梗死體積,表明GLP-1對伴腦缺血/再灌注損傷的糖尿病大鼠具有神經保護作用。細胞間黏附因子-1(intercellular adhesion molecule-1,ICAM-1)作為一種炎性介質,參與血管內皮細胞的黏附功能,其在腦梗死中的作用近年來國內外已有報道[5],但GLP-1、ICAM-1同時在ACI患者血清中的表達關系以及與ACI患者神經損傷的關系研究尚未見報道。因此,現將研究結果報道如下。
1 資料與方法
1.1一般資料:選取2018年10月至2019年12月本院收治的ACI患者67例為研究對象,其中男38例,女29例,年齡52~64歲,平均(57.42±4.36)歲。納入標準:①均符合中華醫學會神經病學分會最新發布的《中國急性缺血性腦卒中診治指南2018》[6]中相關診斷標準;②均為急性起病;③多為局灶神經功能缺損,如一側面部或肢體無力、麻木,語言障礙等;④均經腦顱CT/MRI確診。排除標準:①非血管性病因引起的ACI;②急性腦出血、腦微血管出血等;③近3個月有手術治療史、抗凝藥物服用史;④合并嚴重心肝腎功能障礙患者;⑤合并惡性腫瘤、血液系統疾病患者;⑥存在嚴重的意識障礙患者,或美國國立衛生研究院卒中量表(national institutes of health stroke scale,NIHSS)評分>25分。同期隨機選取50名于本院體檢的健康志愿者為對照組,均排除血管性、感染性、自身免疫疾病,其中男26例,女24例,年齡49~61歲,平均(56.27±5.13)歲。所有患者及家屬均知情并自愿簽署知情同意書,本研究獲得本院倫理委員會批準同意。
1.2方 法
1.2.1一般資料:收集所有入組對象一般情況信息,包括年齡、性別、體質指數(BMI)、既往史如高血壓史、糖尿病史、高血脂癥史、冠心病史、吸煙史、飲酒史等,見表1。所有患者在入院后均接受改善腦循環、降壓降脂降糖、糾正水電解質紊亂等常規治療;根據患者具體情況給予溶栓、抗血小板凝集治療等。
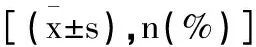
表1 研究組和對照組一般資料比較

組別例數高血脂癥史冠心病史吸煙史飲酒史研究組6719(28.36)24(35.82)25(37.31)22(32.84)對照組50--14(28.00)12(24.00)t/χ2--1.1181.084P--0.290.298
1.2.2血樣采集及檢測:所有ACI患者在入院時及治療后次日清晨抽取肘靜脈外周血5mL,對照組志愿者于體檢當天清晨抽取空腹肘靜脈外周血5mL,3000r/min離心10min后,將上清液轉移至干凈EP管,-20℃保存待測。利用酶聯免疫吸附法檢測血清GLP-1、ICAM-1水平以及S100鈣結合蛋白B(S100B)、神經元特異性烯醇化酶(NSE)。人GLP-1試劑盒(ARB11481)購自北京百奧萊博科技有限公司,人ICAM-1試劑盒(GD-S0034-B)、人NSE試劑盒(GD-S0162-B)均購自上海古朵生物科技有限公司,人S100B試劑盒(CK-E11686)購自武漢益普生物科技有限公司,檢測方法均按照試劑盒說明書步驟進行。
1.2.3神經損傷程度評價:采用NIHSS評分量表對ACI患者入院治療前及治療后神經功能損傷情況進行評分,分別從意識水平、凝視、視野、面癱、上肢運動、下肢運動、肢體共濟失調、感覺、語言、構音障礙、忽視等11個方面進行評分,以患者真實表現打分,分值越高提示神經功能損害越嚴重。其中NIHSS評分<5分為輕度組(23例),5≤NIHSS評分<20分為中度(28例),NIHSS評分≥20分為重度(16例)。
1.3觀察指標:比較研究組和對照組一般資料信息,分析ACI患者入院治療前與治療后血清指標水平及NIHSS水平差異,分析血清GLP-1、ICAM-1水平與S100B、NSE水平及NIHSS水平的相關性。

2 結 果
2.1研究組和對照組血清GLP-1、ICAM-1、S100B、NSE水平比較:研究組血清GLP-1水平明顯低于對照組(P<0.05),ICAM-1、S100B、NSE水平明顯高于對照組(P<0.05),見表2。
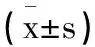
表2 研究組和對照組血清GLP-1 ICAM-1 S100B NSE水平比較
2.2不同神經損傷嚴重程度ACI患者血清GLP-1、ICAM-1、S100B、NSE水平比較:與輕度組相比,中度組、重度組ACI患者血清GLP-1水平明顯降低(P<0.05),ICAM-1、S100B、NSE水平明顯升高(P<0.05);與中度組相比,重度組ACI患者血清GLP-1水平明顯降低(P<0.05),ICAM-1、S100B、NSE水平明顯升高(P<0.05),見表3。
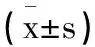
表3 不同神經損傷嚴重程度ACI患者血清GLP-1 ICAM-1 S100B NSE水平比較
2.3研究組患者治療前后血清指標水平和NIHSS評分變化:與治療前相比,治療后ACI患者血清GLP-1水平明顯升高(P<0.05),ICAM-1、S100B、NSE水平、NIHSS評分明顯下降(P<0.05),見表4。
表4 研究組患者治療前后血清指標水平和NIHSS水平變化
2.4ACI患者血清GLP-1、ICAM-1水平與S100B、NSE水平及NIHSS評分的相關性:Pearson結果顯示,ACI患者血清GLP-1水平與ICAM-1、S100B、NSE水平、NIHSS評分均呈負相關(均P<0.05),ICAM-1水平與S100B、NSE水平、NIHSS評分均呈正相關(均P<0.05),見表5。

表5 ACI患者血清GLP-1 ICAM-1水平與S100B NSE及NIHSS的相關性
3 討 論
本研究結果顯示,ACI患者血清GLP-1水平較對照組明顯降低,且與ACI患者神經損傷程度有關。GLP-1是一種肽激素,由胰高血糖素原基因的前激素轉化酶(PC1/3)翻譯后經組織特異性加工而來。大腦內的GLP-1主要由獨束核中的神經元細胞分泌,由腦內的二肽基肽酶Ⅳ(DPP Ⅳ)降解。研究發現[7],GLP-1可靶向大腦中的胰島素信號,通過提高胰島素敏感性來降低淀粉樣蛋白β(Aβ)水平,使大腦免受氧化損傷作用;并可通過血腦屏障,影響各種細胞通路,如神經炎癥、線粒體功能和中樞神經系統中的細胞增殖等[8]。Cai等[9]揭示了補充GLP-1受體激動劑lixisenatide可減少12月齡APP/PS1/tau雌性小鼠海馬內淀粉樣斑塊、神經纖維纏結和神經炎癥,通過激活PKA-CREB信號通路和抑制p38-MAPK通路發揮神經保護功能。表明GLP-1可能作為治療神經損傷的潛在靶點。本研究發現,ACI患者血清GLP-1水平在治療后明顯升高,與Shan等[10]研究結果一致,推測GLP-1水平升高可能通過改善血腦屏障破裂,降低星形膠質細胞來源的細胞因子水平等發揮保護神經功能,降低神經損傷程度。
ICAM-1是表達于細胞表面的免疫球蛋白,可作為一種血管內皮損傷標志物,當腦內血管損傷時,ICAM-1通過調節白細胞與血管內皮細胞的相互作用來促進白細胞向腦損傷區浸潤,加重炎癥反應[11,12]。本研究結果顯示,ACI患者血清ICAM-1水平明顯升高,且隨患者神經損害加重而上升,表明血清ICAM-1可反映ACI患者神經損害嚴重程度,降低其水平可能為治療ACI提供潛在輔助價值。陳龍劍等[13]研究證實,腦梗死伴隨腦微出血患者血清ICAM-1水平明顯升高,其通過介導外周血炎性細胞與血管壁接觸并在血管內皮細胞上黏附、穩定,從而激活局部炎癥反應,致使血腦屏障受損崩解,揭示了ICAM-1可能的潛在作用機制。本研究還發現,S100B、NSE水平與ACI患者神經損傷嚴重程度有關,且血清GLP-1、ICAM-1與S100B、NSE水平之間均有關,提示血清GLP-1、ICAM-1可能是反映ACI患者神經損傷嚴重程度的潛在生物指標。分析其原因,S100B作為一種重要的細胞溶質鈣結合蛋白,既往研究證實S100B在腦卒中發病后水平快速升高,且與患者梗死體積、病情嚴重程度及預后有關,可能是進展性腦缺血的標志物[14]。另有研究認為[15]NSE水平與急性腦卒中患者梗死體積有關,但不影響神經功能缺損程度及患者預后,與本研究結果有異,推測可能與種族、病例差異有關。
綜上所述,ACI患者血清GLP-1水平降低,ICAM-1水平升高,且與患者神經損傷程度有關,二者之間及與S100B、NSE之間密切相關,可能作為指示ACI患者神經損傷嚴重程度的潛在生物指標,為臨床治療ACI、減輕患者神經缺損提供潛在方向。

