miR-138-5p通過調控Survivin表達對食管鱗癌細胞活性的影響
哈斯也提·艾力,妮拉·馬哈德,帕力達·帕拉哈提,崔曉賓
食管鱗癌是消化道類惡性疾病,其發生率男性高于女性[1],食管鱗癌發病因素主要有長期進食熱燙食物、煙酒、煙熏、腌制食物、遺傳、基因突變等[2]。食管鱗癌的早期病變多限于黏膜,表現為黏膜充血、糜爛,呈斑塊兒和乳頭狀,少見腫塊。中晚期腫塊逐漸累積增加并凸入腔內穿透食管進入中隔癌細胞[3]。食管鱗癌具有強侵襲、易復發、預后差等特點。相關研究表明,基因分子對食管鱗癌的治療具有一定的效果。生存素(Survivin)是凋亡抑制因子的一種,且抑制凋亡能力較強,在正常機體中水平較低,在癌癥中水平升高,其水平的高低與腫瘤產生及發展聯系密切[4]。微小RNA在多種腫瘤的產生及發展中發揮著重要作用,可通過與其靶基因結合進而調控基因的表達,與細胞的增殖、凋亡等聯系密切,miR-138-5p是微小RNA之一,已有研究證實[5]miR-138-5p在肺癌中具有一定的作用,過表達的miR-138-5p可抑制肺癌細胞的增殖、并促進肺癌細胞的凋亡。尚未有關報道明確證實其對食管鱗癌細胞具體的作用,因此本文研究miR-138-5p通過調控Survivin的表達對食管鱗癌細胞活性的影響。
1 材料和方法
1.1 一般資料食管鱗癌細胞系EC8733、EC8501、EC109、EC9706細胞來自上海冠導生物公司。收集喀什地區第二人民醫院2018年1月至2020年1月食管鱗癌組織及其癌旁組織標本24例;男性14例、女性10例、年齡(55.65±5.18)歲、腫瘤長度<5 cm、病理分期:T1-T2期9例、T3期15例。所有食管癌患者術前均未接受過放、化療。清潔級SD大鼠20只,購自長沙天勤生物技術有限公司,鼠齡9~11周,體質量200~300 g,動物許可證號:SCXK(湘)20190018,無菌環境常溫飼養,自由飲食飲水,1周后進行實驗。本研究經醫學倫理委員會獲得批準(批號:Y2018-024-05),所有患者及家屬均簽署知情同意書。
1.2 實驗試劑胰蛋白酶(山西利德生物制品有限公司);Primer 5.0軟件(北京中科瑞泰生物科技公司);CCK-8試劑(武漢卡諾斯科技有限公司);酶標儀(山東恒美電子科技有限公司);結晶紫染色液(上海如吉生物科技發揮有限公司);流式細胞儀(江蘇新力科技實業有限公司);miR-138-5p引物、lipofectamine TM 2000脂質體(百奧邁科生物技術有限公司)。
1.3 細胞培養與分組取食管鱗癌細胞系EC8733、EC8501、EC109、EC9706細胞,運用RPMI 1640培養液培養,36 h后更換培養基。常規條件下培養,取對數期細胞進行試驗。
miR-138-5p的轉染:將細胞接種于6孔板中培養。直至細胞長到45%~55%時,按說明書操作,用lipofectamine TM 2000轉染50 nmol/L相應的miR-138-5p mimics、miR-138-5p-NC,轉染培養9 h后,更換新鮮培養液繼續培養3 d后即可進行實驗。實驗分為W組(無轉染組)、C組(食管鱗癌細胞轉染NC組)、Z組(轉染miR-138-5p組)。
1.4 動物實驗取20只大鼠,分為食管癌組(注射食管鱗癌細胞)、miR-138-5p組(注射轉染miR-138-5p食管鱗癌細胞),每組各10只。各組于右側前肢腋下注射相應0.5 mL細胞懸液建立移植瘤模型,4 d后腫瘤體積約為100 mm,表示建模成功。
1.5 檢測指標
1.5.1 RT-PCR檢測Survivin、miR-138-5p水平取W組、C組、Z組食管癌細胞及食管鱗癌組織、癌旁組織標本運用胰蛋白酶消化后提取細胞懸液,沖洗,放于無菌試管中。TRIzol法提取總RNA,Primer5.0軟件設計合成引物。將逆轉后所得的cDNA進行熒光反應實驗。所有反應嚴格按照反應的條件進行擴增,PCR反應條件:94℃、4 min;94℃、30 s;58℃、30 s;2℃、30 s。取PCR產物(5 μL)進行電泳分析(瓊脂糖凝膠1.5%),以GAPDH為內參,共40個循環,取得到的平均值后得到Ct值,計算方法用2-△△Ct法進行分析,引物序列,表1。

表1 引物序列
1.5.2 Western blot檢測取W組、C組、Z組細胞,裂解液裂解并提取蛋白,并對蛋白的濃度進行測量,分裝后,保存在-20℃的環境中。將提取出的蛋白溶液和緩沖溶液進行混均,然后將其煮沸、變性。把電泳后的50 μm蛋白移至PVDF膜上,脫脂奶粉封閉1 h。加入1抗后PBS漂洗3次,每次間隔10 min,最后加入2抗對溶液稀釋,常溫封閉1 h。取出PVDF膜,上述方法漂洗,DAB顯色后照相。
1.5.3 Transwell小室測遷移能力取W組、C組、Z組細胞,用DMEM培養液重懸后將細胞懸液(6×104/孔)加入Transwell小室的上室,下室加入1 mL含10%FBS的高糖DMEM培養液。培養72 h后取出小室,PBS漂洗2次,4%的多聚甲醛溶液固定15 min,用棉簽擦去上層細胞,加入0.1%結晶紫染色液染色15 min。自來水沖洗3次,顯微鏡拍照。實驗重復3次。
1.5.4 CCK-8檢測食管鱗癌細胞增殖情況取W組、C組、Z組細胞,離心5 min,1250 r/min,制成細胞懸液,接種于96孔板中(4×103個細胞)。分別于細胞貼壁后24、48、72 h加入CCK-8試劑,避光孵育3 h。酶標儀檢測450 nm處OD值。
1.5.5 流式細胞儀檢測食管鱗癌細胞凋亡情況
取W組、C組、Z組細胞接種于6孔板中,胰酶消化,完全培養基終止;PBS清洗,進行細胞計數,離心5 min、1250 r/min,棄上清,混入500 μLBinding Buffer(結合緩沖液)重懸。加入5 μLAnnexinV-FITC混勻、10 μL PI混勻,常規孵育15 min后,流式細胞儀檢測。
1.5.6 雙熒光素酶報告基因檢測實驗將2×105個/孔細胞接種于6孔板中,待細胞生長融合至80%時,參照LipofectamineTM2000轉染試劑說明書將構建好的Survivin′-UTR-WT和Survivin′-UTR-MUT質粒轉染miR-NC(NC組),miR-138-5p mimics(miR-138-5p組)共轉染至細胞,按照雙試劑盒操作步驟檢測各組細胞熒光素酶活性。
1.5.7 觀察各組大鼠移植瘤生長情況建模成功4周后處死大鼠,測量腫瘤病灶的長徑以及與其垂直的短徑,計算瘤體積;同時稱瘤質量,計算抑瘤率。
1.6 統計學處理采用SPSS 18.0統計軟件進行分析,W組、C組、Z組3組食管鱗癌細胞增殖、遷移、Survivin水平等影響的比較采用單因素方差分析,兩組間比較采用t檢驗,計量資料以均數±標準差(±s),P<0.05為差異有統計學意義。
2 結果
2.1 miR-138-5p、Survivin水平檢測結果miR-138-5p在食管癌組織中的表達水平低于癌旁組織(P<0.05);Survivin在食管癌組織中的表達水平高于癌旁組織(P<0.05),圖1。
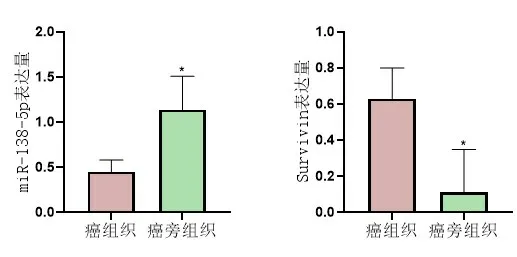
圖1 癌組織組與癌旁組織組miR-138-5p、Survivin水平比較*表示與癌組織組比較(P<0.05),實驗重復3次
miR-138-5p在食管鱗癌細胞系EC9706細胞中表達最低(P<0.05),且Survivin在食管鱗癌細胞系EC9706細胞中表達最高(P<0.05),因此選擇EC9706細胞進行本次實驗,圖2。
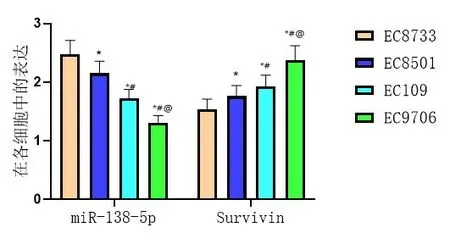
圖2 各細胞中miR-138-5p、Survivin水平表達
miR-138-5p、Survivin在W組與C組中的水平較為接近,組間比較差異無意義(P>0.05);在Z組中miR-138-5p的水平有所上升、Survivin水平有所下降,組間比較差異有統計學意義(P<0.05),由此可看出,miR-138-5p轉染成功,圖3。
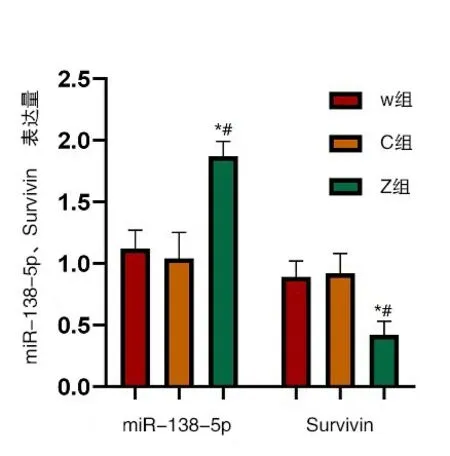
圖3 miR-138-5p、Survivin在W組、C組、Z組細胞中的水平與W組比較,P*<0.05、與C組比較,P#<0.05,實驗重復3次
2.2 Notch1、HIF-1α、MMP-9水平的檢測結果W組與C組中Notch1、HIF-1α、MMP-9水平較為接近,組間比較差異無意義(P>0.05);與W組、C組比較,Z組中Notch1水平有所升高、HIF-1α、MMP-9水平有所下降,組間比較差異有意義(P<0.05),見圖4。
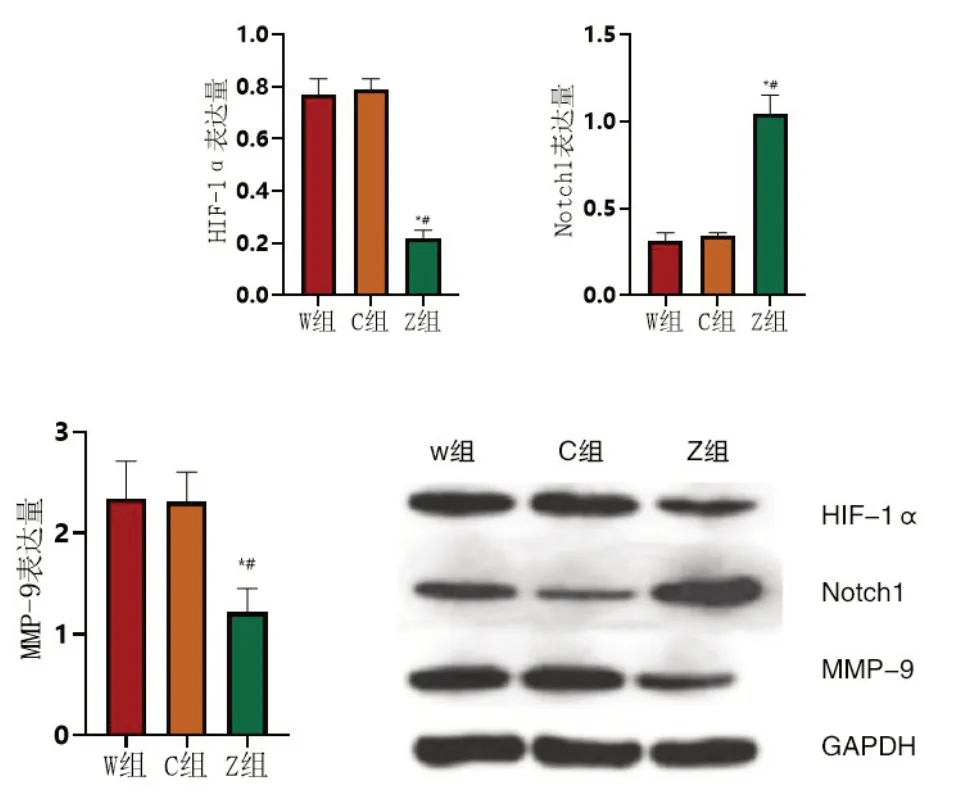
圖4 三組Notch1、HIF-1α、MMP-9水平比較
2.3 食管鱗癌細胞遷移能力W組食管鱗癌細胞遷移數量(282.67±27.65)與C組細胞遷移數量(279.31±28.22)相差較小,組間比較差異無統計學意義(P>0.05);與W組、C組比較,Z組中的遷移數量(76.57±6.71)有所降低,組間比較差異有意義(P<0.05),圖5。
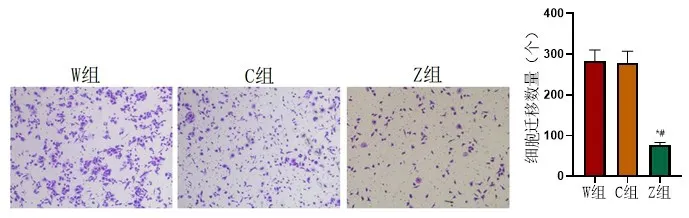
圖5 W組、C組、Z組食管鱗癌細胞遷移情況比較與W組比較,P*<0.05、與C組比較,P#<0.05,實驗重復3次
2.4 食管鱗癌細胞增殖情況W組與C組在24、48、72 h的OD值較為接近,組間比較差異無統計學意義(P>0.05);Z組在各時間點的OD值均較W組與C組低,組間比較差異有統計學意義(P<0.05),表2、圖6。
表2 三組不同時間點OD值的比較(±s)

表2 三組不同時間點OD值的比較(±s)
?
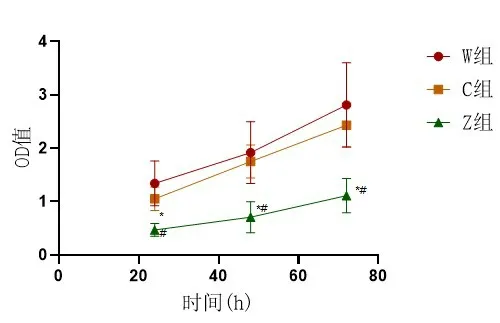
圖6 三組食管鱗癌細胞不同時間點OD值比較與W組比較(P*<0.05)、與C組比較(P#<0.05),實驗重復3次
2.5 食管鱗癌細胞凋亡情況W組食管鱗癌細胞凋亡率(2.47±0.11)%與C組食管鱗癌細胞凋亡率(2.45±0.13)%較為接近,組間比較差異無意義(P>0.05);Z組食管鱗癌細胞凋亡率(13.32±1.23)%高于W組與C組,組間比較差異有意義(P<0.05),見圖7。
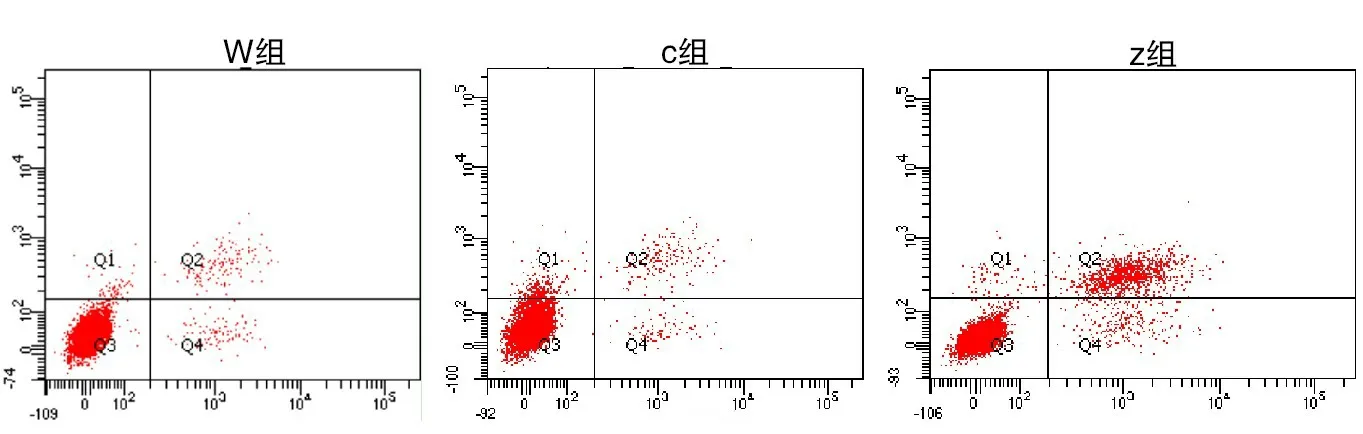
圖7 三組食管鱗癌細胞凋亡情況比較,實驗重復3次
2.6 雙熒光素酶檢測報告結果結果顯示Survivin′-UTR-WT在miR-NC組表達水平為(0.79±0.09)、miR-138-5p組表達水平為(0.59±0.07),組間比較差異有統計學意義(P<0.001);Survivin′-UTRMUT在miR-NC組(0.91±0.11)及miR-138-5p組(1.02±0.12)表達無統計學差異(P>0.05),說明Survivin是miR-138-5p的直接靶點,圖8。
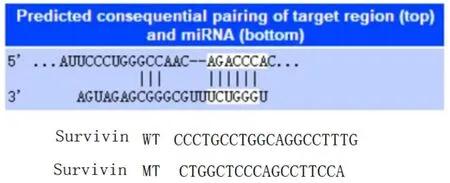
圖8 熒光素酶報告圖
2.7 各組移植瘤生長情況與食管癌組比較,miR-138-5p組大鼠移植瘤的瘤體積、瘤質量降低,抑瘤率升高(P<0.05),見表3。
表3 各組大鼠移植瘤生長情況(±s)

表3 各組大鼠移植瘤生長情況(±s)
?
3 討論
目前,中國是食管鱗癌的高發地區,發病率位列惡性腫瘤的第四位,且有逐年增長的趨勢[6]。威脅患者的生命健康安全,尋求新的食管癌分子靶向治療方法迫在眉睫,因此本文運用miR-138-5p調控Survivin對食管鱗癌進行治療,具體分析如下。
在腫瘤的產生與發展過程中,微小RNA通過調節基因的表達,從而調控細胞的生物活性,間接發揮促癌或抑癌的作用,已有研究證實[7]微小RNA在多種腫瘤中參與癌細胞的增殖、遷移等,miR-138-5p是miRNA的 一 種。miR-138-5p可通過 靶 向調控其下游基因進行調控細胞的生物活性,Survivin是miR-138-5p的下游基因之一,可直接作用其上下游分子,對細胞凋亡途徑具有抑制作用,在正常機體中水平較低,在癌癥中水平升高,其水平的高低與腫瘤的產生與發展密切相關,是抑制細胞凋亡的重要基因之一[8-9]。經本文研究發現在經過轉染miR-138-5p模擬物后,miR-138-5p水平有所增加,Survivin水平有所下降。YangR等[10]研究提示,miR-138-5p與Survivin為負相關,miR-138-5p直接識別并結合Survivin mRNA轉錄,從而抑制Survivin在膀胱癌細胞中的作用,降低癌細胞的增殖與侵襲能力。張志明等[11]對前列腺癌的實驗研究中提出,基因敲除SIRT1靶向結合miR-138-5p具有促進癌細胞凋亡的作用。本文研究與上述研究結果相似。且本文熒光酶報告結果、以及動物實驗結果表明轉染miR-138-5p具有一定的抑瘤作用。
Notch信號通路可調控細胞的分化,根據近年來的研究發現[12-13],Notchl信號還與腫瘤的產生密切相關,其表達水平的變化還起著抑癌或促癌的作用;有關研究指出[14-15],當小鼠體內的Notchl被敲除時,小鼠的皮膚發生增殖、基地細胞樣癌形成,其原因與Notchl信號通路被激活引起與細胞凋亡相關途徑發生改變有關。HIF-1α是一種調控細胞增殖和血管進化相關基因轉錄的重要因子,在多種腫瘤中均呈現高表達[16]。miRNA具有轉錄后調控因子水平的作用,多項研究已證實miR-138-5p與HIF-1α具有一定的相關性[17]。腫瘤細胞或周圍間質細胞可分泌出MMP,可降解細胞外基質以及細胞間的黏附、促進新生血管生成從而增加癌細胞的活性,MMP-9是金屬機制蛋白酶之一,且其與腫瘤的發生發展密切相關[18-19]。miR-138-5p定位于chr16染色體,在多種腫瘤中均為低表達,發揮抑癌作用,對腫瘤細胞的增殖、遷移具有一定的抑制作用[20]。經本文研究表明,經過轉染miR-138-5p模擬物后,Notch1水平升高,HIF-1α、MMP-9水平降低。史永亮[21]提示Notch1、Survivin在甲狀腺乳頭狀癌中呈負相關關系,與癌細胞的轉移和侵襲聯系密切。在王麗萍[22]等對試食管鱗癌的實驗中提出,Notch1與食管鱗癌的產生、發展和轉移聯系密切,可評估食管鱗癌病情的嚴重程度。趙軍華等[23]研究提示,HIF-1α是miR-138-5p的靶基因,在腎癌細胞中miR-138-5p通過靶向調控的表達HIF-1α削弱了癌細胞的增殖、侵襲并抑制了其凋亡。在劉正端等[24]對食管鱗癌細胞研究的實驗中發現,MMP-9水平升高,食管鱗癌細胞的侵襲與轉移加劇。尚雙艷[25]提示Survivin與MMP-9在胃癌中具有正相關關系。本文研究與上述研究結果相似,均認為提高Notch1的表達,降低HIF-1α、MMP-9水平可抑制腫瘤發展,因此本文推測,miR-138-5p通過靶向調控Survivin及HIF-1α的表達間接提高Notch1的水平,抑制了MMP-9表達,從而抑制了食管鱗癌的發展。且CCK8測增殖、Transwell小室測細胞遷移以及流式細胞儀測凋亡結果均可證實上述結論。
綜上所述,miR-138-5p可通過降低Survivin的表達,抑制食管鱗癌細胞的增殖及遷移,并促進其凋亡,其作用機制可能與HIF-1α、Notch1及MMP-9表達有關。

