非酒精性脂肪肝轉歸肝硬化患者血清瘦素及受體基因表達特征研究
馬艷芹,謝永鵬,梁旭陽,倪立顯,徐 靜,左晨艷,呂勝祥
連云港市第一人民醫院 消化內科,江蘇 連云港 222020
非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)具有可逆性,預后一般良好,但一些慢性脂肪肝(包括NAFLD)患者因脂肪肝引發肝損傷,甚至發展為具有不可逆性的嚴重疾病,如肝硬化或肝癌[1-2]。人體內,瘦素通過與Ghrelin激素(饑餓荷爾蒙)相互抵抗并作用于下丘腦弓狀核中的受體以抑制饑餓,刺激飽腹感,平衡能量[3-4]。另有研究表明,瘦素也在其他生理過程(如免疫和炎癥反應)中發揮作用[5-6]。本研究旨在探討NAFLD轉歸肝硬化患者瘦素與其受體水平的變化。現報道如下。
1 資料與方法
1.1 一般資料 選取連云港市第一人民醫院自2017年4月至2019年3月收治的125例NAFLD患者為研究對象。納入標準:符合脂肪肝的診斷標準;無飲酒史或每周飲酒量<40 g;血清轉氨酶>40 U/L,其中,以丙氨酸氨基轉移酶升高為主;影像學和組織學檢查符合NAFLD典型表現;可伴有肥胖、血糖和血脂水平異常或高血壓等代謝綜合征。排除標準:病毒性肝炎、藥物性肝病、自身免疫性肝病和各種其他肝病者;免疫功能障礙者;其他臟器嚴重疾病者。按照患者轉歸情況將患者分為A組(未轉歸為肝硬化;n=50)和B組(轉歸為肝硬化;n=75)。A組中,男性31例,女性19例;平均年齡(53.26±15.72)歲。B組中,男性49例,女性26例;平均年齡(54.18±14.75)歲;肝硬化代償期46例,失償期29例。兩組患者的性別、年齡比較,差異無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會批準。所有患者均簽署知情同意書。
1.2 研究方法 采集患者清晨空腹外周靜脈血5 ml,低溫離心后棄沉淀,將上清于-20℃保存待測。血清瘦素采取免疫放射法檢測,使用Linco公司相關試劑,并按說明書操作。采取酶聯免疫吸附法檢測血清可溶性瘦素受體(soluble leptinR,sOb-R),檢測使用R&D Systems試劑盒,操作按說明書進行。血清瘦素受體(Ob gene receptor,Ob-R)基因表達情況以逆轉錄PCR實驗表征。活檢時獲取患者肝組織樣品(1.5 cm×1.5 cm×0.2 cm),使用RNA抽提試劑盒(PureLink,Thermo Fisher,USA)提取細胞總RNA,以cDNA合成試劑盒合成的第一鏈作為模板進行逆轉錄,使用FastQuant RT試劑盒(KR106,TIANGEN,北京)和瓊脂糖凝膠電泳檢測Ob-R mRNA表達情況。相對表達量檢測使用凝膠成像系統(SYSTEM GelDoc XR,Bio-Rad)檢測。使用全自動生化分析儀(AU5800,Beckman)檢測患者空腹血糖(fasting blood-glucose,FBG)、總膽固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白膽固醇(low density lipoprotein cholesterin,LDL-C)、高密度脂蛋白膽固醇(high density lipoprotein cholesterol,HDL-C)。根據child-pugh分級將B組患者分為A、B、C 3級,A級預后相對較好,C級預后相對最差[7]。按照肝硬化分期將B組患者分為代償期與失償期。

2 結果
2.1 兩組患者血清瘦素及sOb-R水平比較 B組患者血清瘦素水平為(11.38±3.47)μg/L,高于A組的(8.55±2.06)μg/L,差異有統計學意義(P<0.05)。B組患者血清sOb-R水平為(16.23±4.11)μg/L,低于A組的(18.52±4.26)μg/L,差異有統計學意義(P<0.05)。
2.2 B組不同肝硬化分期患者血清瘦素及sOb-R水平比較 失償期患者血清瘦素水平為(12.85±3.52)μg/L,高于代償期的(9.40±2.84)μg/L,差異有統計學意義(P<0.05)。失償期患者血清sOb-R水平為(16.72±3.97)μg/L,低于代償期的(19.01±3.05)μg/L,差異有統計學意義(P<0.05)。
2.3 B組不同child-pugh分級患者血清瘦素及sOb-R水平比較 child-pugh分級C級患者血清瘦素水平高于A級、B級,差異有統計學意義(P<0.05)。見表1。
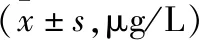
表1 B組不同child-pugh分級患者血清瘦素及sOb-R水平比較
2.4 兩組患者肝組織Ob-R mRNA表達情況比較 A組Ob-R mRNA的相對表達量為(122.75±15.28),明顯高于B組的(107.13±14.32),差異有統計學意義(P<0.05)。見圖1。
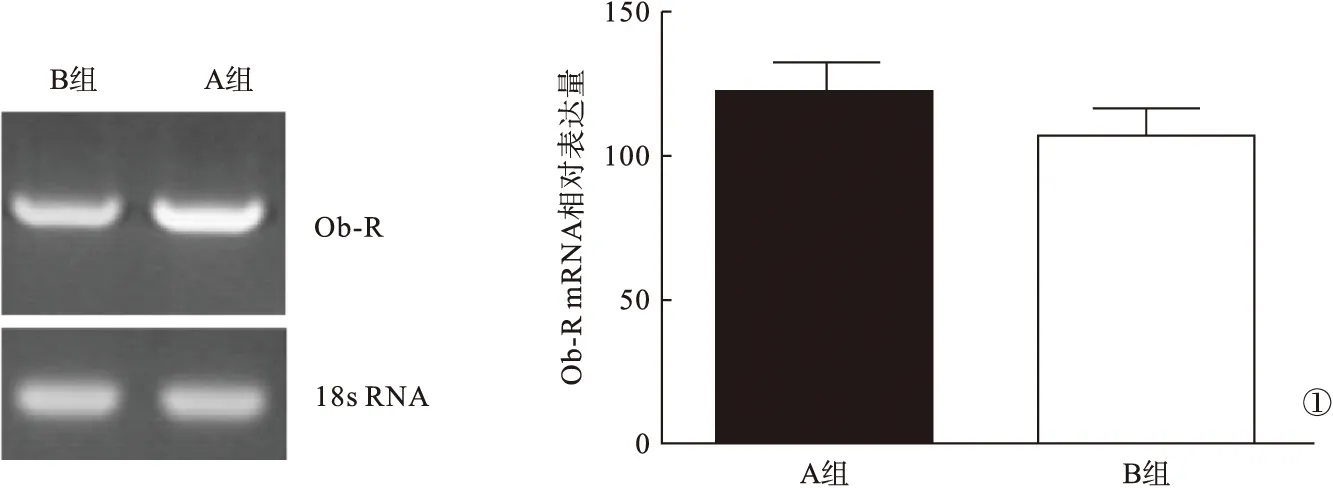
圖1 兩組肝組織Ob-R mRNA表達情況
2.5 兩組患者血液學指標比較 B組患者FBG明顯高于A組,差異有統計學意義(P<0.05)。見表2。
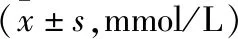
表2 兩組患者血液學指標比較
3 討論
本研究結果顯示,NAFLD發展為肝硬化患者的血清各指標水平明顯異于預后較為良好患者,其中,瘦素水平異常升高,sOb-R水平異常降低。本研究利用逆轉錄PCR檢查了Ob-R mRNA的表達情況,結果顯示,發展為肝硬化患者體內Ob-R基因表達明顯低于預后較為良好患者,與Long等[8]研究結果一致。有研究表明,在NAFLD疾病進展中,TG早期在肝細胞中積累為微泡,后逐漸增加聚為大泡狀,這一過程會對細胞造成物理損傷,并增加由于脂肪過多引起的炎癥反應,從而導致肝炎和肝纖維化[9-10]。而肥胖個體通常表現出比正常體質量個體更高的瘦素循環濃度,因此,血清瘦素升高可提示肝受損傷的程度[11]。此外,sOb-R在血清中水平降低可能是對瘦素水平異常升高的負反饋,以減少瘦素與受體的結合,從而維持代謝控制[12]。有研究報道,sOb-R經酶水解在膜外功能區脫落而進入循環,因此,sOb-R可反映Ob-R表達情況[13],與本研究結果一致,但具體分子機制仍需進下一步的驗證。
本研究分析了NAFLD發展為肝硬化的不同臨床分期及不同分級標準患者的瘦素、sOb-R水平,隨著疾病嚴重程度增加,患者血清瘦素水平升高,而sOb-R水平降低。這提示,瘦素和sOb-R水平隨著NAFLD嚴重程度(或疾病發展)而變化,血清瘦素及Ob-R表達情況可以作為NAFLD是否發展為肝硬化和表征NAFLD疾病發展的指標。NAFLD與葡萄糖和脂質代謝異常有關,包括胰島素抵抗內源性葡萄糖產生,葡萄糖處置率和脂肪組織中的抗脂肪分解[14-15]。本研究發現,B組患者FBG明顯高于A組,與上述研究結果一致。本研究存在一定的不足:本研究因為時間和病例樣本限制(活檢肝組織樣本體積較小),未將Ob-R mRNA樣本根據臨床分期和分級進行細分,因此,未顯示不同時期和分期患者mRNA表達情況。下一步將擬納入大量預后不良且擬行肝移植或部分切除手術的患者,獲取大于本研究樣本量的肝組織,根據上述分類進行再研究和分析,獲取較為可靠的分級結果。
綜上所述,NAFLD轉歸為肝硬化相較于預后良好的患者血清瘦素水平異常增高,sOb-R水平異常降低,同時伴隨FBG水平變化。

