H2S對Graves甲亢小鼠甲狀腺功能與甲狀腺濾泡上皮細胞損傷的保護作用及機制*
歐慧婷 汪新宇 余懷新 陳澤龍 李明政
(深圳市第二人民醫院內分泌科,廣州 深圳 518035)
Graves甲亢(Graves’disease,GD)是一種全身特異性自身免疫疾病,也是甲狀腺功能亢進癥的最常見原因,占所有患者的50%~80%[1]。甲亢是由于甲狀腺受刺激后產生過多的甲狀腺激素引起內分泌代謝性疾病,臨床主要表現為高代謝癥候群、交感神經興奮癥候群及甲狀腺腫大,部分患者伴有突眼或脛前粘液性水腫[2]。目前,GD 甲亢的發病機制尚不明確,治療手段主要包括抗甲狀腺藥物、放射性碘和甲狀腺切除術,但這3種治療手段均有利有弊。硫化氫(H2S)是繼一氧化氮(NO)和一氧化碳(CO)之后發現的第三氣體調節分子,H2S 在機體大部分組織均可內源性生成,其中以腦、心血管系統、肝臟、腎臟生成最多[3]。近些年來,研究證實H2S具有很好的抗氧化效應,可以有效地保護細胞免受氧化脅迫介導的損害[4-6]。但關于H2S在甲狀腺疾病中特別是Graves 甲亢中的研究報道卻相對較少。因此,本實驗通過構建Graves甲亢小鼠模型來探討H2S對Graves甲亢小鼠甲狀腺功能的影響,以及對H2O2誘導甲狀腺細胞損傷是否具有保護作用。
1 材料與方法
1.1 實驗動物 SPF級6~8 周雌性 BALB/c 小鼠45只,均購自深圳大學實驗動物中心。將小鼠飼養于溫度恒定在(20±3)℃,相對濕度為(40±5)%,每日光照:黑暗時間=12 h:12 h的飼養箱內,飼養環境符合實驗動物環境設施要求,期間小鼠自由飲水攝食。
1.2 主要試劑 Ad-TSHR289重組腺病毒和空載體病毒由武漢維諾賽生物技術有限公司設計構建;NaHS、100 IU/mL青霉素與100 μg/mL 鏈霉素、胎牛血清及DMEM培養基購自美國Sigma公司;甲疏咪唑購自德國默克公司;HE染色、RIPA裂解緩沖液和BCA蛋白檢測試劑盒購自上海碧云天生物研究所;免疫組織化學染色試劑購自上海太陽生物科技公司;抗體NIS、TPO、Tg購自北京中杉金橋生物技術有限公司;抗體PCNA、CyclinD1、GAPDH購自美國 Abcam 公司;HRP標記的山羊抗兔購自上海碧云天生物技術公司;CCK-8試劑盒和Annexin V-FITC/ PI細胞凋亡檢測試劑盒購自南京凱基生物科技發展有限公司;血清TRAb、T4 和 TSH ELISA測定試劑盒購自上海冠導生物工程有限公司;其它試劑均為國產分析純。
1.3 方法
1.3.1 GD 動物模型的建立 將45只BALB/c小鼠隨機分為正常對照組、空載體病毒組和重組腺病毒組,每組15只。重組腺病毒組小鼠采用Ad-TSHR289重組腺病毒進行脛前肌注射誘導GD小鼠模型,于實驗第0、3、6周進行注射,共注射三次。同時,空載體病毒組小鼠注射空載體病毒,正常對照組小鼠注射等體積PBS溶液。飼養至第10 周時采集各組小鼠尾靜脈血,檢測血清促甲狀腺激素受體抗體(TRAb)、甲狀腺素(T4)和促甲狀腺激素(TSH)濃度。
將造模階段正常對照組和空載體病毒組小鼠繼續保留,將GD造模成功[7]的15只小鼠隨機分為3組:模型組(GD)、H2S組及甲疏咪唑組,每組5只。H2S組小鼠予以NaHS 溶液(56 μmol/kg/d)腹腔注射,甲疏咪唑組小鼠予以甲疏咪唑溶液腹腔注射(3.9 mg/kg/d),正常對照組和空載體病毒組小鼠予以等體積 0.9%Nacl 溶液腹腔注射,共干預 4 周。4周后,取各組小鼠血清、甲狀腺組織,進行后續實驗。本實驗研究經醫院倫理委員會批準,符合善待動物的倫理學要求。
1.3.2 血清TRAb、T4 和 TSH測定水平 將采集的靜脈血在室溫下靜置待血液自然凝固分層后,析出少量血清,在離心機3000 rpm下離心10 min,取上清液,按照試劑盒說明書測定血清樣本中TRAb、T4 和 TSH濃度。
1.3.3 甲狀腺組織病理學觀察 小鼠取血后處死,迅速解剖小鼠摘取甲狀腺組織,采用4%多聚甲醛固定甲狀腺組織。固定24 h后,經梯度酒精脫水、二甲苯透明,浸蠟與包埋,使用切片機連續切成厚度為5 μm的切片,進行HE染色,石蠟切片脫蠟水化后,用蘇木素染色5 min,自來水沖洗,1%鹽酸乙醇溶液中分化5 s,自來水沖洗,0.5%伊紅染色2 min,脫水與透明后,中性樹膠封片,在光學顯微鏡觀察并拍照。
1.3.4 免疫組織化學染色 將甲狀腺組織石蠟切片二甲苯脫蠟、梯度乙醇脫水后,在3% 過氧化氫中處理 30 min,高溫(98 ℃)下加熱5 min,加入山羊血清室溫孵育1 h,加入兔抗PCNA(1∶100)、CyclinD1(1∶250),4 ℃孵育過夜。PBS 液洗后,加二抗室溫孵育1 h。滴加 DAB 顯色,自來水洗滌,加蘇木素復染,二甲苯透明,中性樹膠封片,在光學顯微鏡下觀察圖像并拍照,通過ImageJ軟件對免疫組化染色結果圖片進行分析。
1.3.5 Western blot檢測NIS、TPO及Tg蛋白表達 將小鼠甲狀腺組織剪碎,加入RIPA裂解緩沖液進行裂解,4 ℃下12000 r/min 離心20 min,取上清液,通過BCA法測定蛋白質含量。以50 μg蛋白加樣并通過10% SDS-PAGE凝膠分離蛋白質,然后轉移至聚偏氟乙烯膜上。5%脫脂奶粉室溫封閉2 h,TBST洗膜后,加入稀釋后的兔抗NIS(1: 1000)、TPO(1∶1000)、Tg(1∶1000)抗體,以GAPDH(1∶1000)為內參,4 ℃下孵育過夜。次日,TBST洗膜,加入辣根過氧化物酶標記的二抗(1∶5000),室溫下孵育1 h,TBST洗膜后,滴加ECL化學發光液顯色曝光,凝膠成像系統拍照,使用Image Pro-Plus分析系統對蛋白條帶進行分析。
1.3.6 甲狀腺濾泡上皮細胞分離與培養 將小鼠甲狀腺組織剪碎,D-Hanks 液洗滌后,加入含0.25% 胰蛋白酶、250 U/mL Ⅱ型膠原蛋白酶的消化液在37 ℃ 的水浴箱振蕩消化 60 min,以 1000 rpm離心 10 min,棄上清并加入DMEM培養基洗滌沉淀,將離心沉淀反復輕柔吹打均勻,培養于含有100 IU/mL青霉素和100 μg/mL 鏈霉素、100 mL/L 胎牛血清的DMEM培養基中,在37 ℃、5%二氧化碳培養箱中,次日換液,去除未貼壁的細胞,以后2~3 d 更換培養基 1 次,每 5 d 傳代 1 次。通過倒置顯微鏡下觀察細胞形態與生長狀況,培養第10 d時對細胞進行特異抗原NIS免疫熒光染色進行鑒定。
1.3.7 細胞分組與處理 將培養的甲狀腺濾泡上皮細胞隨機分為3組:正常對照組、H2O2組及NaHS+H2O2組,并進行不同處理:正常對照組甲狀腺濾泡上皮細胞正常培養,不進行任何處理;H2O2組使用H2O2(400 μmol/L)溶液處理甲狀腺濾泡上皮細胞24 h; NaHS+H2O2組先用 NaHS (400 μmol/L)預處理甲狀腺濾泡上皮細胞 30 min,再用H2O2(400 μmol/L)溶液處理細胞24 h。
1.3.8 CCK-8檢測細胞活力 取對數生長期的甲狀腺濾泡上皮細胞,調整細胞濃度為1×105個/mL,取100 μL接種于96 孔板培養,在37 ℃、5%二氧化碳培養箱中培養24 h,按照1.3.7進行分組處理后繼續培養至24、48、72 h時,每孔加10 μL CCK-8溶液,再將培養板放在培養箱中培養 2 h,使用酶標儀在450 nm 處檢測各組細胞吸光光度值。
1.3.9 流式細胞術檢測細胞凋亡 將甲狀腺濾泡上皮細胞按照1.3.7進行分組處理后,離心棄去培養基,用預冷的PBS緩沖液洗滌細胞2次,加入500 μL 1×Binding Buffer重懸細胞,在細胞懸浮液加入5 μL Annexin V-FITC和10 μL PI混合均勻,室溫避光孵育30 min,立即用流式細胞儀進行檢測。

2 結果
2.1 各組小鼠血清中TRAb、T4 和 TSH水平比較 與正常對照組比較,重組腺病毒組小鼠血清中TRAb和T4的水平顯著上升,TSH水平顯著下降(均P<0.05),而空載體病毒組較正常對照組血清中TRAb、T4 和 TSH水平差異無統計學意義(P>0.05),這提示GD小鼠模型成功構建,見表1。
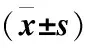
表1 造模第10 周各組小鼠血清中TRAb、T4 和 TSH水平比較
藥物干預4 周后,檢測各組小鼠血清中TRAb、T4和TSH水平。與正常對照組比較,模型組、H2S組和甲疏咪唑組小鼠血清中TRAb和T4的水平顯著上升,TSH水平顯著下降(均P<0.05);與模型組比較,H2S組和甲疏咪唑組小鼠血清中TRAb和T4的水平顯著下降,TSH水平顯著升高(均P<0.05);H2S組和甲疏咪唑組血清中TRAb、T4 和 TSH水平比較,差異無統計學意義(P>0.05),見表2。
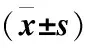
表2 藥物干預4 周各組小鼠血清中TRAb、T4 和 TSH水平比較
2.2 各組小鼠甲狀腺組織病理學變化觀察 正常對照組和空載體病毒組小鼠甲狀腺組織中濾泡呈扁平狀,細胞排列整齊,濾泡腔光滑,可見紅色、均勻的膠質;模型組小鼠甲狀腺組織中濾泡大小不等,濾泡腔不光滑,腔內膠質明顯減少,并出現破裂的現象;H2S組和甲疏咪唑組小鼠甲狀腺組織較模型組甲狀腺組織細胞形態變化得到改善,細胞形態逐漸恢復扁平狀,濾泡腔內的膠質增加,見圖1。

圖1 HE染色觀察各組小鼠甲狀腺組織病理學變化(400×)
2.3 各組小鼠甲狀腺組織中PCNA與CyclinD1表達檢測 與正常對照組比較,模型組小鼠甲狀腺組織中PCNA與CyclinD1陽性表達顯著增加(P<0.05),空載體病毒組較正常對照組差異無統計學意義(P>0.05);與模型組比較,H2S組和甲疏咪唑組小鼠PCNA與CyclinD1陽性表達顯著減少(P<0.05),且H2S組和甲疏咪唑組PCNA與CyclinD1陽性表達差異無統計學意義(P>0.05),見圖2。

圖2 免疫組化染色檢測各組小鼠甲狀腺組織PCNA與CyclinD1表達(400×)
2.4 各組小鼠甲狀腺組織中NIS、TPO、Tg蛋白表達比較 與正常對照組比較,模型組小鼠甲狀腺組織中NIS、TPO與Tg蛋白表達量顯著升高(P<0.05),而空載體病毒組較正常對照組NIS、TPO與Tg蛋白表達量無統計學差異(P>0.05);與模型組比較,H2S組和甲疏咪唑組小鼠甲狀腺組織中NIS、TPO與Tg蛋白表達量顯著下降(P<0.05),見圖3。

圖3 Western blot檢測甲狀腺組織NIS、TPO、Tg蛋白表達
2.5 光學顯微鏡觀察甲狀腺濾泡上皮細胞 通過顯微鏡觀察從小鼠甲狀腺組織分離培養的甲狀腺濾泡上皮細胞,甲狀腺濾泡上皮細胞貼壁式生長,呈梭形、多角形,形態較為均一。免疫熒光染色結果顯示,胞質中可見較強的NIS熒光染色,見圖4。

圖4 甲狀腺濾泡上皮細胞觀察與鑒定
2.6 各組甲狀腺濾泡上皮細胞活力比較 與正常對照組比較,H2O2組甲狀腺濾泡上皮細胞活性在培養24、48、72h顯著下降(均P<0.05);在培養48 h和72 h時,NaHS+H2O2組甲狀腺濾泡上皮細胞活性較H2O2組細胞活性顯著升高(P<0.05),見圖5。

圖5 CCK-8檢測各組甲狀腺濾泡上皮細胞活力
2.7 各組甲狀腺濾泡上皮細胞凋亡比較 與正常對照組比較,H2O2組甲狀腺濾泡上皮細胞凋亡率顯著升高(P<0.05);NaHS+H2O2組甲狀腺濾泡上皮細胞凋亡率較H2O2組細胞凋亡率顯著降低(P<0.05),見圖6。

圖6 流式細胞術檢測各組甲狀腺濾泡上皮細胞凋亡
3 討論
近年來,GD發病率呈不斷上升趨勢,由于其具有病程長、易復發的特點,因此給患者帶來了極大痛苦,并給家庭和社會造成了沉重的經濟負擔[8-9]。在 GD 發病過程中,免疫系統對甲狀腺正常組織成分的免疫耐受狀態被打破,免疫細胞被甲狀腺組織中的特異性抗原激活,產生抗甲狀腺組織的抗體,如針對甲狀腺濾泡上皮細胞 TSH 受體的特異性自身抗體,稱為TRAb[10-11],TRAb 含量的異常增高是GD 的發病關鍵,在發病機制中起著重要作用。此外,T4是甲狀腺分泌的主要激素之一,其分泌量增多也是判斷甲亢發生的重要指標,TSH由垂體前葉嗜堿性細胞合成,是下丘腦-垂體-甲狀腺軸負反饋調節中的重要環節,可調節甲狀腺激素的合成、分泌并促進甲狀腺細胞的生長[12-13]。研究表明,GD過程中,T4、T3過量分泌通過負反饋途徑抑制TSH的合成與分泌[14]。本研究中,通過檢測發現注射Ad-TSHR289重組腺病毒的小鼠血清中TRAb和T4的水平上升,且TSH水平下降,由此說明GD小鼠模型構建成功。
H2S是一種重要的氣體信號分子,與許多生理功能有密切的聯系,其可以通過影響一系列細胞信號傳導過程以調節細胞的功能,具有抗氧化、抗炎癥、降血壓、調節神經功能以及促血管舒張等作用[15-17]。Chen等[18]發現在小鼠急性腎損傷后,H2S 能夠明顯降低細胞內 ROS 水平,抑制炎癥因子 TNF-α和 IL-1的產生。Kang等[19]的研究表明,當大鼠肝臟缺血再灌注后肝臟組織受到氧化損傷,加入NaHS有效地降低組織內炎癥因子 TNF-α和IL-10 分泌水平,同時抑制凋亡相關蛋白 caspase-3 的表達。本研究結果顯示,經過NaHS干預后小鼠血清中TRAb和T4的水平顯著下降,TSH水平顯著升高,且小鼠甲狀腺組織病變得到明顯改善,組織中細胞形態逐漸恢復,且濾泡腔內的膠質增加。同時,通過檢測發現NIS、TPO、Tg蛋白表達水平下降。甲狀腺功能失調是由于碘化物處理障礙導致甲狀腺激素的生物合成出現缺陷,繼而導致先天性甲狀腺功能減退,這也是常見的內分泌疾病[20]。甲狀腺激素的生物合成需要碘化物的存在,NIS、TPO和Tg是甲狀腺素合成過程中的關鍵因子,而NIS、TPO及Tg增加是導致GD患者血清甲狀腺素升高的重要原因。
CyclinD1是調節G1期細胞增殖的主要因子,PCNA是一種內源性增殖細胞相關抗原,PCNA與CyclinD1作為細胞生長的正性調節因子,PCNA羧基端通過與CyclinD1以及CDK結合成為具有活性的復合物,其之間相互協同對細胞由G1期過渡到S期起到了促進作用[21-22]。CyclinD1在甲狀腺乳頭癌中表達增高,且在GD患者和小鼠甲狀腺組織中均發現PCNA表達的增加。本研究結果顯示,在NaHS作用下可抑制GD小鼠甲狀腺組織中PCNA與CyclinD1蛋白的陽性表達。
通過分離小鼠甲狀腺組織中甲狀腺濾泡上皮細胞進行體外實驗,檢測H2S在H2O2誘導的甲狀腺濾泡上皮細胞損傷中的作用,實驗結果顯示,經過NaHS預處理后再經過H2O2作用的甲狀腺濾泡上皮細胞,在培養48 h和72 h時細胞活性明顯高于H2O2組細胞活性,同時抑制了細胞的凋亡。因此,H2S對H2O2誘導的甲狀腺濾泡上皮細胞損傷起到了保護作用。
4 結論
H2S能夠阻止GD小鼠血清中TRAb、T4水平升高及TSH水平下降,抑制甲狀腺組織中PCNA與CyclinD1陽性表達,同時下調NIS、TPO及Tg蛋白表達,以改善甲狀腺組織病變。此外,H2S對 H2O2誘導甲狀腺濾泡上皮細胞氧化損傷具有一定的保護作用。但因GD發病機制復雜,H2S對甲狀腺功能與甲狀腺濾泡上皮細胞的損傷的作用機制還有待進一步深入探討。

